温和灸对自然衰老模型大鼠肝组织Rb、P53、Bcl-2、PKC表达的影响
谭琳蓥 赵天平 国兰琴 赵琛 刘慧荣 朱慧华 崔云华
衰老是生物体各种功能普遍衰弱,以及抵抗环境伤害和恢复体内平衡能力降低的过程[1]。近年来,全球老年人口比重迅速上升[2],探索衰老机理,延缓衰老、防治与衰老相关的疾病、提高老年人的生活质量,对全球的经济发展和卫生事业将带来重大的影响。本研究采用自然衰老大鼠模型,观察温和灸“肾俞”穴对自然衰老大鼠肝组织原癌基因Rb(Rb)、原癌基因P53(P53)、B细胞淋巴瘤/白血病-2(Bcl-2)、蛋白激酶C(PKC)表达的影响,以期进一步探讨艾灸延缓衰老的机制。
1 材料与方法
1.1 实验动物
由上海中医药大学实验动物中心提供的2月龄雄性清洁级SD (Sprauge-Dawley)大鼠共24只,SPF级,体重(160±20)g,适应性饲养1周后,随机分为正常组8只、自然衰老组8只、艾灸组8只。
1.2 主要试剂与仪器
Rb原位杂交试剂盒、P53原位杂交试剂盒、Bcl-2原位杂交试剂盒、PKC原位杂交试剂盒、羊抗兔SABC试剂盒、羊抗小鼠SABC试剂盒、兔抗大鼠Rb多克隆抗体、小鼠抗大鼠P53单克隆抗体、小鼠抗大鼠Bcl-2单克隆抗体、小鼠抗大鼠蛋白酶C单克隆抗体、DAB显色试剂盒等选用武汉博士德生物工程有限公司产品;仪器包括恒温杂交炉(OLS 200)、显微镜(OLYMPUS BH2)、Motic图像分析系统(麦克奥迪实业集团有限公司)。
1.3 造模方法
SD大鼠适应性饲养1周后,在SPF级环境设施中正常饲养20个月,待其自然进入衰老期[4]。
1.4 分组与处理
正常组:正常情况下饲养9周。
自然衰老组:正常情况下饲养20个月。
艾灸组:温和灸肾俞穴[3],每日1次,每次5分钟,5次为一疗程,每疗程结束后休息2天,再进行下一疗程,共治疗20个月。
1.5 标本采集
实验结束后处死各组大鼠,摘取肝脏,分别置于液氮或10%中性甲醛固定液中保存备用。
1.6 检测指标与方法
1.6.1 原位杂交方法检测大鼠肝组织Rb、P53、Bcl-2、PKC mRNA的表达
原位杂交探针由复旦科技有限公司合成。引物序列、探针长度见表1。Rb、P53、Bcl-2、PKC mRNA原位杂交检测按试剂盒说明书进行。
阴性对照:以预杂交液代替杂交液,并完成整个过程。
棕黄色为阳性信号,阴性对照无阳性着色。每张片子随机采集3个视野,运用MOTIC图象分析系统对阳性表达面积和阳性表达光密度进行分析。

表1 Rb、P53、Bcl-2、PKC引物序列与探针长度
1.6.2 免疫组化方法检测大鼠肝组织Rb、P53、Bcl-2、PKC的蛋白表达
Rb、P53、Bcl-2、PKC蛋白免疫组化检测按试剂盒说明书进行。
阴性对照:以抗体稀释液代替第一抗体孵育,并完成整个操作。
棕黄色为阳性信号,阴性对照无阳性着色。每张片子随机采集3个视野,运用MOTIC图象分析系统对阳性表达面积和阳性表达光密度进行分析。
1.7 统计学处理
各组均值以表示,应用SPSS 11.0统计软件,进行单因素方差分析,不符合方差分析条件的,采用秩和检验。
2 结果
2.1 温和灸对自然衰老大鼠肝组织Rb mRNA表达的影响
表2、图1显示,自然衰老组大鼠肝组织Rb mRNA阳性表达面积和阳性表达光密度均显著高于正常组(P<0.01),艾灸组肝组织Rb mRNA阳性表达面积显著低于自然衰老组(P<0.01),但未达到正常水平(与正常组比较P<0.05)。艾灸组肝组织Rb mRNA阳性表达光密度也显著降低(P<0.01),且与正常组比较无显著性差异(P>0.05)。
2.2 温和灸对自然衰老大鼠肝组织P53 mRNA表达的影响
表3、图2显示,自然衰老组大鼠肝组织P53 mRNA阳性表达面积和阳性表达光密度均显著高于正常组(P<0.05,P<0.01),艾灸组大鼠肝组织P53 mRNA阳性表达面积与阳性表达光密度均显著低于自然衰老组 (P<0.05,P<0.01),但均未达到正常水平(P<0.05,P<0.01)。
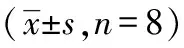
表2 温和灸对自然衰老大鼠肝组织Rb mRNA表达的影响
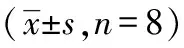
表3 温和灸对自然衰老大鼠肝组织P53 mRNA表达的影响
2.3 温和灸对自然衰老大鼠肝组织Bcl-2 mRNA表达的影响
表4、图3显示,自然衰老组大鼠肝组织Bcl-2 mRNA阳性表达面积和阳性表达光密度均显著低于正常组(P<0.01),艾灸组大鼠肝组织Bcl-2 mRNA阳性表达面积显著高于自然衰老组(P<0.01),但未达到正常水平(与正常组比较P<0.05)。艾灸组大鼠肝组织Bcl-2 mRNA阳性表达光密度也显著增强(P<0.01),且与正常组比较无显著性差异(P>0.05)。
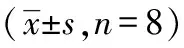
表4 温和灸对自然衰老大鼠肝组织Bcl-2 mRNA表达的影响
2.4 温和灸对自然衰老大鼠肝组织PKC mRNA表达的影响
表5、图4显示,自然衰老组大鼠肝组织PKC mRNA阳性表达面积和阳性表达光密度均显著低于正常组(P<0.01),艾灸组大鼠肝组织PKC mRNA阳性表达面积与阳性表达光密度均显著高于自然衰老组(P<0.01),但均未达到正常水平(P<0.01,P<0.05)。
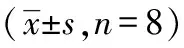
表5 温和灸对自然衰老大鼠肝组织PKC mRNA表达的影响
2.5 温和灸对自然衰老大鼠肝组织Rb蛋白表达的影响
表6、图5显示,自然衰老组大鼠肝组织Rb蛋白阳性表达面积和阳性表达光密度均显著高于正常组(P<0.01),艾灸组大鼠肝组织Rb蛋白阳性表达面积和阳性表达光密度均显著低于自然衰老组(P<0.01),但与正常组比较仍有显著性差异(P<0.01)。
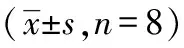
表6 温和灸对自然衰老大鼠肝组织Rb蛋白表达的影响
2.6 温和灸对自然衰老大鼠肝组织P53蛋白表达的影响
表7、图6显示,自然衰老组大鼠肝组织P53蛋白阳性表达面积和阳性表达光密度均显著高于正常组(P<0.01),艾灸组大鼠肝组织P53蛋白阳性表达面积与阳性表达光密度均显著低于自然衰老组(P<0.01),但与正常组比较仍有显著性差异(P<0.01)。
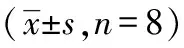
表7 温和灸对自然衰老大鼠肝组织P53蛋白表达的影响
注: 与正常组比较:aP<0.01,与自然衰老组比较:bP<0.01
2.7 温和灸对自然衰老大鼠肝组织Bcl-2蛋白表达的影响
表8、图7显示,自然衰老组大鼠肝组织Bcl-2蛋白阳性表达面积和阳性表达光密度均显著低于正常组(P<0.01),艾灸组大鼠肝组织Bcl-2蛋白阳性表达面积与阳性表达光密度均显著高于自然衰老组(P<0.01),但均未达到正常水平(P<0.01)。
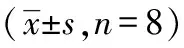
表8 温和灸对自然衰老大鼠肝组织Bcl-2
2.8 温和灸对自然衰老大鼠肝组织PKC蛋白表达的影响
表9、图8显示,自然衰老组大鼠肝组织PKC蛋白阳性表达面积和阳性表达光密度均显著低于正常组(P<0.01),艾灸组大鼠肝组织PKC蛋白阳性表达面积与阳性表达光密度均显著高于自然衰老组(P<0.01,P<0.05),但均未达到正常水平(P<0.05,P<0.01)。
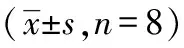
表9 温和灸对自然衰老大鼠肝组织PKC

图1 各组大鼠肝组织Rb mRNA的表达

图2 各组大鼠肝组织P53 mRNA的表达

图3 各组大鼠肝组织Bcl-2 mRNA的表达

图4 各组大鼠肝组织PKC mRNA的表达
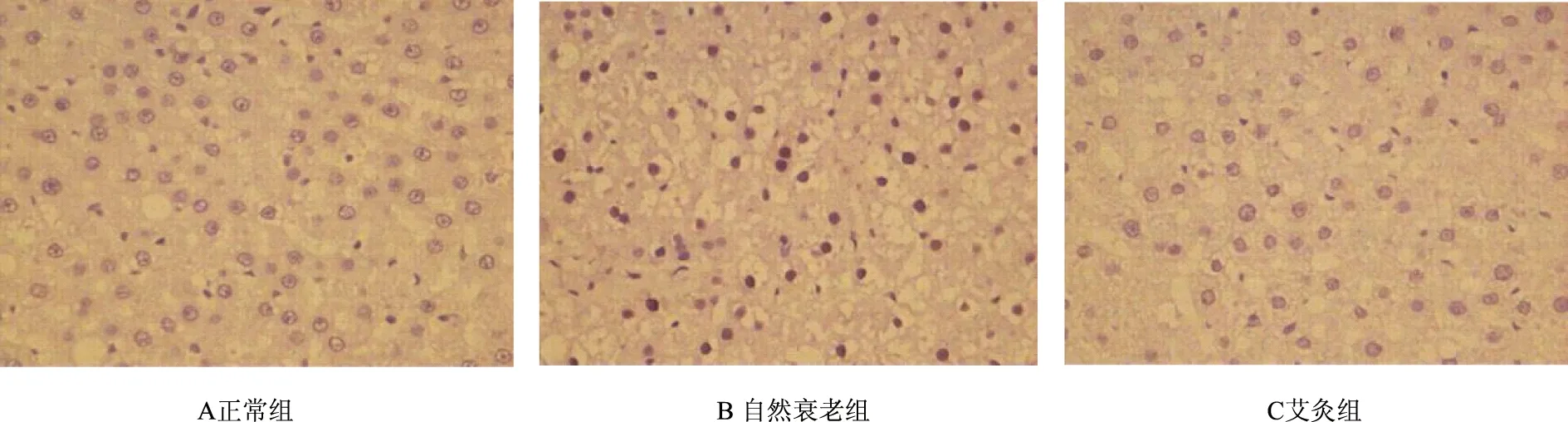
图5 各组大鼠肝组织Rb蛋白的表达

图6 各组大鼠肝组织P53蛋白的表达
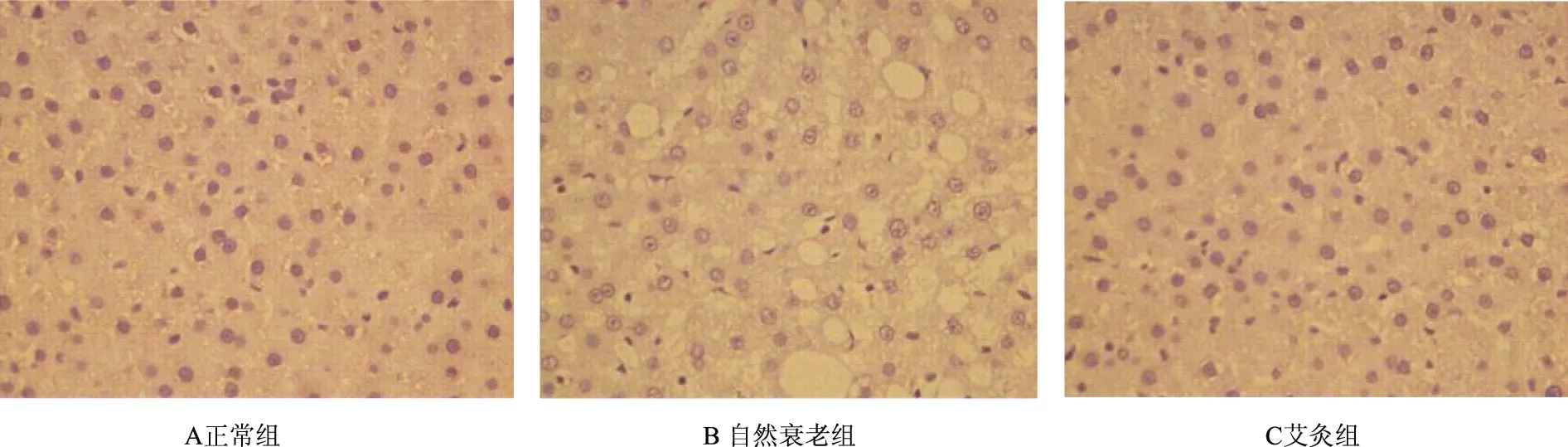
图7 各组大鼠肝组织Bcl-2蛋白的表达

图8 各组大鼠肝组织PKC蛋白的表达
3 讨论
衰老的发生由多种信号触发所致,肿瘤抑制基因是其中之一[4-7]。研究显示:Rb、P53、Bcl-2、PKC与衰老关系密切。Rb、P53是一类负性细胞周期的调控蛋白,为延缓衰老的负相调控因子,抑制细胞增殖,使细胞停滞于G1期,参与细胞周期分裂、衰老与凋亡。在衰老的细胞中,Rb仅以其活性的低磷酸化的生长抑制形式存在[8]。P53是序列特异性转录调控因子,通过直接或间接的方式活化或抑制其靶基因,介导细胞的生长停滞或凋亡。P53 mRNA较高水平表达于衰老细胞[9-12]。有学者研究发现Rb/P53细胞转导通路相关基因及蛋白在衰老大鼠睾丸组织发生明显改变,衰老大鼠睾丸组织P53、Rb基因表达明显高于正常对照组(P<0.01)[13]。本研究结果显示,自然衰老大鼠肝组织Rb、P53 mRNA及蛋白表达均显著高于正常组,Rb、P53 mRNA及蛋白表达与衰老呈负相关;艾灸组(温和灸20个月)大鼠肝组织Rb、P53 mRNA及蛋白表达均显著低于自然衰老组,提示温和灸可抑制衰老大鼠肝组织Rb、P53 mRNA及其蛋白的表达。
Bcl-2、PKC为延缓衰老的正相调节因子,参与细胞的增殖、分化、存活与衰亡的调控。Bcl-2多位于细胞内氧自由基产生较多的位置,如线粒体、内质网和核膜等,与细胞的抗氧化自我保护关系密切。Bcl-2对各种刺激诱导的凋亡有阻抑效应,又称为长寿基因,通常被作为衰老检测的参数指标[14]。在衰老细胞里,Bcl-2表达降低[15-17]。有实验表明Bcl-2的过量表达能使多种造血细胞在去除生长因子后寿命延长[18]。PKC广泛分布于哺乳动物的器官、组织和细胞中,参与多种细胞活动调控[19]。活化的PKC能使蛋白质底物上的丝氨酸或苏氨酸残基磷酸化,是细胞内信号传导过程中的关键分子之一。在衰老细胞内,PKC的功能失调[20,21],在细胞衰老的发生发展中起着决定性的作用[22]。本研究中,自然衰老大鼠肝组织Bcl-2、PKC mRNA及蛋白表达均显著低于正常组;艾灸组(温和灸20个月)大鼠肝组织Bcl-2、PKC mRNA及蛋白表达均显著高于自然衰老组,提示温和灸可促进衰老大鼠肝组织Rb、P53 mRNA及其蛋白的表达。
综上所述,本文研究结果提示:自然衰老大鼠肝组织Rb、P53 mRNA及其蛋白表达升高,Bcl-2、PKC mRNA及其蛋白表达降低。温和灸能抑制Rb、P53 mRNA及其蛋白的表达,促进Bcl-2、PKC mRNA及其蛋白的表达,这可能是温和灸延缓衰老的途径之一。
[1] Tumheim,Klau S.When drug therapy gets old:pharmacokinetics and pharmacodynamics in the elderly[J],Experimental Gerontology,2003,38(8):843-853.
[2] 杨亚玲.人口老龄化的挑战与思考[J].中国卫生事业管理, 1999,8(134);425-427.
[3] 李忠仁.实验针灸学[M].北京:中国中医药出版社,2007:316.
[4] 邹移海,徐志伟,苏钢强,等.实验动物学[M].北京:科学出版社,2004:89-91.
[5] Mallette FA, Goumard S, Gaumont-Leclerc MF, et al. Human fibroblasts require the Rb family of tumor suppressors, but not p53, for PML-induced senescence[J]. Oncogene, 2004,23(1):91-99.
[6] Bischof O, Nacerddine K, Dejean A.Human papillomavirus oncoprotein E7 targets the promyelocytic leukemia protein and circumvents cellular senescence via the Rb and p53 tumor suppressor pathways[J]. Mol Cell Biol, 2005,25(3):1013-1024.
[7] Ohtani N, Yamakoshi K, Takahashi A,et al. The p16INK4a-RB pathway: molecular link between cellular senescence and tumor suppression[J]. J Med Invest, 2004,51(3-4):146-153.
[8] 胡作为, 周燕萍, 沈自尹. P16基因与细胞衰老关系的研究进展[J]. 国外医学:遗传学分册, 2004,27(4):200-202.
[9] Edwards MG, Anderson RM, Yuan M,et al.Gene expression profiling of aging reveals activation of a p53-mediated transcriptional program[J]. BMC Genomics, 2007,(8):80.
[10] Takahashi K, Yoshida N, Murakami N,et al.Dynamic regulation of p53 subnuclear localization and senescence by MORC3[J]. Mol Biol Cell, 2007,18(5):1701-1709.
[11] Wesierska-Gadek J, Wojciechowski J, Ranftler C,et al.Role of p53 tumor suppressor in ageing: regulation of transient cell cycle arrest and terminal senescence[J].J Physiol Pharmacol, 2005,56(1):15-28.
[12] Davis T, Skinner JW, Faragher RG, et al.Replicative senescence in sheep fibroblasts is a p53 dependent process[J].Exp Gerontol, 2005,40(1-2):17-26.
[13] 牛嗣云,陈龙,高福禄,等.p53/Rb细胞转导通路相关基因和蛋白在衰老大鼠睾丸组织的表达[J]. 解剖学报,2008,39(6):841-844.
[14] Königsberg M,López-Diazguerrero NE,Aguilar MC,et al. Senescent phenotype achieved in vitro is indistinguishable,with the exception of Bcl-2 content,from that attained during the in vivo aging process[J].Cell Biol Int,2004,28(8-9):641-651.
[15] Zhang ZB, Cai CY, Tian SP, et al.Lipid peroxidation affects serum T and Bcl-2 expression in the testis of aging male rats[J]. Zhonghua Nan Ke Xue, 2007,13(1):46-49.
[16] Mak YT, Chan WY, Lam WP,et al.Immunohistological evidences of Ginkgo biloba extract altering Bax to Bcl-2 expression ratio in the hippocampus and motor cortex of senescence accelerated mice[J].Microsc Res Tech, 2006,69(8):601-605.
[17] Crescenzi E, Palumbo G, Brady HJ.Bcl-2 activates a programme of premature senescence in human carcinoma cells[J].Biochem J, 2003,375(Pt 2):263-274.
[18] 陈智松,吴志奎,蔡辉国,等.补肾生血药对衰老小鼠Bcl-2mRNA表达的影响[J].中医杂志,2002,43(5):382-384.
[19] Battaini F, Pascale A.Protein kinase C signal transduction regulation in physiological and pathological aging[J].Ann N Y Acad Sci, 2005,1057:177-192.
[20] Van der Zee EA, Palm IF, O'Connor M,et al.Aging-related alterations in the distribution of Ca(2+)-dependent PKC isoforms in rabbit hippocampus[J].Hippocampus, 2004,14(7):849-860.
[21] Centurione L, Di Giulio C, Cacchio M,et al.Correlations between protein kinase C zeta signaling and morphological modifications during rat heart development and aging[J].Mech Ageing Dev, 2003,124(8-9):957-966.
[22] Di Giulio C, Rapino M, Zingariello M,et al.PKC alpha-mediated CREB activation is oxygen and age-dependent in rat myocardial tissue[J]. Histochem Cell Biol, 2007,127(3):327-333.

