冈田酸抑制神经元轴突生长
郑红云 李 艳 童永清
神经元的极性是指绝大多数神经元存在一个长的轴突和几个短的树突。对于一个神经元来说,树突往往是接受信息的部位,轴突往往是输出信息的部位,因此神经元的极性是保证信息在神经系统内部及神经系统与其他系统之间有序流动的物质基础。但是神经元极性形成的分子机制仍是一个有趣且具挑战性的问题。
胎鼠海马神经元培养是研究神经元极性的良好模型[1]。海马神经元极性的建立经历层状伪足、无极性的突起以及轴突和树突形成三个阶段[2]。研究表明,微管对轴突和树突的分化成熟起着关键作用[3];进一步研究揭示微管相关蛋白tau和微管相关 蛋 白 1B(microtubule-associated protein 1B,MAP1B)促进神经元轴突的形成[4];脑衰蛋白反应调节蛋白2(collapsin response mediator protein-2,CRMP-2)可结合管蛋白,促进微管聚集,进而调节轴突和树突极性形成[5]。最近2项研究表明糖原激酶合酶3((glycogen synthase kinase 3,GSK-3()通过调节 CRMP-2磷酸化状态影响神经元极性[6,7]。大量事实表明蛋白质磷酸化状态与神经元极性形成关系密切,而蛋白质磷酸化状态受蛋白磷酸激酶和磷酸酯酶的双向调节。近年来研究报道了激酶对神经元极性的影响,而蛋白磷酸酯酶对神经元极性的影响尚无研究。
本实验采用蛋白磷酸酯酶(PP2A)特异性抑制剂OA在海马神经元极性形成的早期处理海马神经元,探讨PP2A在神经元极性形成中是否起作用,为神经元发生的机制提供新的理论基础。
1 材料与方法
1.1 动物 孕18 d的SD大白鼠(由华中科技大学同济医学院实验动物学部提供)。
1.2 试剂及抗体 OA购于Calbiochem公司(La Jalla,CA,USA),DMSO购于sigma公司。MAP2和Tau-1购于Chemicon公司。
1.3 原代海马神经元细胞的培养 无菌条件下取出孕18 d胎鼠的完整脑组织,剔除脑膜和血管,钝性分离出双侧海马;将海马剪成1 mm3的组织块(以上均在冰上进行),置入解剖液(含3%~6%葡萄糖D-Hanks)中,0.125%胰蛋白酶(Gibco,USA)37℃消化15 min,加入种植培养液(含10%胎牛血清的DMEM培养基)终止反应,滴管吹打后经200目筛网滤过,1500 r/min离心5 min,加入适当的种植培养液重悬,细胞计数,调至1x107/L,接种于预铺多聚赖氨酸的培养板或培养瓶中,于37℃、5%CO2培养箱中培养;12 h后换成维持培养基(含5%小牛血清、2%B27的DMEM培养基)。
1.4 OA处理海马神经元 海马神经元原代培养24 h后分别给予不同浓度的OA处理细胞24 h,普通光学显微镜下观察海马神经元形态变化。
1.5 免疫荧光双重标记 海马神经元原代培养24 h,即给予OA处理细胞24 h后吸出培养基,0.01 M磷酸盐缓冲液(phosphate buffered saline,PBS)漂洗后加入100%甲醇-20 ℃固定5 min,PBS-0.2%Triton漂洗,然后 PBS-0.5%Triton破膜5~10 min,PBS-0.2%Triton漂洗,5%牛血清白蛋白(bovine serum albumin,BSA)封闭1 h,分别滴加鼠抗Tau-1(1∶200)和兔抗微管相关蛋白2(microtubule-associated protein-2,MAP-2)(1∶1000),于4℃孵育过夜,漂洗后加入荧光标记Ⅱ抗于室温孵育1 h,漂洗后于共聚焦显微镜下观察。
1.6 图像分析和统计学处理 采用统计产品与服务解决方案软件(statistical product and service solutions 11.0,SPSS 11.0),全部数据采用平均数±标准差±s)表示,采用Image-Proplus软件统计突起长度。
2 结 果
2.1 正常海马神经元极性形成的形态观察
普通光学显微镜下可见种植4 h后少部分细胞贴壁,细胞表面呈现单个或多个层状伪足;种植12 h后大部分细胞贴壁,多数神经元出现无分支的突起;种植24 h后细胞完全贴壁,可见双突起、三个突起和多个突起的神经元,其中一个突起迅速生长成为轴突;种植48 h后其它的突起发展成为树突,并且突起之间交错成网(图1)。
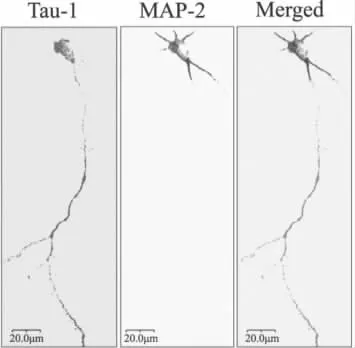
图1 原代海马神经元培养48 h后固定做免疫荧光,分别采用轴突特异性标记物Tau-1和树突特异性标记物MAP2标记神经元(Bar=20μm)
2.2 OA抑制原代海马神经元轴突生成
普通光学显微镜下可见DMSO对照组神经元的轴突和树突已经形成,神经元极性完全建立;采用PP2A抑制剂OA处理24 h后各浓度组神经元突起的生长均受到了不同程度的抑制,且随OA浓度的增加抑制作用逐渐增强,呈现剂量依赖性(图2)。与对照组(平均长度为185μm)相比,不同浓度OA处理后神经元轴突平均长度分别为150μm、100 μm、80μm、75μm、50μm。
3 讨 论
神经元极性形成对其功能的正常发挥至关重要,探索神经元极性形成的分子基础尤为迫切。本实验结果可见正常海马神经元培养48 h后极性已完全形成,而培养24 h后用PP2A特异性抑制剂OA处理后普通光学显微镜下可见随OA浓度的增加,对神经元突起生长的抑制作用逐渐增强,呈剂量依赖性,该结果提示PP2A参与了神经元极性的形成。
OA是一种广泛使用的PP2A选择性抑制剂。最新研究表明OA处理皮质神经元可导致tau蛋白和CRMP-2均发生不同程度的磷酸化,并首次提出CRMP-2磷酸化状态受PP2A活性的调节[8]。微管相关蛋白tau、MAP1B以及CRMP-2可结合管蛋白,促进微管聚集,进而调节轴突和树突极性形成[9,10]。在发育的新生海马神经元轴突末端以及生长锥,tau蛋白、MAP1B以及CRMP-2主要以非磷酸化形式存在[11];GSK-3β磷酸化 CRMP-2降低其与管蛋白的结合能力,抑制微管的聚集和神经元轴突生长[12],而PP2A广泛存在于微管相关蛋白区域[13],可以去磷酸化tau蛋白、MAP1B和 CRMP-2而促进微管聚集。因此,tau蛋白、MAP1B和CRMP-2可能作为PP2A下游靶分子以调节神经元极性。
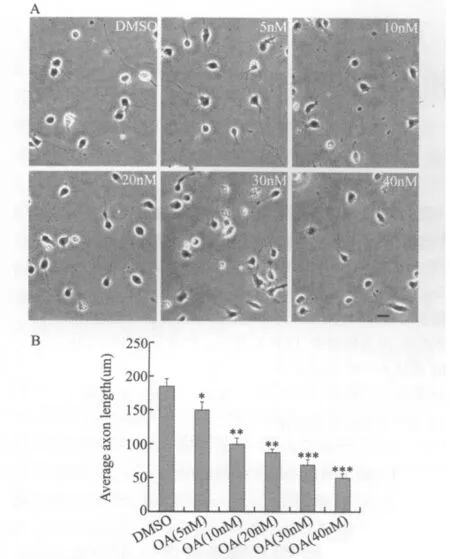
图2 不同浓度OA处理后对神经元轴突形成的影响
在常见神经退行性疾病如Alzheimer病(AD)患者脑中PP2A活性明显降低,tau蛋白以高度磷酸化的形式存在[14],进而出现神经元极性的丧失并最终导致神经元的大量丢失,因此上调PP2A对促进AD患者脑中神经元正常生存意义重大。因此,该研究为神经元极性形成的分子机制提供了新资料,同时为神经退行性疾病的治疗提供了新的理论基础。
1 Arimura N,Kaibuchi K.Neuronal polarity:from extracellular signals to intracellular mechanisms.Nat Rev Neurosci,2007,8(3):194-205.
2 Szu-Yu Ho,Rasband MN.Maintenance of neuronal polarity.Dev Neurobiol,2011,71(6):474-482.
3 Buck KB,Zheng JQ.Growth cone turning induced by direct local modification of microtubule dynamics.J Neurosci,2002,22(21):9358-9367.
4 Tahirovic S,Bradke F.Neuronal polarity.Cold Spring Harb Perspect Biol,2009,1(3):16-44.
5 Arimura N.Role of CRMP-2 in neuronal polarity.J Neurobiol,2004,58(1):34-47.
6 Jiang H,et al.Both the establishment and the maintenance of neuronal polarity require active mechanisms:critical roles of GSK-3beta and its upstream regulators.Cell,2005,120(1):123-135.
7 Yoshimura T.GSK-3beta regulates phosphorylation of CRMP-2 and neuronal polarity.Cell,2005,120(1):137-149.
8 Hill JJ.Identification of okadaic acid-induced phosphorylation events by a mass spectrometry approach.Biochem Biophys Res Commun,2006,342(3):791-799.
9 Hirai S.Axon formation in neocortical neurons depends on stagespecific regulation of microtubule stability by the dual leucine zipper kinase-c-Jun N-terminal kinase pathway.J Neurosci,2011,31(17):6468-6480.
10 Hoogenraad CC,Bradke F.Control of neuronal polarity and plasticity--a renaissance for microtubules?Trends Cell Biol,2009,19(12):669-676.
11 Yoshimura T,Arimura N,Kaibuchi K.Molecular mechanisms of axon specification and neuronal disorders.Ann N Y Acad Sci,2006,1086:116-125.
12 Ni MH.GSK-3 mediates the okadaic acid-induced modification of collapsin response mediator protein-2 in human SK-N-SH neuroblastoma cells.J Cell Biochem,2008,103(6):1833-1848.
13 Awotunde OS.Interaction of maize(Zea mays)protein phosphatase 2A with tubulin.Acta Biochim Pol,2003,50(1):131-138.
14 Small SA,Duff K.Linking Abeta and tau in late-onset Alzheimer's disease:a dual pathway hypothesis.Neuron,2008,60(4):534-542.
——水芹主要害虫识别与为害症状

