CpG ODN诱导人PBMC对结肠癌细胞体外杀伤作用的研究
韩 刚,李金龙,贾明库
(吉林大学第二医院普通外科,吉林长春130041)
大肠癌是最常见的恶性肿瘤之一,目前治疗原则以手术为主。而对于手术切除困难甚至失去手术机会的患者目前仍是困扰临床医生的难题。近年来肿瘤的生物治疗研究较多,并取得了一定的疗效与进步。本文通过观察以CpG ODN为免疫佐剂,联合应用肿瘤冻融抗原和IL-2激活PBMC,对其增殖活性、肿瘤杀伤活性及T亚群活性的影响,探讨CpG ODN作为佐剂在抗肿瘤免疫中的作用,寻找合理的肿瘤免疫治疗方法。
1 材料和方法
1.1 材料
1.1.1病例选择 分别选取本院健康志愿者和结肠癌患者各5人进行采血,量为20 ml,采血后2 h内分离。
1.1.2肿瘤细胞株、CpG2006和IL-2 人结肠癌细胞株SW1116购自吉林省肿瘤研究所;CpG 2006由上海生工生物技术服务公司合成;IL-2购自长生基因药业股份有限公司。
1.2 方法
1.2.1人PBMC的分离 每份血样中加入等量生理盐水混匀稀释,加3 ml淋巴细胞分离液,离心。分离出离心分层后单个核细胞层,另加入RPMI1640后离心,洗涤2次。计算活细胞百分数>95%。
1.2.2肿瘤抗原的制备 SW111细胞培养于含10%FCS的IMDM培养基中,0.25%胰酶消化传代。细胞呈指数期生长时,调细胞浓度1×107/ml,共计8.8 ml。放入液氮中10 min,室温融化,反复5次。4℃离心,15 000 rpm,1 h。收上清。同时将细胞沉淀溶于8.8 ml生理盐水中,超声细胞破碎仪破碎30 min,4℃离心,15 000 rpm,1 h。收上清。两次离心收获的上清混合,-80℃保存备用。用紫外分光光度仪测蛋白浓度。
1.2.3CpG-ODN刺激PBMC对肿瘤细胞的杀伤活性测定 调PBMC细胞浓度为6×106/ml,接种于24孔板,每孔500 μ l,每组2复孔。其中 PHA 10倍稀释 ,每孔加 100 μ l。抗原 3 倍稀释 ,每孔加 100 μ l。CpG-ODN 每孔 加 100 μ l,使其终 浓度 为 10 μ g/ml。IL-2每孔加10 μ l。各组分别补加相应体积的IMDM培养液至 1 000 μ l/孔 。37℃、5%CO2培养 72 h 备用。调SW1116细胞浓度为6×104/ml,接种于96孔培养板,100 μ l/孔。次日待细胞贴壁后加入上述准备好的效应细胞。效靶比50∶1。37℃、5%CO2培养72 h,在培养结束前4小时加入MTT(5mg/ml)20 μ l/孔。培养结束后离心弃上清,各孔加入150 μ lDMSO混匀,酶标仪492 nm波长测A值。
实验分4组:(1)PBMC;(2)PBMC+Ag;(3)PBMC+Ag+IL-2;(4)PBMC+Ag+IL-2+CpG-ODN。
CTL活性计算:CTL活性={1-(实验组A值-效应细胞对照组A值)/靶细胞对照组 A值}×100%。
1.3 统计学处理
应用SPSS11.0软件行t检验。
2 结果
2.1CpG 2006、肿瘤抗原、IL-2共刺激可明显提高PBMC的肿瘤杀伤活性,与单独应用肿瘤抗原组及单独应用IL-2组有显著性差异(P<0.01)。随加入CpG浓度的增加,其肿瘤杀伤活性相应提高,呈线性相关。见表1,表2。
表1 CpG-ODN刺激PBMC对肿瘤细胞杀伤活性的测定(%,s,n=4,正常人组)

表1 CpG-ODN刺激PBMC对肿瘤细胞杀伤活性的测定(%,s,n=4,正常人组)
*与PBMC组相比,P<0.01;**与不加CpG组相比,P<0.01
组别 A值(s)PBMC 31.46±6.93 PBMC+Ag 36.04±7.57 PBMC+Ag+IL-2 46.61±0.60*PBMC+Ag+IL-2+CpG-ODN 77.86±0.58**
表2 CpG-ODN刺激PBMC对肿瘤细胞杀伤活性的测定(%,s,n=4,肿瘤组)

表2 CpG-ODN刺激PBMC对肿瘤细胞杀伤活性的测定(%,s,n=4,肿瘤组)
*与PBMC组相比,P<0.01;**与不加抗原组相比,P<0.05
组别 A值(s)PBMC 27.63±1.38 PBMC+Ag 33.59±0.72*PBMC+Ag+IL-2 47.54±1.67*PBMC+Ag+IL-2+CpG-ODN 77.71±1.60**
2.2正常人与肿瘤病人的PBMC均可被我们采用的不同干预手段激活。相同干预手段,各实验组无明显差异(P>0.05)。见表3。
3 讨论
近年来,我国结肠癌的发病率逐年增高[1]。目前的治疗手段主要是以手术为主,辅以全身的放疗和化疗,但术后易复发和肝转移。随着免疫学的发展,人们对恶性肿瘤的免疫逃逸机制和机体的抗肿瘤免疫机制的认识不断深入,免疫治疗的作用越来越受重视[2]。有研究表明,肿瘤患者可通过免疫效应机制发挥抗肿瘤作用。当宿主免疫功能低下或受抑制时,肿瘤的发病率增高;而在肿瘤进行性生长时,患者的免疫功能也受到抑制[3]。我们实验表明无论是正常人还是肿瘤病人的外周血淋巴细胞均可被冻融抗原、IL-2或CpGODN所激活而表现出较强的肿瘤杀伤活性。而冻融抗原、IL-2或CpGODN共同刺激组杀伤活性提高最为明显,且与CpG浓度呈正相关,说明三者在免疫刺激机制上能够协调、互补。用肿瘤冻融抗原进行主动免疫是一种比较理想的免疫治疗方法。理论上应该可以激发全身细胞免疫功能,诱发长期免疫,但实际效果很难达到。IL-2是参与免疫应答的一种重要的细胞因子,可以促进T细胞增殖及产生细胞因子,促进B细胞增殖和分泌Ig,激活巨噬细胞,增强NK细胞的活化与增殖。CpG2006属于B型CpGODN,能够直接激活单核细胞、巨噬细胞和树突状细胞,引起这些细胞分泌IL-12、TNF-α等Th1样细胞因子,并刺激细胞表面分子MHC-Ⅱ 、B7-1、B7-2的表达 。除此之外,CpG2006还可以有效地激活获得性免疫[4,5],在Th1细胞因子的作用下显著增强获得性细胞免疫。联合应用冻融抗原、IL-2或CpGODN增强PBMC抗肿瘤作用可能的机制为:联合刺激可以多途径增强天然免疫,调节多种细胞因子的释放,形成良好的免疫微环境;活化的肿瘤特异性淋巴细胞在微环境中进一步活化,激活其他免疫细胞或增强自身抗肿瘤免疫功能,使免疫原性较弱的肿瘤抗原能被免疫系统识别,诱导产生CTL并增强ADCC作用,有效地杀伤肿瘤细胞。
表3 CpG-ODN刺激PBMC对肿瘤细胞杀伤活性的测定(%,s,n=4)
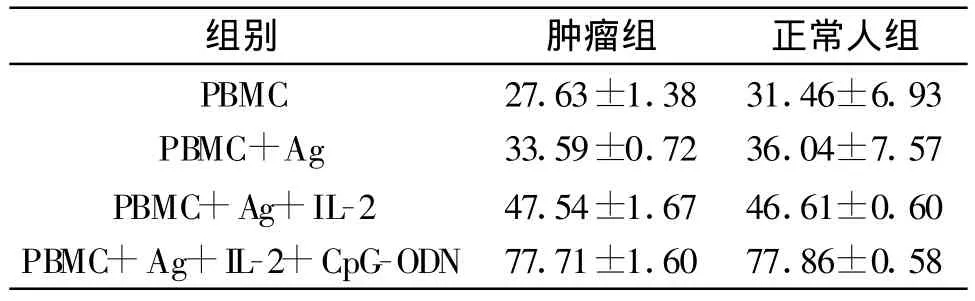
表3 CpG-ODN刺激PBMC对肿瘤细胞杀伤活性的测定(%,s,n=4)
组别 肿瘤组 正常人组PBMC 27.63±1.38 31.46±6.93 PBMC+Ag 33.59±0.72 36.04±7.57 PBMC+Ag+IL-2 47.54±1.67 46.61±0.60 PBMC+Ag+IL-2+CpG-ODN 77.71±1.60 77.86±0.58
[1]《2008年我国卫生事业发展统计公报》.中华人民共和国卫生部.
[2]Hall SS.Acommotion in the blood:Life,death,and the immune system.Sloan Technology Seris[M].New York:Henry Holland Company,1997:538.
[3]Cerottini JC,Brunner KT.Cell-mediated cytotoxicity,allograft rejection,and tumor immunity[J].Adv Immunol,1974,18:67.
[4]Y Naito,K Saito,K Shiiba,et al.[J].Cancer Res,1998,58:3491.
[5]Krieg AM.CpG DNA induce sustained IL-12 expression in vivo and resistance to Listeria monocyto genes challenge[J].Immnol,1998,161:2428.

