假丝酵母SSR-PCR反应体系的优化
孙晓红,杨艳秋,贺 丹,张云峰,横山耕治,王 丽*
(1.吉林大学白求恩医学院病原生物学系,吉林长春130021;2.北华大学基础医学院;3.吉林大学第一医院;4.日本千叶大学真菌医学研究中心)
微卫星(Microsatellite)又称为简单序列重复(Simple sequence repeats,SSR),是指基因组中由l-6个核苷酸为基本单位的串联重复序列构成的一段DNA。广泛分布于真核生物基因组中,由于其在群体中的多态性高,且一般为共显性遗传,已成为一种很好的分子遗传标记。目前在真菌的研究中,SSR主要用于种群遗传多样性、近缘种间及种内的系谱研究、基因分型等[1-4]。
近年来,医院内真菌感染日益增多,且主要表现为条件致病真菌感染。其中,假丝酵母居于第一位,但在国内及国外的多项研究中,检出的假丝酵母各菌种的构成比有很大差异[5,6]。为了追溯感染的来源,更有利于真菌感染的治疗,有必要使用分子生物学方法对假丝酵母进行正确的鉴定。以PCR为基础的SSR技术,因其对DNA质量要求不高及引物的通用性好等特点,对菌种的鉴定具有特殊意义[7,8]。本研究确定了SSR-PCR反应最适的退火温度,利用正交实验优化反应体系,建立了最佳的SSR-PCR反应体系。旨在为将该技术用于临床假丝酵母感染的快速鉴定奠定基础。
1 材料与方法
1.1 菌株
热带假丝酵母(Candidaparapsilosis)(JLCC33785)为SSR-PCR反应体系优化试验菌株,所用菌株由吉林大学真菌研究中心菌种保藏中心(Culture Collection of Jilin University Mycology Research Center,JLCC)保藏。
1.2 主要试剂及仪器
SSR引物由本实验室设计,宝生物(大连)工程有限公司合成;dNTP、Taq DNA聚合酶和DNA marker购自宝生物(大连)工程有限公司;美国ASTEC基因扩增仪PC-320。
1.3 基因组DNA提取
采用Gene TLETM酵母菌DNA快速抽提方法并进行改进[9]:①取 100-200 mg菌丝体,加入540 μ l SolutionⅠ ,混匀 ;②加入 60 μ l SolutionⅡ ,混匀 ,95 ℃金属浴10 min;③加入300 μ l Solution Ⅲ,颠倒混匀,冰浴 2 min;④12 000 rpm 、4℃离心 10 min,取 600 μ l上清于一新EP管中;⑤加入等体积异丙醇,混匀,12 000 rpm、4℃离心 5 min,弃上清 ;⑥加入 200 μ l-20℃的70%冷乙醇洗涤,12 000 rpm、4℃离心5 min,弃上清;⑦沉淀物置于离心浓缩仪中真空干燥;⑧获得的DNA,加入40 μ l ddH2O 溶解,-20℃保存备用。
1.4 PCR反应条件
根据引物Tm值,设立6个梯度的退火温度,依次为 48℃、49℃、50℃、51 ℃、52℃、53℃。PCR 反应条件为94℃预变性2 min;94℃变性1 min,退火1 min,72℃延伸 90 s;40个循环,最后72℃延伸10 min,PCR产物4℃保存备用。取反应产物10 μ l,于1.5%的琼脂糖凝胶电泳,EB染色30 min,置于凝胶成像系统下观察拍照。
1.5 SSR-PCR反应体系的优化
以Taq DNA聚合酶、模板DNA、dNTP、引物为实验因素,进行4因素3水平的正交实验优化反应体系(表1),即选用L9(34)正交表进行9种组合的实验(表2)。

表1 SSR-PCR反应体系正交实验的水平和因素

表2 SSR-PCR反应体系正交实验设计表L9(34)
2 结果
2.1 退火温度对SSR-PCR反应的影响
退火温度将会直接影响PCR扩增的结果。为此,本研究根据理论Tm值将退火温度分别设置为48℃、49℃、50℃、51℃、52℃、53℃。其结果明显不同:泳道1、2、3扩增的非特异条带多,背景弥散;泳道4扩增的条带清晰,多态性好;泳道5扩增的条带明亮,但多态性低;泳道6几乎没有扩增出条带。所以选择泳道4对应的51℃为最适退火温度(图1)。
2.2 正交实验优化SSR-PCR反应体系
通过4因素3水平的正交实验,共9种组合,对SSR-PCR反应体系进行了优化。每一组合的结果存在显著差异,泳道1没有扩增出条带;泳道2扩增条带弱;泳道3、4、8扩增的条带较亮,但多态性低;泳道5、6、7、9扩增条带均较清晰,多态性高,其中以泳道6的效果最好;对泳道5、6、7、9的反应体系进行比较,确定泳道6各因素浓度作为最佳的反应体系:25μ l SSR-PCR反应体系中,加入Taq DNA聚合酶1.0 u 、模板 DNA 为 25 ng、dNTP 为 0.15 mmol·L-1、引物为 0.5 μ mol·L-1(图 2)。
2.3 模板浓度对SSR-PCR反应体系的影响
在正交实验中确定了最佳的模板用量为25 ng,为3水平中的最高值。为了验证SSR反应体系的灵敏度,设置了不同的模板梯度,依次为5 ng、10 ng、15 ng、20 ng、25 ng、30 ng、35ng。电泳结果表明,泳道1、2扩增的条带相对较弱;泳道 3、4、5、6扩增的条带较亮且清晰,且以泳道5、6扩增的效果好,这和正交实验中确定的模板用量基本一致;泳道7扩增的条带较亮,但多态性低(图3)。
2.4 反应体系的稳定性验证
使用优化的SSR-PCR反应体系及条件,对6株临床分离鉴定的热带假丝酵母进行PCR扩增,1.5%琼脂糖凝胶电泳后均得到明亮、清晰、多态性稳定的条带,长度分别约为480 bp、750 bp、1750 bp,证实该体系具有较好的的稳定性(图4)。
3 讨论
SSR作为一种很好的分子遗传标记,其高度的多态性优于 RFLP、重复性强于RAPD。对于SSRPCR技术,其结果多用聚丙烯酰胺凝胶电泳进行检测,虽分辨率高,但操作复杂、成本较高。本研究使用SSR引物进行PCR扩增,采用1.5%的琼脂糖凝胶电泳观察结果,可得到清晰稳定的多态性条带,操作简单,在普通实验室易于开展。
PCR反应受许多因素影响,退火温度的高低会直接影响PCR扩增结果。温度过低非特异条带多,温度过高会影响引物和模板的结合,甚至无PCR产物扩增。本研究设置48℃~53℃6个梯度的退火温度,其中,51℃扩增的条带清晰、明亮,将其作为最适的退火温度。这说明每一引物,有其适宜的退火温度。
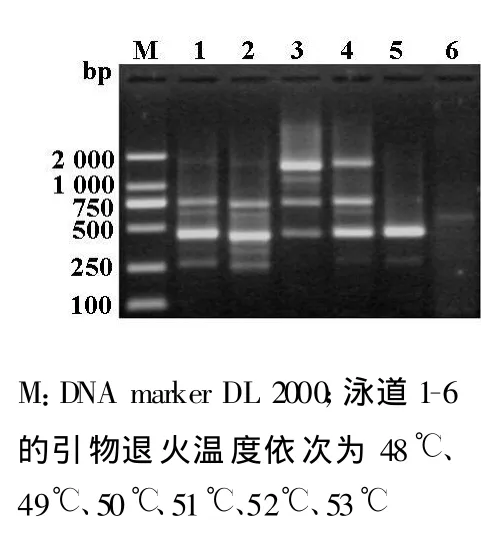
图1 退火温度对SSRPCR反应的影响

图2 正交实验SSR-PCR反应体系优化的电泳图
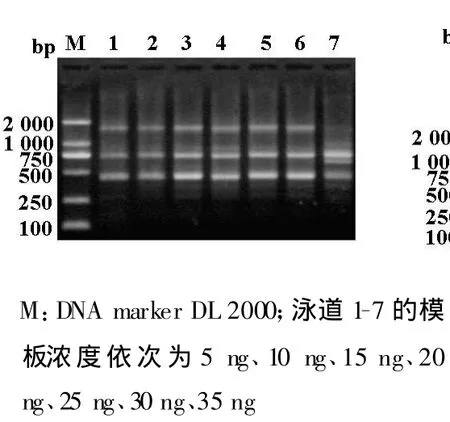
图3 模板浓度对SSR-PCR反应体系的影响

图4 临床菌株验证反应体系的稳定性
本研究采用4因素3水平的正交实验,对SSRPCR反应体系进行优化,建立了最佳的反应体系,在动态环境中考虑到PCR反应各因素的相互作用。因为各因素浓度过低时,可能无法扩增出产物;浓度过高时,非特异性条带可能增多及出现弥散状背景[10]。dNTP既是PCR反应的原料,又可以与PCR反应中的Mg2+结合,如 dNTP浓度过高,使Mg2+浓度下降而影响Taq DNA聚合酶的活力;另外,引物浓度过高,易引起非特异性扩增及形成引物二聚体[11]。从节约的角度考虑,只要能扩增出清晰、明亮、稳定、多态性高的条带,Taq DNA聚合酶、模板DNA、dNTP、引物的用量应越低越好,在图 2中,泳道 5、6、7、9扩增的条带均较亮且清晰,但综合考虑各因素的浓度,选择泳道6对应的各因素浓度作为最佳的SSR-PCR反应体系。
在确定的最佳SSR-PCR体系中,模板DNA为25 ng,为3水平中的最高值。所以我们又设置7个梯度的模板浓度,浓度为5 ng-30 ng时,基本上均可得到清晰的电泳条带。这说明模板浓度对该反应的影响不大及PCR反应的高灵敏性,也证实通过变换某单一因素而固定几种其他因素来确定PCR反应体系的局限性。
综上分析,采用正交实验优化的SSR-PCR反应体系,操作简便,电泳条带清晰,多态性好,重复性强。为将本实验室设计的SSR引物,进一步用于假丝酵母的鉴定奠定基础。
[1]Giraud T,Fournier E,Vautrin D,et al.Isolation of 44 polymorphic microsatellite loci in three host races of the phytopathogenic fungus Microbotryum violaceum[J].Molecular Ecology Notes.2002,2(2):142.
[2]Barve MP,Haware MP,Sainani MN,et al.Potential of microsatellites to distinguish four races of Fusarium oxysporum f.sp.ciceri prevalent in India[J].Theoretical and Applied Genetics,2001,102(1):138.
[3]Dea Garcia-Hermoso,Odile Cabaret,Gael Lecellier,et al.Comparison of Microsatellite Length Polymorphism and Multilocus Sequence Typing for DNA-Based Typing of Candida albicans[J].Journal of ClinicalMicrobiology,2007,45(12):3958.
[4]Brent A.Lasker,Geraldine Butler,andTimothy J.Lott.Molecular Genotyping of Candida parapsilosis Group I Clinical Isolates by Analysis of Polymorphic Microsatellite Markers[J].Journal of Clinical Microbiology,2006,44(3):750.
[5]方 芳,伊和姿,吴丽桂.危重病人203例深部真菌感染的调查研究[J].皮肤病与性病,2005,27(1):6.
[6]Agarwal J,Bansal S,Malik GK,et al.Trends in neonatal septicemia:emergence of non-Candida albicans[J].Indian Pediatr,2004,41(7):712.
[7]Meyer W&Mitchell TG.Polymerase chain reaction fingerprinting in fungi using single primers specific to minisatellites and simple repetitive DNA sequences:strain variation in Cryptococcus neoformans[J].Electrophoresis,1995,16(9):1648.
[8]Barada G,Basma R,Khalaf RA.Microsatellite DNA identification and genotyping of Candida albicans from Lebanese clinical isolates[J].Mycopathologia,2008,165(3):115.
[9]Wang L,Yokoyama K,Miyaji M,et al.Mitochondrial cytochrome b gene analysis of Aspergillus fumigatus and related species[J].J Clin Microbiol,2000,38(4):1352.
[10]张文娜,王 忆,孔 瑾,等.甜樱桃品种SSR-PCR反应体系的优化[J].生物技术通报,2009,11:103.
[11]韩加军,林英任,刘艳兵,等.散斑壳属ISSR-PCR反应条件的优化[J].微生物学杂志,2008,28(1):20.

