放养密度对网箱养殖黄鳝生长的影响
储张杰,钟爱华,方 芳,蒋天水,吴 智,王小军
(1.浙江海洋学院水产学院,浙江舟山 316004;2.乐清市海洋与渔业局,浙江温州 325603;3.舟山市普陀区海洋与渔业局,浙江舟山 316000)
密度是影响鱼类生长的重要因子。已有研究表明密度对鱼类生长有负影响[1],但也有研究表明密度对生长没有负影响[2],或在某一临界水平以上产生影响[3-4]。密度的影响在鱼的不同发育阶段也不同,DRUMMOND等[5]在幼湖红点鲑Salvelinus namaycush中发现了密度阻碍生长,但在成鱼中没有发现。鱼处在高密度环境中被普遍认为暴露于一系列复杂的相互作用的因素中,许多可能的因素,单独或一起影响鱼的生长,因此探讨鱼群密度对生长的影响机制就较为复杂且尤为重要。EL-SAYEDA等[6]的工作表明,密度对生长的影响不一定是由摄食引起的,也可能是通过代谢消耗的改变。他们把生长和摄食率的数据与生物能量学模型结合来估计活动率,得出生长率随密度增加而下降可以解释为增加了摄食耗能及与社会相互作用相关的耗能活动水平,由此导致食物转化率的降低。但EMATA等[7]认为持续提供食物也不能完全补偿密度相关的生长下降,这可能是由于其它压力和相互作用的影响,倾向于降低摄食和食物转化效率,因此持续提高黄鳝的养殖密度对生长会产生负影响。然而,FERNANDEZ PALACIOS[8]报道,在高密度养殖环境下虹鳟Oncorhynchus mykiss依然保持生理方面正常的摄食行为,因此认为食物转化率的降低不足以解释高密度组中鱼的生长减慢现象。在这方面要更多研究,以便更准确地考察密度对黄鳝生长的影响。
黄鳝Monopterus albus俗称鳝鱼,是我国主要名优淡水水产品之一。由于肉质鲜美、营养价值高,它既是中老年人滋补的佳品,也是青少年摄取DHA、促进大脑发育的最佳食品[9]。此外,黄鳝还有抗病、养颜和强身等多种功效,国内外市场前景广阔。近几年来,由于捕捞黄鳝工具的优化,捕捞黄鳝的强度加大,加上农药的大量使用,造成黄鳝的天然资源锐减,解决黄鳝供不应求的惟一办法是人工养殖。目前国内外成功率高、效益好的方式多采取网箱高密度投饵养鳝。在生产中,增加放养密度能有效提高单位水体产量,但放养密度过高,势必会对鱼类造成胁迫,引起鱼体内生理状态的紊乱。另一方面,随着养殖规模和强度的不断扩大,未食的残饵以及养殖体的排泄物等对养殖水体及周围水环境的影响越来越突出,结果导致鱼病增加,养殖水体富营养化,最终使得黄鳝生长停滞,养殖不能继续[10-11]。另外,目前国内的黄鳝网箱养殖的放养密度完全凭借经验,没有规范的标准,不合理的放养密度往往对养殖效果带来不利的影响。因此研究密度对黄鳝生长的影响在生产实践中具有重要意义。
1 材料与方法
1.1 实验动物
黄鳝来源于舟山市当地农户捕捞的野生鳝鱼,体重要求和国内目前网箱养殖黄鳝的放养规格相近,本次实验所选鱼基本在 25 g左右,实际测得的体长为(27.4±4.1)cm,体重为(24.01±1.95)g。
1.2 实验条件
试验塘位于舟山市定海区北禅乡钓琅湾休闲农庄,为东西向,规格为41.6 m×60 m,平均水深1.6 m。试验塘设置网箱15个,由40目聚乙烯网片制成,规格为1.2 m×2.5 m×1.2 m,其中每组网箱的间距为3 m,组内相邻网箱的间距为1.2 m。放养前池塘先清淤,后暴晒1个月,再注水10 d后用1 g/m3的漂白粉消毒。放苗前15 d投入水花生作为黄鳝的附着物,投入的水花生占网箱总面积的60%~70%。在池塘两端分设进水口和排水口。
1.3 试验时间与饲养管理
试验时间为2009年6月30日-2009年10月30日。于2009年6月30日放养鳝种,因黄鳝入池后有一个适应过程,这期间会拒食。因此,一般在鳝种入池前进行驯食。驯食的方法:在黄鳝饥饿2 d后,起先用少量的鱼糜进行驯饵,当黄鳝摄食正常后,鱼糜逐步减少。第1天投食量只能占幼鳝体重的0.1%~0.5%,待第2天早晨观察,若食物全部吃完,则第2天增加1/5配合饲料(蛋白质含量约35%),若食物未全部吃完,则继续按原来的比例进行投喂,直至食物完全吃完后再增加。到幼鳝完全正常摄取配合饲料8~10 d后,这时的饲料改为鱼糜和颗粒料各占50%,以后投喂直到实验结束一直按照这一比例投喂,中途不再改变。根据黄鳝的摄食规律,按黄鳝体重的2%~3%将配合饲料投喂在水花生的表面,坚持“四定”原则,每天17:00~18:00投喂:1次,以不剩为宜。每3天加注新水1次,每10天用漂白粉化水泼洒,泼洒的浓度为1 g/m3。具体投喂量根据天气变化和实际摄食情况而定,每天观察黄鳝的活动情况,防逃、防病害。
1.4 实验设计
实验设Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ 5 个密度组,分别为 15 尾/m2、25 尾/m2、35 尾/m2、45 尾/m2和 90 尾/m2,组内设3个重复。随机挑选规格相近的健康苗种放入试验箱中,测量各组黄鳝苗的初始体长和体重,每个月的30日在每只网箱中随机取3尾测量体长和体重,每次测量均安排在下午喂食前。
1.5 数据处理
黄鳝的生长指标用生长离散(SV)、增长率(GBL)和增重率(GBW)表示,计算公式[18]:
GBL=100×(L2-L1)/L1
GBW=100×(W2-W1)/W1
大小变动系数SV=100×SD/X
式中W1,W2为某一时间段开始和结束时的平均体重(g),L为体长(cm),SD为标准差,X为平均体重。
不同密度条件下饲养黄鳝所测得的数据先作单因子方差分析(ANOVA),如果差异显著(P<0.05),再进一步用Duncan氏法进行多重比较。所有数据分析均在SAS system for windows V8软件包上进行(SAS institute,Cary,NC,USA,1999)。
2 结果与分析
2.1 不同养殖密度下黄鳝的生长情况
2.1.1 养殖密度与体重、GBL及GBW
不同密度组黄鳝体重的生长情况如图1所示。从图1可以看出:刚开始各实验组中黄鳝的体重都有一个呈指数增长的过程,随着实验时间的推移,生长逐渐缓慢趋于平稳,期间甚至出现负生长,之后又出现一个生长高峰。数据显示,不同密度组的黄鳝体重增长速度不同,养殖密度对黄鳝的生长存在显著影响(P<0.05),放养密度为35尾/m2,45尾/m2的实验组体重增长速度较快,其最终体重、GBW显著高于低密度组15尾/m2和高密度组90尾/m2。其中35尾/m2增重率达到374.70%,而最低密度组15尾/m2和高密度组90尾/m2增重率仅为109.89%和149.67%(表1)。
2.1.2 养殖密度与体长
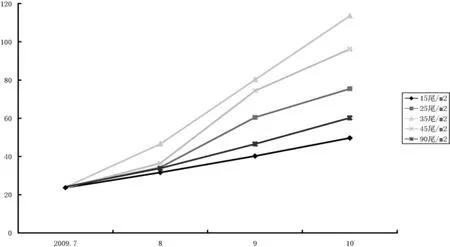
图1 不同密度组黄鳝体重的生长曲线Fig.1 Weight growth curves of M.albus under different treatments
养殖密度与体长的关系如图2所示。从图2可以看出,刚开始各密度组黄鳝体长增长都很快,随着时间的推移,各组体长出现差异。其中35尾/m2密度组体长增加幅度最大,15尾/m2密度组生长缓慢。这与体重的增长趋势呈现一致性。密度对黄鳝的生长有显著性影响(P<0.05)。高密度组90尾/m2的体长低于35尾/m2。研究发现,放养密度对生长的影响在不同范围内存在明显差异,在一定密度范围内,放养密度与生长呈负相关,放养密度越大,个体生长越慢,增长率35尾/m2>45 尾/m2>90 尾/m2。而超过这个范围,密度与生长的关系发生变化,增长率15尾/m2<25尾/m2<35尾/m2(表1)。

图2 不同密度组黄鳝体长的生长曲线Fig.2 Length growth curves of M.albus under different densities
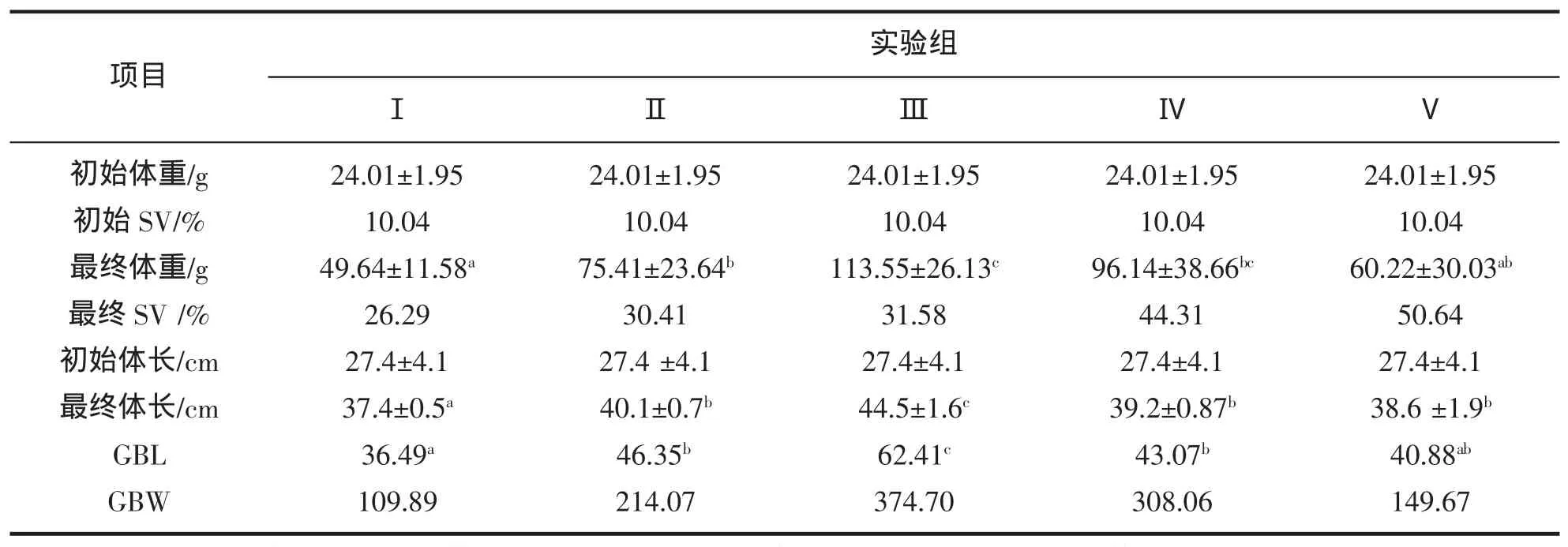
表1 不同养殖密度下黄鳝的生长参数(平均值±标准差)Tab.1 Growth parameters of M.albus at different rearing densities(means±sd)
2.2 养殖密度对生长离散的影响
由表1可知,各密度组的体重大小变动系数SV在实验前后发生了显著变化,随着养殖密度的上升,各密度组的SV显著上升。这可能是养殖密度过大导致种内对空间和食物的竞争更激烈,使生长优势鱼得到更多的资源,生长速度较快,而生长劣势鱼一直处于能量不足状态,导致差距逐渐增大。
3 讨论
本研究表明,网箱养殖黄鳝存在一个合适的放养密度,当密度为35尾/m2能够取得较好的养殖效果,密度过低或过高都不利于黄鳝的生长。这与MOCHIZUKI等[12]对银大麻哈鱼Oncorhynchus kisutch,VIJAYAN等[13]对溪红点鲑Salvelinus fontinalis和庄平等[14]对史氏鲟Acipenser schrenki稚鱼的研究结果密度与生长呈负相关有所差异。此次实验显示,放养密度过低、个体增重、GLB和GBW会减少,这可能是因为群体内毫无竞争,个体抢食差,食欲降低,因此生长缓慢。FISHELSON等[15]认为,同种的群居性相互作用对个体生长能产生正的或负的影响,许多环境因素可能改变群居相互作用的消耗和益处的平衡,密度通过社会和行为方式对鱼的生理产生更多的影响,这种复杂的行为因素和社会性导致的压力对受压迫鱼表现出生理干扰,从而最终影响生长。高密度养殖环境子下虹鳟的血浆中皮质醇水平会显著上升,8天后恢复到原来的水平。MOCHIZUKI等[12]发现,尽管高密度环境中生长的银大麻哈与血浆中皮质醇水平同低密度组相比无显著差异,但是高密度水平鱼体内的皮质醇清除速度要快一些,估计这也是由于皮质醇的代谢途径发生变化所致。
KLOC等[16]认为由于鱼群密度增加,导致对食物空间的相互竞争,加速了鱼的大小分布的差异和不对称,从而有可能建立社会等级制度使生长不均匀。与密度相关的社会行为对鱼类的摄食率和食物转化率有影响,从而可能影响其生长率。VIJAYAN等[13]的研究也表明溪红点鲑的摄食率和食物转化率与密度呈负相关;MOCHIZUKI等[12]报道了银大麻哈鱼的密度增加食物转化率下降。
当养殖密度过大,超过养殖容量时,养殖生物不能得到繁殖生长所需的正常营养物质而长期处于体弱状态,养殖生物体逐渐小型化。一般认为,随着养殖密度的增加,单位水体的产量也随之上升,但随着养殖密度的继续上升,DO消耗,残饵以及代谢废物(二氧化碳.氨态氮等)增加,出现水质恶化,不良水体环境对鱼类的胁迫现象,从而使鱼类活动耗能增加,饵料消耗率下降最终对生长产生消极的影响。
IZQUIERDO等[2]及JANG等[4]对不同密度水平下生长的溪红点鲑的肾间组织离体培养,对其分泌活性进行的研究发现,高密度下生长的溪红点鲑的肾间组织皮质醇激素的分泌活性显著升高。不同密度下血浆中皮质醇的代谢途径会改变。密度胁迫作用较弱的情况下,皮质醇主要通过鳃上皮进行代谢清除;而在高密度胁迫作用下,肝脏对皮质醇的摄取量显著增加。庄平等[14]也报道了拥挤会对鱼类的生长产生消极影响。朱勇夫等[17]对罗氏沼虾Macrobrachium rosenbergii的研究表示:投放密度大的试验池亩产量高,但是成虾规格小,且高密度试验池出现缺氧泛池的几率大,因此要适当控制放养密度。方差分析结果显示:本实验单位养殖水体存在一个最适养殖容量。王小兵等[18]也指出南美白对虾Penaeus vannamei存在一个最适放养密度。本实验的最适养殖容量为35尾/m2。放养密度小于最适养殖容量时,随放养密度的增加,生长速度会快速上升,但在放养密度超过最适养殖容量后,随着养殖密度的增加生长速度逐渐减缓。
从生长离散来看,黄鳝放养密度越大,个体之间规格差异越大。可能由于鱼群密度增加,导致对食物和空间的竞争,加速了鱼的大小分布的差异和不对称,从而有可能建立社会等级制度,使生长不均匀。在本实验中高密度组内个体之间体重差异较大,表明密度使黄鳝形成了等级结构或竞争行为,这与KLOC等[16]的研究结果相一致,但庄平等[14]在密度对史氏鲟生长影响的研究中发现,SV在实验前后未发生显著性变化,最终SV反而比初始的小,说明通过提供良好的水质条件,会减少密度对生长离散的影响。在本实验后期,随着黄鳝放养密度增大,高密度组由于排泄量大,造成了不良的水质环境,同时对饲料竞争的加剧,使得对处于生长劣势的黄鳝更加不利,从而使高密度的生长离散更加明显。
[1]DE LEEUW R,CONN P M,VAN′T VEER C,et al.Characterization of the receptor for gonadotropin-releasing hormone in the pituitary of the African catfish,Clarias gariepinus[J].Fish Physiology and Biochemstry,1988,5(2):99-107.
[2]IZQUIERDO M S,FERNANDEZ-PALACIOS H,ACONA G J T.Effect of broodstock nutrition on reproductive performance of fish[J].Aquaculture,1988,2001,197(1/4):25-42.
[3]RODGERS E W,DRANE S L,GROBER M S.Sex reversal in pairs of Lythrypnus dalli;behavioral and morphological changes[J].The Biological Bulletin,1994,208:120-126.
[4]JANG S H,ZHOU F,XIA L X,et al,Construction of a BAC library and identification of Dmrt1 gene of the rice field eel,Monopterus albus[J].Biochemical and Biophysical Research Communications,2006,348(2):775-780.
[5]DRUMMOND A E,BAILLIE A J,FINDLAY J K.Cell Ovarian estrogen receptor alpha and beta mRNA expression:impact of development and estrogen[J].Mol Cell Endocrino1,1999,149(1/2):153-161.
[6]EL-SAYEDA A F M,MANSOURB C R,EZZAT A A.Effects of dietary protein level on spawning performance of Nile tiiapia(Oreochromis niloticus)broodstock reared at different water salinities[J].Aquaculture,2003,220(1/4):619-632.
[7]EMATA A C,BORLONGAN I G,DAMASO J P.Dietary vitamin C and E supplementation and reproduction of milkfish Chanos chanos Forsskal[J].Aquaculture Research,2000,31(7):557-564.
[8]FERNANDEZ PALACIOS H,IZQUIERDO M S,ROBAINA L,et al.Effect of n-3 HUFA level in broodstock diets on egg quality of gilthead sea bream(Sparus aurata L.)[J].Aquaculture,1995,132(3/4):325-337.
[9]陈全震,高爱根.黄鳝养殖生物学的研究进展[J].水产科技情报,1999,26(3):115-119.
[10]万新生,郭建文,凌 伟.黄鳝的网箱养殖及病害防治[J].淡水渔业,2002,32(1):32-34.
[11]卫化强.黄鳝生态养殖技术[J].淡水渔业,2000,30(10):14-15.
[12]MOCHIZUKI K,NISHIMIYA-FUJISAWA C,FUJISAWA T.Universal Occurrence of the Vasa-Related Genes Among Metazoans and their Germ line Expression in Hydra[J].Dev Genes Evol,2001,211(6):299-308.
[13]VIJAYAN M M,LEATHERLAND J F.Effect of stocking density on the growth and stress respond in brook charr,Salvelinus fontinalis[J].Aquaculture,1998,75:159-170.
[14]庄 平,李大鹏,王明学,等.养殖密度对史氏鲟稚鱼生长的影响[J].应用生态学报,2002,13(6):735-738.
[15]FISHELSON L.Protogynous sex reversal in the fish Anthias squamipinnis(Teleostei,Anthiidae)regulated by the presence or absence of a male fish[J].Nature,1970,227:90-91.
[16]KLOC M,BILINSKI S,CHAN A P.Mitochondria ribosomal RNA in the germinal granules in Xenopus embryos[J].Differentiation,1998,67:80-83.
[17]朱勇夫,南春莲,印 杰,等.罗氏沼虾池塘不同密度养殖对比试验[J].科学养鱼,2006(8):29-30.
[18]王小兵,黄 勃,邓中日.南美白对虾高位池养殖模式最适放养密度的调查[J].水产科学,2005,24(5):20-22.

