蛇床子素:防治中枢神经系统疾病的新希望
龚其海,杨丹莉,李 菲,石京山,黄 彬
(遵义医学院药理学教研室暨贵州省基础药理重点实验室,贵州遵义563000)
蛇床子素(osthole,Ost)又名甲氧基欧芹酚或欧芹酚甲醚,其化学名称为7-甲氧基-8-异戊烯基香豆素(7-methoxy-8-[3-methylpent-2-enyl]coumarin),结构式见图1,分子量:244.29,是最先从伞形科植物中提取分离出的天然香豆素类化合物,存在于多属植物中,目前已知至少在15个属如蛇床属、当归属、古当归属、绵果芹属、欧防风属、欧芹属等中存在[1]。因其在伞形科植物蛇床的干燥成熟果实蛇床子(Fructus cnidii)中含量较高(约2%),故而得名。现代药理研究发现,蛇床子素具有抗凝血、抗骨质疏松症、抗高血压、抗心律失常等作用,且数见综述[1~3]。然而,随着人们对蛇床子素研究的深入,发现其在中枢神经系统也具有广泛的药理作用。为了让人们更好地开发利用蛇床子素防治中枢神经系统疾病,本文对其在中枢神经系统的药理作用及机制作一综述,旨在为其后续深入研究提供导向。

图1 蛇床子素的化学结构
1 抗缺血性脑损伤
缺血性脑损伤的病理生理过程复杂,涉及脑缺血缺氧后触发的一系列改变,包括兴奋性毒性、线粒体功能紊乱、自由基生成过多、炎症和凋亡调控基因的激活等多种病理过程,而且各种因素相互作用、相互影响,形成恶性网络,共同导致病情加重,严重威胁人类健康。现已发现蛇床子素对多种缺血性脑损伤模型有效。
1.1 急性缺血性脑损伤 Chao等采用大鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型,在制模前30min分别腹腔注射蛇床子素10、20、40mg/kg,缺血2h/再灌22h(即MCAO后24h)进行神经功能缺陷评分并测定脑梗死体积、脑含水量,结果发现各剂量的蛇床子素均能降低MCAO所致的神经功能缺陷评分,中、高剂量的蛇床子素明显降低了脑梗死体积及脑含水量[4],采用2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chlorid,TTC)染色分析脑梗塞体积的代表性图片见图2。这表明蛇床子素对缺血性中风具有良好的预防作用。在此基础上,该研究组进一步检测了脑梗死区及缺血半暗区的谷胱甘肽(glutathione,GSH)、髓过氧化物酶(myeloperoxidase,MPO)活性及丙二醛(malondialdehyde,MDA)含量,发现蛇床子素明显阻遏MCAO所致的GSH活性降低,减轻了MCAO所致的MDA含量、MPO活性增加[4]。该研究组同时发现蛇床子素可抑制梗死半球的白细胞介素(interleukin)-1及IL-8含量[4]。这表明蛇床子素可通过抗氧化、抗炎作用而预防MCAO所致的缺血性脑损伤。Mao等通过MCAO大鼠模型,观察了蛇床子素对缺血2h/再灌注24h所致损伤的影响,发现MCAO前腹腔注射蛇床子素100mg/kg可预防该模型损伤,其机制与逆转缺血/再灌注所致的基质金属蛋白酶(matrix metalloproteinase,MMP)-9含量/活性有关[5]。MMP-9失调可使细胞-细胞、细胞-基质信号崩解,促发脑细胞功能失调与死亡[6]。MMP-9也可分解神经血管底物,使血-脑屏障通透性增加,形成脑水肿及其它继发性损伤[7]。因此可以认为,蛇床子素可维持血-脑屏障的稳定,这也是其抗缺血/再灌注损伤的机制之一。何蔚等采用短暂MCAO制备局灶性脑缺血2h/再灌注24h损伤模型,缺血后1 h分别舌下静脉注射蛇床子素5和10mg/kg,再灌注24 h,发现蛇床子素能改善大鼠脑缺血/再灌注后神经功能行为缺陷评分,减轻脑水肿,降低大鼠脑组织中IL-1、IL-8和一氧化氮(nitric oxide,NO)含量,抑制脑组织中MPO和诱生型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)的活性[8],认为蛇床子素对脑缺血/再灌注损伤有保护作用,作用机制可能与其抑制炎症反应有关[8]。刘文博等采用四血管阻塞法所致的大鼠全脑缺血模型(4VO模型),缺血15 min再灌注后1h给予5、25、125mg/kg蛇床子素腹腔注射治疗,发现缺血15min再灌注后1h给药的各蛇床子素治疗组大鼠的行为学评分和组织形态学分析结果均明显优于模型组,并在25mg/kg剂量时表现出最大保护效果,其半胱氨酸依赖的天冬氨酸蛋白酶(cysteinylaspartate-specific proteases,caspase)-3表达水平显著降低[9]。Caspase-3是在凋亡执行阶段起主要作用。因此可以认为蛇床子素治疗性给药对全脑缺血再灌注脑损伤有一定的脑保护作用,其机制可能与抑制细胞凋亡有关。
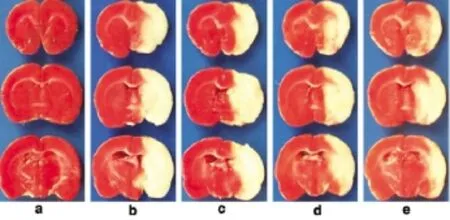
图2 蛇床子素缩小MCAO所致脑梗死体积的代表性图片[4]。a.假手术组,b.MCAO组,c-e分别为蛇床子素10、20、40mg/kg组。
1.2 慢性低灌注诱导的缺血性脑损伤 Ji等通过永久性结扎双侧颈总动脉(2VO法)大鼠脑慢性低灌注诱导的缺血性脑损伤模型,2VO后30天灌胃蛇床子素10、20mg/kg至第55天,同时在第50天开始检测大鼠的认知功能,后取海马行检测超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶、谷胱甘肽过氧化酶(Glutathione Peroxidase,GPx)活性及MDA含量,并观察蛇床子素对2VO法所致海马形态损伤的影响,以及系列凋亡相关蛋白表达的影响[10]。结果发现蛇床子素可减轻脑慢性低灌注诱导的认知功能减退及海马形态损伤,并增加海马过氧化氢酶、谷胱甘肽过氧化酶活性,减低MDA含量,阻遏了海马bcl-2下调及bax上调,同时减轻了caspase-3激活[10]。该研究表明蛇床子素对慢性低灌注诱导的缺血性脑损伤同样有效,其机制与抗氧化、抗凋亡有关。
以上研究表明蛇床子素无论是对急性缺血性脑损伤还是慢性缺血性脑损伤、无论是局灶性脑缺血还是全脑缺血、无论是灌胃还是注射给药、无论是预防性给药还是治疗性给药都具有较为良好的效应。这为蛇床子素用于缺血性脑损伤的防治提供了基础药理学依据,展示了蛇床子素用于该类疾病的防治具有良好的临床应用前景。作用机制方面,主要与抗氧化、抗炎、抗凋亡及维持血-脑屏障稳定性有关,但该方面的研究尚不深入,需进一步研究。
2 抗痴呆及延缓衰老
蛇床子素用于抗痴呆及延缓衰老方面的研究较早。蛇床子素是中药蛇床子的主要活性成分之一。1994年,王彬等发现蛇床子在增强体力、降低血中胆固醇、提高免疫力及性激素(雌二醇/睾酮)水平等方面均有一定的抗衰老作用[11]。沈丽霞等采用东莨菪碱诱导的记忆获得减退模型、亚硝酸钠诱导记忆巩固障碍模型和乙醇诱导记忆再现障碍模型,发现蛇床子素可明显改善记忆获得和巩固障碍以及方向辨别障碍,并延长断头耐缺氧时间,但对记忆再现障碍无明显改善作用[12,13]。通过小鼠避暗实验和跳台实验、血浆和脑组织SOD活性及全血GSH-Px活性测定,观察了蛇床子素对AlCl3诱导的小鼠记忆障碍模型的保护作用,发现蛇床子素能明显改善该模型的被动回避性记忆障碍,增强SOD和GSH-Px活性,认为蛇床子素对AlCl3致急性衰老模型小鼠记忆障碍有保护作用,其作用机制可能与抗氧化作用有关[13]。Hsieh等在对东莨菪碱所致和去卵巢后引起的方向辨别障碍模型中,发现蛇床子素在该模型中对方向辨别障碍大鼠的保护作用,其作用机制与其雌激素样和激活中枢胆碱能神经系统作用[14]。如前所述,蛇床子素可减轻脑慢性低灌注诱导的认知功能减退,并增加海马GPx活性,减低MDA含量,阻遏了海马bcl-2下调及bax上调,同时减轻了caspase-3激活[10]。这提示蛇床子素对慢性低灌注诱导的认知功能减退同样有效,其机制与抗氧化、抗凋亡有关。此外,李建东等采用高频电刺激诱导长时程增强效应的电生理学方法,在体记录并观察不同剂量蛇床子素对麻醉大鼠海马齿状回长时程增强现象的影响,发现蛇床子素对大鼠海马齿状回突触传递活动有明显促进和增强作用[15]。以上研究初步表明蛇床子素在增强学习记忆及延缓衰老方面具有较好疗效,其机制与抗氧化、抗凋亡等作用有关。然而,老年痴呆病理表现为神经纤维缠结、老年斑及神经元变性缺失。蛇床子素是否可以减轻与其病理特征密切相关的Tau蛋白磷酸化、淀粉样蛋白形成尚需进一步研究。
3 镇静作用
周青等发现蛇床子素显著增强阈下催眠剂量的戊巴比妥钠对小鼠的催眠作用,明显抑制醋酸所致的小鼠扭体反应,但对高热板法致痛小鼠的痛阈无明显影响[16]。而且,蛇床子素对安钠咖所致的小鼠自主活动增加有明显对抗作用,但对正常小鼠的自主活动未见明显影响[16]。此外,蛇床子素还可降低蟾蜍离体坐骨神经动作电位的振幅[16]。这些结果显示蛇床子素对中枢神经系统有抑制作用[16]。该研究组同时发现,蛇床子素显著增强阈下催眠剂量戊巴比妥钠对小鼠的催眠作用,且此作用与剂量相关[17]。鉴于只影响肝药酶而减少戊巴比妥钠代谢的药物对此模型是无效的,这进一步证明蛇床子素可通过抑制中枢神经系统而发挥作用[17]。
4 镇痛作用
胡杰等发现蛇床子素能够显著减少醋酸致痛小鼠的扭体次数和高热致痛小鼠的痛阈,对物理和化学引起的疼痛和炎症均有明显的对抗作用[18];能够显著抑制二甲苯所致小鼠耳廓肿胀和降低小鼠腹腔对伊文思蓝的通透性[18]。就蛇床子素对高热致痛小鼠痛阈的的影响报道不一[16,18],尚需进一步确证。但其对炎症的抑制作用较为肯定,后续的离体研究也证实了这一点[19]。
5 抗惊厥作用
Luszczki等通过最大电休克诱导的小鼠发作模型,观察了腹腔注射蛇床子素后15、30、60及120min对该模型的抑制作用,发现蛇床子素具有明确的抗电休克所致的发作效应,半数有效量为259-631mg/kg[20]。该研究组进一步通过上述模型及时间点比较了欧前胡素、蛇床子素及丙戊酸钠的抗惊厥作用及中毒剂量,发现其半数有效量分别为167-290、253-639、167-290mg/kg,半数中毒量为 329-443、531-648、363-512 mg/kg,保护指数(半数中毒量与半数有效量的比值)分别为1.13-2.60、0.83-2.44、1.72-2.00[21]。因此可以认为,蛇床子素的抗惊厥效应与丙戊酸钠相似,在抑制发作方面存在着潜在的临床应用价值,值得进一步研究。
6 抗帕金森病作用
1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)本身并无毒性,但在单胺氧化酶B的作用下,转化为甲基-苯基-吡啶离子(1-methyl-4-phenylpyridinium ion,MPP+)后可对多巴胺神经元产生明显的毒性作用,导致机体产生帕金森病样症状,并导致活性氧族的产生及神经元凋亡,是研究帕金森病的工具药。Liu等观察了蛇床子素对MPP+诱导的PC12细胞株毒性的影响,发现蛇床子素可减低MPP+对PC12细胞产生的毒性,其机制与抗抗氧化及抗凋亡有关[22]。因此可以认为,蛇床子素在抗帕金森病方面或许也有较好的疗效,有必要通过帕金森病整体动物模型进一步研究。
7 展望
现代药理学的发展加速了蛇床子素防治中枢神经系统疾病的研究,包括抗缺血性脑损伤、抗痴呆及延缓衰老、镇静、镇痛、抗惊厥及抗帕金森病等,展示了蛇床子素在防治中枢神经系统疾病方面存在较好的临床应用前景。机制研究方面目前尚不深入,主要为抗氧化、抗炎、抗凋亡及维持血-脑屏障稳定性等。因此,真正把蛇床子素作为抗中枢神经系统疾病的药物应用于临床尚需时日,在必要时有可能考虑对其进行适当的化学结构改造以增强其活性,以便筛选出适合临床广泛应用的强效抗中枢神经系统疾病的新药,这对充分开发利用蛇床子素有着重要意义。
[1]马玉明.蛇床子素的药理进展及剂型开发[J].中国现代药物应用.2008,2(15):112-114.
[2]阴旗俊,孙海峰.蛇床子素的药理作用和作为生物农药的研究[J].中医药信息.2009,26(2):13-15.
[3]You L,Feng S,An R,Wang X.Osthole:a promising lead compound for drug discovery from a traditional Chinese medicine(TCM)[J].Nat Prod Commun.2009,4(2):297-302.
[4]Chao X,Zhou J,Chen T,et al..Neuroprotective effect of osthole against acute ischemic stroke on middle cerebral ischemia occlusion in rats[J].Brain Res.2010,1363:206-211.
[5]Mao X,Yin W,Liu M,et al..Osthole,a natural coumarin,improves neurobehavioral functions and reduces infarct volume and matrix metalloproteinase-9 activity after transient focal cerebral ischemia in rats[J].Brain Res.2011,1385;275-280
[6]Gu Z,Kaul M,Yan B,et al..S-nitrosylation of matrix metalloproteinases:signaling pathway to neuronal cell death[J].Science.2002,297(5584),1186-1190.
[7]Ballabh P,Braun A,Nedergaard M.The blood-brain barrier:an overview:structure,regulation,and clinical implications[J].Neurobiol Dis.2004,16(1),1-13.
[8]何蔚,刘建新,周钰梅,等.蛇床子素对大鼠脑缺血/再灌注损伤的保护作用及其机制[J].中国药理学通报.2008,24(11):1528-1530.
[9]刘文博,霍军丽,费舟,等.蛇床子素在缺血再灌注脑损伤模型中的脑保护作用[J].中华神经外科疾病研究杂志.2008,8(2):118-121.
[10]Ji HJ,Hu JF,Wang YH,et al..Osthole improves chronic cerebral hypoperfusion induced cognitive deficits and neuronal damage in hippocampus[J].Eur J Pharmacol.2010,636(1-3):96-101.
[11]王彬,王宏珉,廖晖,等.蛇床子延缓衰老的药理学研究[J].中药药理与临床,1994,10(1):8-12.
[12]沈丽霞,张丹参,张力,等.蛇床子素对学习记忆的影响及其机制分析[J].药学学报,1999,34(6):405-409.
[13]沈丽霞,金乐群,张丹参,等.蛇床子素对AlCl3致急性衰老模型小鼠记忆障碍的保护[J].药学学报,2002,37(3):178-180.
[14]Hsieh MT,Hsieh CL,Wang WH,et al..Osthole improves aspects of spatial performance in ovariectomized rats[J].Am J Chin Med.2004;32(1):11-20.
[15]李建东,章春芝,温晓竞,等.蛇床子素对麻醉大鼠中枢长时程增强现象的影响[J].陕西中医.2008,29(8):1083-1085.
[16]周青,周俐,胡晓,等.蛇床子素对中枢神经系统的抑制作用[J].赣南医学院学报.1998,18(2):99-102.
[17]连其深,胡晓,上官珠,等.蛇床子素镇静作用的研究.中药新药与临床药理杂志[J].2000,11(4):244-245.
[18]胡杰,陈刚.蛇床子素抗炎镇痛作用的实验研究[J].湖南中医杂志.2007,23(1):82-83.
[19]Zimecki M,Artym J,Cisowski W,et al..Immunomodulatory and anti-inflammatory activity of selected osthole derivatives[J].Z Naturforsch C.2009,64(5-6):361-368.
[20]Luszczki JJ,Andres-Mach M,Cisowski W,et al..Osthole suppresses seizures in the mouse maximal electroshock seizure model[J].Eur J Pharmacol.2009,607(1-3):107-109.
[21]Luszczki JJ,Wojda E,Andres-Mach M,et al..Anticonvulsant and acute neurotoxic effects of imperatorin,osthole and valproate in the maximal electroshock seizure and chimney tests in mice:a comparative study[J].Epilepsy Res.2009,85(2-3):293-299.
[22]Liu WB,Zhou J,Qu Y,et al..Neuroprotective effect of osthole on MPP+-induced cytotoxicity in PC12 cells via inhibition of mitochondrial dysfunction and ROS production[J].NeurochemInt.2010,57(3):206-215.

