耐甲氧西林葡萄球菌的耐药性分析
翟俊轻 张立志 李静 刘开扬
自从1961年英国学者Jevons报道了世界上首株耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,MRSA)以来,MRSA和耐甲氧西林凝固酶阴性葡萄球(methicillin-resistant coagu-lase-ngeative staphylococci,MRCNS)在世界各地广泛传播,其分离率逐年增加。20世纪80年代末90年代初以来,葡萄球菌较以前感染明显增多,尤其是耐甲氧西林葡萄球菌(MRS)。耐药菌株的出现,给临床抗感染治疗造成极大困难。本文旨在比较我院患者MRS对利奈唑胺、万古霉素、替考拉宁、利福平、左氧氟沙星的耐药性,为临床预防、治疗该菌感染提供基础。
1 材料与方法
1.1 菌株 选择我院2007年12月至2008年5月门诊及住院患者送检的标本(包括分泌物、脓、痰、血液、尿液、脑脊液等),临床分离MRS 31株,按CLSI标准操作规程进行,葡萄球菌用头孢西丁纸片法检测出MRS。
1.2 试剂 利奈唑胺(30 μg/片)纸片购自英国OXOID公司,替考拉宁(30μg/片)、利福平(5μg/片)、左氧氟沙星(5μg/片)、头孢西丁(30μg/片)纸片购自北京天坛微生物技术开发公司,万古霉素(30 μg/片)纸片以及药敏培养基(MH琼脂)购自杭州天和微生物试剂有限公司。
1.3 方法 纸片扩散法按CLSI标准操作规程进行,MRSA:头孢西丁的抑菌圈直径≤19 mm为耐药;MRCNS:头孢西丁的抑菌圈直径≤24 mm为耐药。采用Kerby-Bauer纸片扩散法进行测定所有菌株对利奈唑胺等5种抗菌药物的耐药性。在MH平板上涂布0.5麦氏单位的待检细菌后,用药敏纸片专用加样器将药敏纸片均匀分散放置在平板上,35℃培养18~24 h。精确量取(坐标纸量取法,量3次取其平均值)抑菌圈直径,以ATCC25923为质控菌株,药敏结果依据CLSI/NCCLS(2006年)判断。
2 结果
K-B法测得31株MRS对5种抗菌药物的抑菌圈情况:利奈唑胺与万古霉素、替考拉宁敏感率均为100%,利福平敏感率为45.16%,左氧氟沙星敏感率为16.13%。利奈唑胺与万古霉素、替考拉宁抗菌效果优于其他2种药物。见表1、2。
3 讨论
细菌耐药性已成为全球医药界关注的问题,具有重要临床意义的耐药菌有青霉素耐药的肺炎链球菌、甲氧西林耐药的葡萄球菌、万古霉素耐药的肠球菌、β-内酰胺类抗生素耐药的革兰氏阴性杆菌。这些耐药菌不仅呈逐年上升趋势,并且常为多重耐药菌株,致使这些菌种所致感染的治疗成为临床上的难题,对感染患者的健康和生命直接构成威胁,因此控制和减缓耐药细菌的增长已成当务之急。
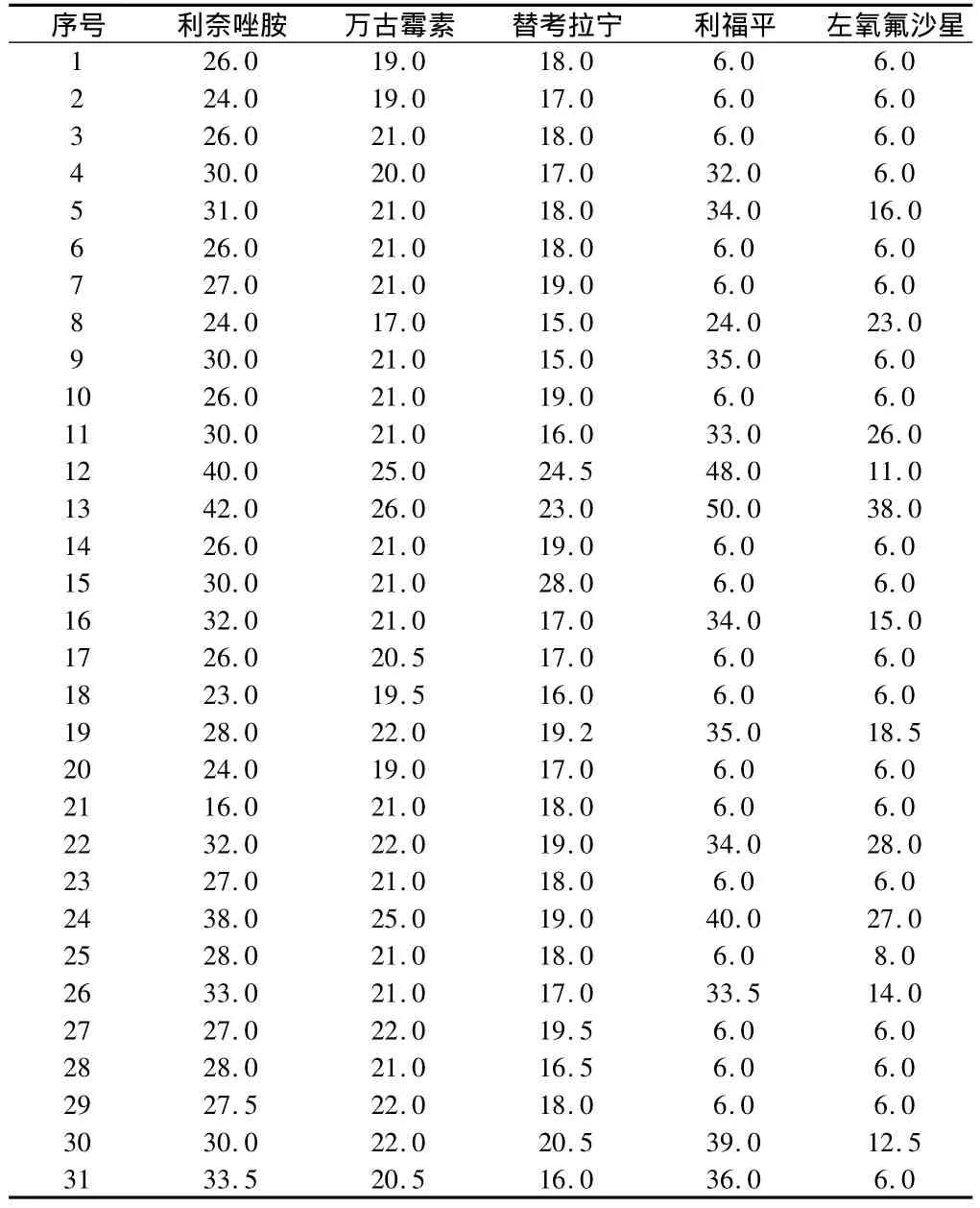
表1 5种药物对MRS的抑菌圈直径 mm

表2 MRS对5种药物的敏感性 n=31,株(%)
MRS包括MRSA和MRCNS。MRS对甲氧西林的耐药性主要是由PBP2α所介导的。编码PBP2α,从而介导葡萄球菌对甲氧西林耐药性的是位于细菌染色体上的mecA基因,这种基因只存在于MRS中。葡萄球菌耐药机制比较复杂,主要通过质粒介导、靶位改变、竞争结合位点,改变核糖体结构和DNA促螺旋酶与拓扑异构酶的变异及主动外排系统的参与而使其耐药性增加;耐药质粒不但可在同种菌间传播,也可在不同细菌间传播,导致耐药迅速广泛的散布,这也是细菌耐药性不断增强的重要原因[1]。葡萄球菌对甲氧西林的耐药是由于其携带的mecA基因所表达的一种低亲和力的青霉素结合蛋白PBP2α造成的,mecA基因位于一个称为葡萄球菌盒式染色体(staphylococcal cassette chromosome,SCC)的移动基因组件上[2]。本次检测耐甲氧西林葡萄球菌时采用头孢西丁纸片法。耐甲氧西林葡萄球菌检测方法很多,有头孢西丁纸片法、苯唑西林纸片法、苯唑西林-盐琼脂筛选法、PBP2α胶乳凝集法等表型检测,还有PCR、探针杂交法快速检测。苯唑西林法随着β-内酰胺酶含量增加被破坏导致假阳性发生;苯唑西林不能检测异质性MRSA,因为对大多数非β-内酰胺类抗生素表现为敏感而被认为是甲氧西林敏感的金黄色葡萄球菌(MSSA)[3]导致MRSA漏检。苯唑西林-盐琼脂筛选法简便可行,敏感度极高,常用作校正其他方法的标准;本法因氯化钠浓度高(40 g/L),造成高渗环境,时间延长至48 h,MSSA易产生大量β-内酰胺酶缓慢水解苯唑西林,致细菌生长,检测特异性下降。PBP2α胶乳凝集法简便、快速、准确,检测全程只需15 min,但由于检测试剂依赖进口费用昂贵,限制了在临床中的应用。PCR检测mecA基因,虽然会有基因不表达的情况,但对作为分子标志的mecA基因的检测仍是目前认为最可靠的检测方法,是判定MRSA和MRCNS的金标准[4]。MecA基因检测(PCR法)和头孢西丁纸片扩散法检测MRSA、MRCNS的阳性率无差别。探针杂交法目前还处于研究阶段,还未应用于临床。头孢西丁更易诱导mecA基因的表达。在纸片扩散试验中无中介类别,易判读终点,是临床应用的首选方法[5,6]。
利奈唑胺与50 S核糖体亚基的特殊位点结合,不可逆地阻止蛋白合成初期络合物的形成,尽管其结合位点与氯霉素和林可霉素相近(均作用于细菌50 S核糖体亚单位),终止蛋白合成。但他们的作用机制不同,氯霉素抑制肽键的形成,利奈唑胺作用于翻译起始阶段,干扰包含mRNA、30 S核糖体、起始因子和fMet-tRNA等复合物的形成,从而抑制细菌合成蛋白,以往的抗菌药物均未将此阶段作为抑制生物蛋白合成的靶位[7,8],这种不同的作用机制使利奈唑胺与氯霉素和林可霉素之间不易产生交叉耐药性。万古霉素和替考拉宁属于糖肽类抗生素,结构基本骨架相同。从部分文献的结果及目前临床耐药菌株的分布情况看,万古霉素是MRSA及MRSE感染所致疾病的首选药物,但是,近年来,不断有报道MRSA对万古霉素敏感性降低,而且Garrett等[9]先后报道表皮葡萄球菌与溶血葡萄球菌对万古霉素敏感性降低。替考拉宁主要用于治疗革兰阳性细菌的感染,是目前临床上为数不多的仍对多重耐药葡萄球菌和肠球菌具有抗菌活性的药物之一。有学者认为,由于万古霉素大量应用于对MRS感染的治疗,可能会导致MRS对万古霉素敏感性的下降并最终对万古霉素的耐药,因而交替使用利奈唑胺、万古霉素和替考拉宁可能会延缓这种耐药情况的出现[10]。
国外在一项院内获得性MRS感染的随机研究中发现,治疗组给予利奈唑胺600 mg,静脉注射,12 h/次;对照组给予万古霉素1 g,静脉注射,12 h/次。其主要感染部位为肺和皮肤软组织。结果,MRSA的治疗有效率分别为78.5%(51/65)和72.2%(57/79)。2 组的胃肠外给药时间(5.4 d 和 14.8 d,P<0.01)和住院时间(8 d和16 d,P<0.01)差异有统计学意义[11]。结合本实验室采用K-B法检测药物对MRS抑菌圈大小分析利奈唑胺的作用效果优于万古霉素。
从本次实验结果综合分析利奈唑胺抑菌圈明显大于其他几种药物,甚至有的抑菌圈是敏感界限的两倍,鉴于这种情况的存在,因此建议给临床提供药敏结果是不能单纯报告敏感、中敏和耐药,而是用最新的一种提法极度敏感、高度敏感、敏感、中度敏感和耐药来报告结果,以便为临床治疗提供更好的用药信息,延缓药物耐药性的产生。
针对近年来葡萄球菌耐药性越来越严重,我们要对细菌耐药性提高重视,用药前进行细菌培养及其药敏试验,合理使用抗生素,延缓或避免细菌对一种又一种抗生素耐药。有人提倡,在可能情况下,应选用喹诺酮类药物,如左氧氟沙星、利福平、呋喃妥因等联合治疗多重耐药MRS,在这些药物治疗失败后,再选用万古霉素等药物[12]。临床检验工作者在实验工作中应增加药敏试验的抗生素品种,为临床医生提供更合适的敏感抗生素,这样才能保证治疗效果以及防止耐药菌株的进一步增加。通过实验室对5种药物抑菌圈大小分析发现利奈唑胺、万古霉素、替考拉宁为治疗MRS的首选药物。
1 何代平,胡美玲,央娜,等.高原地区医院耐甲氧西林葡萄球菌感染及其耐药谱分析.高原医学杂志,2005,15:57-59.
2 周义正,李向阳,杨锦红,等.临床分离葡萄球菌中mecR1和mecI基因突变缺失研究.医学研究杂志,2007,36:46-49.
3 Felten A,Grandry B,Lagrange PH,et al.Evalution of three techniques for detection of low-level methicillin-resistant Staphylococcus aureus:a disk difusion method with cefoxitin and moxalactam,the Vitek 2 system,and the MRSA-Screen latex agglutination test.J Clin Microbiol,2002,40:2766-2771.
4 沈定霞,罗燕萍,张有江,等.我院近十年细菌流行分布及耐药性监测.中华临床医药卫生杂志,2004,2:15-18.
5 宋焰桃,徐元宏.四种初筛试验检测耐甲氧西林葡萄球菌的评价.热带医学杂志,2007,7:1170-1172.
6 杨锦红,周义正,朱敏敏,等.基因扩增和3种表型筛查法检测耐甲氧西林葡萄球菌的应用评价.医学研究杂志,2007,36:42-45.
7 Linden P.Ues of linezolid for gram-positive infections.Infect Med,2002,19:25-32.
8 Sisson TL,Jungnluth GL,Hopkins NK.Age and sex effects on the pharmacokinetics of linezolid.Eur J Clin Pharmacol,2002,57:793-797.
9 Garrett DO,Tochimsen E,Murfitt K,et al.The emergence of aecreased susceptibicity to oancomycin in Staphy Cococcus epidermidis.Infect Control Hosp Epidemiol,1999,20:167-170.
10 逢崇杰,巩路,田彬,等.替考拉宁和万古霉素对临床分离耐甲氧西林葡萄球菌体外抗菌活性比较.中国抗感染化疗杂志,2005,5:360-361.
11 Linden P.Use of linezolid for Gram-positive infections.Infect Med,2002,19:25.
12 余方友,胡龙华,谭丝明,等.金黄色葡萄球菌临床分离株的耐药谱变迁分析.中华传染病杂志,2004,22:57-60.

