IFN-γ基因+874位点基因多态性与肺结核易感性的病例对照研究
王海宾 国文 杨淑岭 康书慧 刘海云 曹金凤 田红卫 檀新云 刘玉肖
结核病是严重危害人类健康的重要传染病之一。早在一百多年前Robert Koch就发现结核分枝杆菌是结核病的致病菌。由于缺乏完善的诊断技术,结核仍然是威胁人类健康传染病中的“头号杀手”[1]。事实上,在感染人群中,90% ~95%的感染者处于休眠状态,仅有5%~10%最终进展为临床结核病[2]。目前国外已有不少研究探讨IFN-γ基因多态性与某些传染病(如结核病、乙型肝炎、利什曼原虫等)间的关联[3-5],但对于该多态性位点与中国汉族人群结核发生间的关联研究并不多见。因此,我们采用扩增难控制突变系统PCR(ARMSPCR)方法分析273例肺结核患者、297例对照明人群IFN-γ +874位点基因多态性与肺结核发病间的关联,并探讨可能的基因-环境交互作用。
1 资料与方法
1.1 一般资料
1.1.1 病例组入选与排除标准:选择2008年3月至2009年3月石家庄市第五医院结核科选择肺结核新发病例,所有病例均按以下国家统一标准确诊,即痰菌阳性同时胸X线片有肺结核特征病灶;或痰菌阴性,但胸部X线片示活动性肺结核征象、结核菌纯蛋白衍化物(purified protein derivative,PPD)试验强阳性并具有明显结核病临床体征者。
1.1.2 对照组入选与排除标准:选择同医院中无结核病史、诊断为其他疾病的患者,或病例的健康同事、亲友,对所有对照经X线胸透,排除近期结核感染者,同时排除其他部位结核、肺炎、肺癌、尘肺等结核相似病症,HIV感染、慢性疾病、肿瘤患者、长期使用激素或器官移植等免疫功能低下者。
1.2 问卷内容 设计统一的调查问卷,由调查组成员对所有研究对象进行面对面的问卷调查,内容包括基本特征(如年龄、性别、籍贯、婚姻状况、文化程度、居住地、经济收入等)、生活行为方式(吸烟、饮酒、肉类摄入、居住环境、健身活动等)。既往病史、家族史、结核相关因素接触史、卡介苗接种史(以研究对象上臂的卡痕来判断,由专业临床医生检查卡痕并记录)。利用问卷培训流调人员,对研究对象进行预调查后进行相关的修订和改进。
1.3 基因多态性检测
1.3.1 基因组DNA提取:每个研究对象抽取3 ml血液,EDTA抗凝,全血基因组快速提取试剂盒(天根公司)提取全血中基因组DNA。
1.3.2 基因多态性分析
1.3.2.1 引物设计与合成参:参照文献[6]设计扩增 IFN-γ 基因第一内含子+874位点的PCR引物,由北京奥科生物技术有限公司合成。其中通用反向引物与特异正向引物1构成第一对,用于扩增于IFN-γ+874A,产物片段为261 bp,通用反向引物与特异正向引物2构成第二对,用于扩增IFN-γ+874T,产物片段为261 bp,内参照正向引物与反向引物构成第三对,用于判定PCR体系的成功与否,产物片段为426 bp。每个样本均进行两次PCR反应,如果仅有第一对扩增产物合并内参照产物为阳性,结果判定为+874AA基因型,如果仅第二对扩增产物合并内参照产物为阳性,结果判定为+874TT基因型,如果两对引物扩增产物合并内参照产物均为阳性,则结果判定为+874A/T基因型。见表1。
1.3.2.2 PCR 反应条件:10 × PCR 缓冲液 3 μl,2.5 mmol/LdNTP Mixture 3 μl,Taq DNA 聚合酶1.5 U,10 μmol/L 的通用反向引物和特异性正向引物各1 μl,10 μmol/L的内对照上、下游引物引物各 0.5 μl,DNA 模板 1 μl,补水至总体积 30 μl。PCR反应条件为95℃热启动1 min,进入第一部分循环,95℃、15 s,62℃、50 s,72℃、40 s,10 个循环,然后进入第二部分循环,95℃、20 s,56℃、50 s,72℃、50 s,20 个循环,最后于 72℃ 延伸10 min。

表1 应用ARMS-PCR检测IFN-g基因多态性
1.3.2.3 扩增产物的分析:PCR扩增产物用含有EB的2%琼脂糖凝胶,1×TAE缓冲液,99V恒压电泳30 min,紫外灯下观察结果,并用法国VL自动凝胶成像分析系统进行成像和分析。
1.4 统计学分析 应用SPSS 10.0统计软件,用基因计数法计算各组IFN-γ+874启动子基因型频率和等位基因频率,Hardy-Weinberg平衡吻合度检验群体代表性。单因素分析估计基因型与疾病的关联,计算OR值及其95%CI。然后,将是否发病作因变量,各基因型作为自变量,前述有显著意义的环境相进行多因素非条件logistic回归分析,最大似然比法估计调整OR值及其95%CI。计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组环境相关的单因素分析 年龄、籍贯、婚姻状况、文化程度、居住地、经济收入等因素在2组中的分布无差异。对环境相关的单因素分析,结核患者密切接触史及卡介苗接种史两个因素在病例组和对照组中分布有差异,前者是肺结核发生的危险因素,而后者则是疾病发生的保护因素。而健身状况、吸烟、饮酒等其他因素在2组中分布无差异。
2.2 IFN-γ基因多态性位点与肺结核易感性的单因素分析用基因计数法计算2组人群IFN-γ+874基因型频率,经Hardy-Weinberg平衡吻合度检验(P >0.05),符合 Hardy-Weiberg遗传平衡。在本研究人群中,IFN-γ基因+874AA、AT和TT基因型在病例组中的分布频率分别为70.33%、28.57%和1.10%,在对照组中的分布频率分别为70.71%、28.28%和1.01%。见表2。
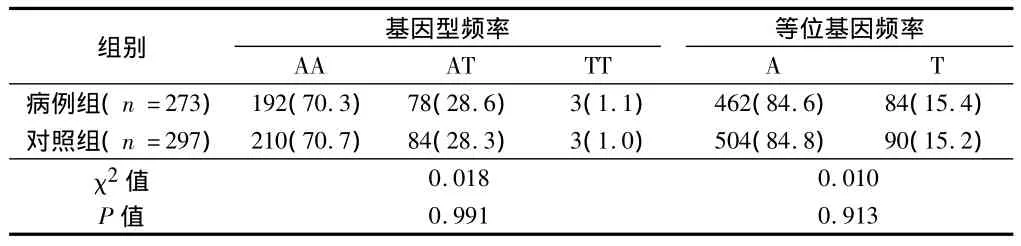
表2 IFN-γ基因多态性位点与肺结核易感性的单因素分析例(%)
2.3 IFN-γ基因多态性位点与肺结核易感性的多因素分析IFN-γ基因+874位点基因多态性见图1。以是否发病作为因变量,各基因型为自变量,单因素分析中有显著意义的密切接触史和卡介苗接种史为协变量,进行多因素非条件logistic回归分析。结果显示调整了接触史和接种史两个因素后,IFN-γ基因+874位点基因多态性与肺结核的发生无显著性关联(P>0.05)。将含有等位基因TT和AT组合并,作为参照组AA基因型组与之相比,在病例和对照组中的分布仍无差异(P>0.05)。见表 3。

图1 IFN-γ基因+874位点基因多态性
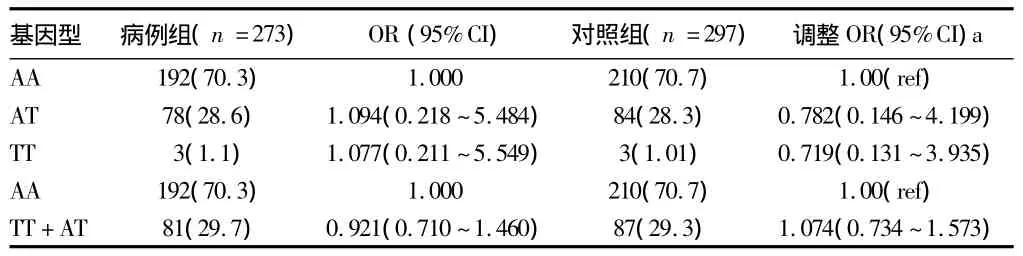
表3 IFN-γ基因多态性位点与肺结核易感性的多因素分析
3 讨论
人类IFN-γ基因全长5755 bp,位于常染色体12q14,含4个外显子和3个内含子。研究发现,IFN-γ基因具有6个多态性位点,分别位于启动子、内含子1、内含子3,以及3’端非编译区[7]。研究最多的是与第一内含子5’末端的(CA)12重复序列相邻的+874位点T/A,+874A/T多态性位点位于转录因子NF-kappaβ的结合位点中,且当多态性位点为T等位型时,该结合位点存在[8]。IFN-γ +874T等位序列具有 NF-kappaβ 结合活性,该结合对于IFN-γ的转录具有调控作用,使IFN-γ的表达量呈现出个体差异。研究表明+874AA和TT基因型分别为低表达量基因型和 TT为高表达量基因型[6,8]。同时,机体内IFN-γ表达量的高低将直接影响到机体免疫反应效应的强弱,进而影响到疾病的进程及临床转归。在结核感染过程中,IFN-γ是抗MTB感染的保护性因子,高表达量的IFN-γ促进巨噬细胞对抗原的呈递和自身的活化,启动机体的免疫反应,从而增加巨噬细胞清除MTB的活性。
研究表明IFN-γ+874A/T基因型与结核病的易感性显著相关,Lopez-Maderuelo等在对113例痰菌阳性肺结核、207例健康密切接触者及100例无结核患者接触史、无BCG接种史的健康对照的研究中发现,携带+874AA基因型的个体患结核病的危险性是具有其它基因型个体的3.75倍[6]。同样,Sallakci也认为携带AA基因型的个体患结核的危险性可以增加1.41倍,而携带TT基因型的个体患结核的危险性下降至30%[9]。在冈比亚人群[10]、南非人群[11]、克罗地亚人群[12]、巴西人群和印度尼西亚人群[13]中进行了大规模的病例-对照研究,均证实了AA基因型别与宿主对结核病易感性相关。然而,另有研究小组在不同人群进行的类似研究得出的结果与之不符,甚至正好与之相反[14]。
本研究利用病例对照研究将遗传因素与环境因素综合考虑,对结核病的危险因素进行了问卷调查,同时通过多因素Logistic回归分析排除其可能引起的混杂影响,从根本上探讨IFN-γ+874A/T基因与结核病易感性的关联。结果显示调整了结核暴露史和卡介苗接种史两个环境因素后,各基因型在病例和对照中的分布无显著性差异。本研究表明+874A/T基因多态性与结核发病不存在显著关联。分析人群中IFN-γ基因与结核病的关联研究上存在差异的原因,可能是由不同的遗传背景差异或不同的基因-环境间的交互作用造成,同时我们也不能排排除由于样本量差别、研究设计差异等客观因素引起的差异。因此,真正关联有待在不同人群中和更大样本量基础上深入研究。
1 Corbett EL,Watt CJ,Walker N,et al.The growing burden of tuberculosis:global trends and interactions with the HIV epidemic.Arch Intern Med,2003,163:1009.
2 林定文,兰江,黎国形.涂阳肺结核病人家庭接触者发病的研究.中国全科医学,2010,13:31:313-315.
3 Rossouw M,Nel HJ,Cooke GS,et al.Association between tuberculosis and polymorphic NFkappaB binding site in the interferon gamma gene.Lancet,2003,361:1871-1872.
4 Ziv BA,Eytan M,Orit P,et al.Cytokine gene polymorphismis in patients infected with HBV.Am J Gastroenterol,2003,98:144-150.
5 Matos GI,Covas Cde J,Bittar Rde C,et al.IFNG polymorphism is not associated with American tegumentary leishmaniasis susceptibility but can inxuence leishmania induced IFN-gamma production.BMC Infect Dis,2007,7:33.
6 López-Maderuelo D,Arnalich F,Serantes R,et al.Interferon-γ and interleukin-10 gene polymorphisms in pulmonary tuberculosis.Am J Respir Crit Care Med,2003,167:970-975.
7 Chevillard C,Henri S,Stefani F,et al.Two new polymorphisms in the human interferon gamma(IFN-gamma)promoter.Eur J Immunogenet,2002,2:53-56.
8 Khani-Hanjani A,Lacalle D,Hoar D,et al.Association between dinucleotide repeat in non-coding region of interferon-gamma gene and susceptibility to,and severity of,rheumatoid arthritis.Lancet,2000,356:820-825.
9 Sallakci N,Coskun M,Berber Z,et al.Interferon-gamma gene+874T-A polymorphism is associated with tuberculosis and gamma interferon response.Tuberculosis,2007,87:225-230.
10 Newport MJ,Awomoyi AA,Blackwell JM.Polymorphism in the interferon-1 gamma receptor 21 gene and susceptibility to pulmonary tuberculosis in the Gambia.Scand J Immunol,2003,58:383-385.
11 Fraser DA,Bulat-Kardum L,Knezevic J,et al.Interferon-gamma receptor-1 gene polymorphism in tuberculosispatient s f rom Crotia.Scand J Immunol,2003,58:480-484.
12 Amim LH,Pacheco AG,Fonseca-Costa J,et al.Role of IFN-gamma+874T/A single nucleotide polymorphisms in the tuberculosis outcome among Brazilian subjects.Mol Biol Rep,2008,35:563-566.
13 Sahiratmadja E,Baak-Pablo R,de Visser AW,et al.Associated of polymorphisms in IL-12/IFN-gamma pathway genes with susceptibility to pulmonary tuberculosis in Indonesia.Tuberculosis(Edinb),2007,87:303-311.
14 Cooke GS,Campbell SJ,Sillah J,et al.Polymorphism within the Interferon Gamma/Receptor complex is associated with pulmonary tuberculosis.Am J Respir Crit Care Med,2006,174:339-343.

