CCl4诱导的大鼠肝纤维化模型肝纤维化逆转与MAPK信号通路的研究
李政通,李 俊,黄 成,李 浩,章圣鹏,黄 艳,陶 辉
(安徽医科大学药学院,安徽天然药物活性研究省级重点实验室,国家中医药管理局中医药三级实验室“中药药理实验室”,安徽合肥 230032)
肝纤维化是肝脏对慢性损伤的一种修复反应,是持续性肝损伤的共有病理改变,肝细胞发生持续、反复的坏死或炎症刺激,大量纤维增生同时伴有纤维降解的相对或绝对不足,ECM在肝内大量沉积并最终演变为肝硬化[1-3]。近来研究发现[4-5],肝纤维化有逆转恢复的可能,在人或动物模型均有报道。CCl4诱导大鼠肝纤维化模型是一个经典模型,在肝纤维化模型成功后,停止用CCl4诱导,大鼠肝纤维化也有类似的逆转恢复期,然而其逆转恢复的机制尚不清楚[6-7]。MAPK信号通路是真核细胞调控介导细胞内信号转导的重要系统,主要包括ERK/MAPK、JNK/MAPK、p38/MAPK三条信号通路,其在肝纤维化发生、发展过程中亦有重要作用[8]。然而,MAPK信号通路在肝纤维化逆转过程中的作用目前研究较少。为此,本实验采用CCl4诱导大鼠肝纤维化模型,研究其逆转过程肝纤维化大鼠肝脏中MAPK通路蛋白表达变化,以期了解MAPK信号通路与肝纤维化自发逆转的关系。
1 材料与方法
1.1实验动物Sprague-Dawely(SD)大鼠,♂,体质量200~250 g。与安徽医科大学实验动物中心提供(动物合格证号:皖医实动准字第01号)。
1.2主要药品与试剂CCl4(AR级,汕头西陇化工厂);丙氨酸氨基转移酶(ALT)、天门冬酸氨基转移酶(AST)测定试剂盒、羟脯氨酸(Hyp)试剂盒(南京建成生物工程研究所),层粘连蛋白(LN)、Ⅲ型前胶原氨端肽(PⅢNP)放免试剂盒均购自北京北方生物技术研究所;兔抗ERK1/2和p-ERK1/2多克隆抗体:Santa Cruz产品;鼠抗 JNK1/2、p-JNK1/2、p38、pp38多克隆抗体:Cell Signaling产品。
2 方法
2.1动物模型的建立与处理SD大鼠90只,随机分为正常组(n=40)和肝纤维化逆转模型组(n=50)。模型组大鼠皮下注射50%CCl4(CCl4∶花生油=1 ∶1,1 ml·g-1),正常组以同样方法注射等量花生油作对照,每周二、周五注射,一周两次,共12周。模型组于造模结束后第 0、2、4、6、8周分批处死动物,每次8只,同时处死8只正常大鼠作为对照。大鼠取血后室温静置 1 h,3 000 r·min-1离心15 min,分离血清。按试剂盒操作赖氏法检测ALT、AST,ELISA法检测LN、PⅢNP,放免法测肝组织中 Hyp含量。Masson染色观察肝组织中胶原沉积。病理组织观察经体积分数为0.10的甲醛固定的组织,石蜡包埋,做常规组织切片,Masson胶原染色,100倍光镜下观察并比较各组织的病理状况,并对Masson染色结果进行半定量分析。肝纤维化程度分级标准为[9]:0:无纤维化;1:轻度纤维化,纤维沉积仅位于小叶中央;2:中度纤维化,纤维沉积扩展至小叶中央之外,但未至小叶边缘;3:严重肝纤维化,纤维沉积扩展至小叶边缘;4:早期肝硬化(定性标准)。肝组织迅速冷冻保存。
2.2Western blot法检测蛋白表达取正常组、模型组、恢复2、4、6、8周各组肝组织分别约100~150 mg。用RIPA蛋白裂解液(主要成分为1%TritonX-100,1%Noidet P-40,0.5%sodium deoxycholate,1 mmol·L-1PMSF和蛋白酶抑制剂复合物)裂解进行匀浆、裂解,12 000 r·min-1离心后取上清(蛋白)分装于0.5 ml离心管中,BCA法测定蛋白浓度。取总蛋白5 μg进行12%SDS-PAGE电泳,经PVDF膜转移。第一抗体在4℃中孵育过夜,再与HRP偶联第二抗体室温中孵育1 h,ECL化学发光底物显色,X线片放射自显影压片。按照以上步骤,分别检测 p-ERK、ERK、p-JNK、JNK、p-p38和 p38表达。定量分析结果分别以p-ERK/ERK、p-JNK/JNK、p-p38/p38蛋白表达量比值表示。成像结果采用Quantity One V 4.6软件分析,结果重复3次。
2.3统计学处理实验数据采用±s表示,采用SPSS 11.5统计软件进行单因素方差分析和t检验处理;等级资料采用非参数秩和检验;相关性分析使用Pearson相关。
3 结果
3.1各实验分组大鼠血清学指标的变化
3.1.1血清ALT、AST比较 见Tab 1,实验数据表明,大鼠血清中ALT、AST在模型组最高,且与正常组相比有差异有显著性(P<0.01)。逆转恢复期逐渐减少,其中逆转4周、逆转6周、逆转8周降低明显,与模型组相比差异均有显著性(P<0.05)。
Tab 1 Comparison of ALT and AST in various groups(±s,n=8)

Tab 1 Comparison of ALT and AST in various groups(±s,n=8)
**P<0.01 vs normal;#P<0.05,##P<0.01 vs model
Group ALT/U·L-1 AST/U·L -1 Normal 29.14 ±6.92 81.11 ±8.33 Model 75.07 ±17.24** 136.12 ±14.24**2 wk 61.56 ±1.42 124.64 ±12.23 4 wk 56.1 ±12.04# 119.87 ±12.11#6 wk 46.62 ±10.33## 109.07 ±11.52##8 wk 33.54 ±9.04## 96.02 ±9.54##
3.1.2各组大鼠血清LN、PⅢNP的比较 Tab 2所示,LN、PⅢNP在模型组最高,且与正常组相比有明显差别(P<0.01)。逆转恢复期逐渐减少,其中逆转4周、逆转6周、逆转8周降低明显,与模型组相比均有明显差别(P<0.05)。
Tab 2 Comparison of LN and PⅢNP in various groups(±s,n=8)

Tab 2 Comparison of LN and PⅢNP in various groups(±s,n=8)
**P<0.01 vs normal;#P<0.05,##P<0.01 vs model
Group LN/μg·L -1 PⅢNP/μg·L -1 Normal 75.06 ±24.62 8.53 ±2.84 Model 157.53 ±51.5** 30.56 ±10.02**2 wk 134.59 ±44.10 22.41 ±7.35 4 wk 107.87 ±35.24# 14.69 ±4.93##6 wk 97.47 ±31.92## 11.01 ±3.65##8 wk 87.92 ±28.72## 9.23 ±3.03##
3.2病理组织学结果
3.2.1肝组织Hyp含量比较 如Tab 3所示大鼠肝组织中的Hyp含量在模型组中最高,与正常组相比有明显差别(P<0.01),逆转恢复期逐渐降低,逆转4、6、8周降低明显,且与模型组差异有显著性(P<0.05)。
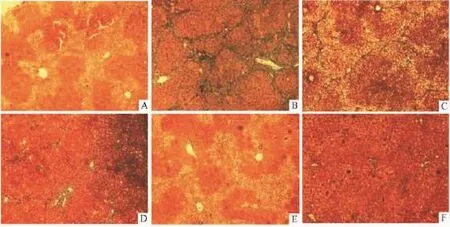
Fig 1 Pathological results of the liver fibrosis rats about different recovery phases induced by CCl4
Tab 3 Comparison of Hyp in various groups(±s,n=8)
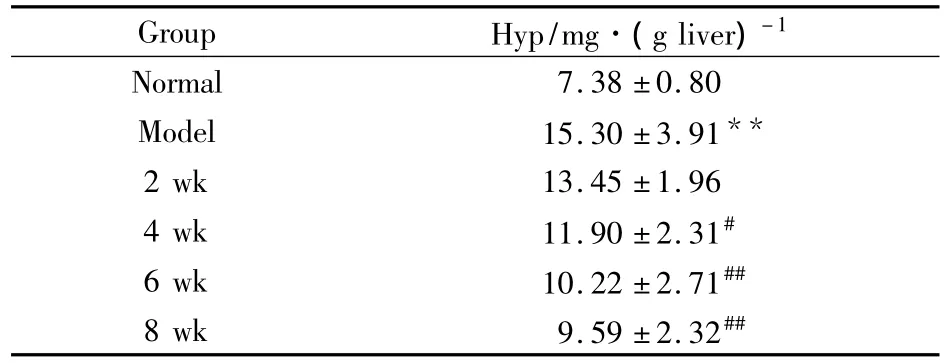
Tab 3 Comparison of Hyp in various groups(±s,n=8)
**P<0.01 vs normal;#P<0.05,##P<0.01 vs model
Group Hyp/mg·(g liver)-1 Normal 7.38 ±0.80 Model 15.30 ±3.91**2 wk 13.45 ±1.96 4 wk 11.90 ±2.31#6 wk 10.22 ±2.71##8 wk 9.59 ±2.32##
3.2.2病理形态学观察 Masson胶原染色显示(Fig 1),正常组肝小叶结构完整,肝细胞排列整齐仅有少量血管壁着蓝色。模型组肝组织有大量胶原纤维沉积,着蓝色,纤维间隔较厚,形成明显的假小叶,并伴有大量的脂肪空泡。逆转期各组炎症细胞浸润和脂肪空泡逐渐减少,纤维沉积程度减轻,纤维间隔变窄,至恢复8周后,肝纤维化明显减轻,提示模型有明显的逆转期。

Tab 4 Pathological results of the liver fibrosis rats about different recovery phases induced by CCl4(n=8)
3.3各组大鼠肝组织中MAPK信号通路蛋白表达变化3.3.1ERK1/2通路蛋白表达变化 由Fig 2可见,p-ERK1/2在模型组表达最低,与正常组相比差异有显著性(P<0.01);逆转2周开始逐渐升高,逆转4周表达最高,与模型组相比差异有显著性(P<0.01),逆转6周、逆转8周逐渐降低。
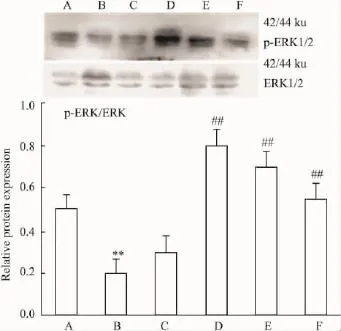
Fig 2 Relative expression levels of ERK signaling way proteins detected by Western blot(±s,n=8)
3.3.2JNK信号通路蛋白表达变化 由Fig 3可见,p-JNK1/2在肝纤维化模型期表达最低,与正常组相比差异有显著性(P<0.01);逆转期逐渐增高,与模型组相比差异有显著性(P<0.01)。
3.3.3p38信号通路蛋白变化 由 Fig 4可见,pp38在肝纤维化模型组表达最高,与正常组相比差异有显著性(P<0.01),逆转2周表达较高与模型组差异不明显,逆转4周(P<0.05)、6周、8周逐渐降低与模型组相比差异有统计学意义(P<0.01)。
3.4MAPK信号通路蛋白与Hyp相关性分析结果Hyp为胶原蛋白特有的氨基酸,测定肝组织羟脯氨酸含量可间接反映肝纤维化的程度[10]。MAPK信号通路蛋白与Hyp相关性研究能够揭示其与肝纤维化逆转的关系。分析结果为p-ERK/ERK与Hyp相关系数r=-0.46,P=0.003;p-JNK/JNK与Hyp相关系数r= -0.53,P=0.0004;p-p38/p38与Hyp相关系数r=0.81,P=0.0001。
4 讨论
CCl4皮下注射为建立肝纤维化经典方法,诱导12周后停止注射后可自发逆转[5-6]。本实验中反映肝损伤和肝纤维化指标 ALT、AST、Hyp、LN、PⅢNP,在CCl4皮下注射12周后明显增加,于自发恢复2、4、6、8周逐渐降低,同时,病理组织学 Masson胶原染色也显示逆转期,大鼠肝脏病理表现与肝纤维化分期逐渐改善,表明大鼠肝纤维化及其逆转期动物模型建立成功。Hyp为胶原蛋白特有的氨基酸,测定肝组织羟脯氨酸含量可间接反映肝纤维化的程度,是肝纤维化检测的重要指标,也是动物实验中检测肝纤维化程度最为常用的指标[10]。因而,研究肝纤维化逆转期MAPK信号通路蛋白与Hyp的相关性可以进一步揭示MAPK信号通路在肝纤维化逆转中所起的作用。
肝纤维化为肝损伤共有的病理改变,肝损伤时肝细胞凋亡增加,ERK信号转导通路在肝损伤的修复过程中发挥重要作用[11],JNK信号通路也参与调控许多细胞增殖、分化与凋亡。采用cDNA微阵列杂交和Nothern杂交法,发现ERK信号通路相关基因在肝纤维化逆转时明显活化[12]。本实验从蛋白表达角度研究显示,肝纤维化模型期p-ERK1/2表达明显下降,与正常组相比差异有显著性,逆转恢复期表达逐渐增强,4周达最高,此后逐渐下降。肝纤维化指标Hyp的含量亦在模型组最高,逆转期逐渐降低,且Hyp与p-ERK/ERK表达呈负相关,说明p-ERK的表达与肝纤维化严重程度有负相关性。JNK1/2蛋白在肝纤维化模型期表达明显下降,与正常组相比差异有显著性,逆转期表达增加且与模型期相比差异有显著性,表明JNK通路在肝纤维化逆转恢复期亦明显活化。p-JNK的表达与Hyp也呈负相关,说明p-JNK与p-ERK的表达均与肝纤维化病变程度有负相关性。有研究显示上调JNK蛋白表达可促进肝细胞DNA的合成[13],表明p-JNK表达与肝细胞增殖关系密切。文献报道纤维化逆转期肝细胞的增殖活动明显增强[14],因而推测在肝纤维化逆转期ERK1/2和JNK1/2信号蛋白表达增多,二者共同作用促进肝细胞增殖可能是肝纤维化逆转恢复的重要机制之一。
p38信号传导通路在炎症反应、细胞应激反应、细胞迁移、细胞凋亡以及细胞表型转分化等方面起着重要作用[15],随着肝纤维化的发展p-p38表达增多,且与α-SMA表达呈正相关,同时,免疫组化pp38表达定位于肝脏间质细胞,推测其可能通过诱导HSC的活化、增殖促进纤维化的形成[16]。本研究结果显示,模型期p-p38蛋白表达最高,逆转4周后蛋白表达水平明显下降,逆转6~8周后表达逐渐降至较低水平。进一步研究发现p-p38/p38与Hyp呈正相关且差异有统计学意义,提示p-p38的表达增多能够促进肝纤维化形成,表达减少促进肝纤维化逆转。由此推测肝纤维化逆转期p-p38表达减少也可能为肝纤维化逆转恢复的机制之一。
综上所述,本研究表明MAPK信号通路与肝纤维化逆转恢复关系密切。其中ERK、JNK、p38三条信号通路均参与肝纤维化逆转恢复,ERK和JNK通路与肝纤维化逆转期有负相关性,p38通路与肝纤维化逆转期呈正相关。然而,肝纤维化发病和自发恢复机制复杂,参与介导的信号传导通路众多,故肝纤维化逆转的具体机制还有待进一步研究。
[1]Friedman S L.Mechanisms of hepatic[J].Gastroenterology,2008,134(6):1655 -69.
[2]Friedman S L.Hepatic stellate cells:protean,multifunctional,and enigmatic cells of the liver[J].Physiol Rev,2008,88:125-72.
[3]黄 艳,黄 成,李 俊.肝纤维化病程中Kupffer细胞分泌的细胞因子对肝星状细胞活化增殖、凋亡的调控[J].中国药理学通报,2010,26(1):9-13.
[3]Huang Y,Huang C,Li J.Effect of cytokines secreted from Kupffer cell on HSC proliferation,apoptosis in hepatic fibrosis process[J].Chin Pharmacol Bull,2010,26(1):9 - 13.
[4]Dienstag J L,Goldin R D,Heathcote E L,et al.Histological outcome during long-term lamivudine therapy[J].Gastroenterology,2003,124(1):105 -17.
[5]Ueberham E,Low R,Ueberham U,et al.Conditional tetracycline-regulated expression of TGF-beta1 in liver of transgenic mice leads to reversible intermediary fibrosis[J].Hepatology,2003,37(5):1067-78.
[6]Iredale J P,Benyon R C,Pickering J,et al.Mechanisms of spontaneous resolution of rat liver fibrosis.Hepatic stellate cell apoptosis and reduced hepatic expression of metalloproteinase inhibitors[J].J Clin Investig,1998,102(3):538 -49.
[7]Issa R,Zhou X,Trim N,et al.Mutation in collagen-1 that confers resistance to the action of collagenase results in failure of recovery from CCl4-induced liver fibrosis,persistence of activated hepatic stellate cells,and diminished hepatocyte regeneration[J].FASEB J,2003,17(1):47 -9.
[8]蒋明德.肝纤维化发生中的MAPK信号传导通路[J].第四军医大学报,2005,26(8):766 -7.
[8]Jiang M D.Liver fibrosis in the MAPK signaling pathway[J].J Fourth Mil Med Univ,2005,26(8):766 -7.
[9]Oh W Y,Pyo S,Lee K R,et al.Effect of Holotrichia diomphalia larvae on liver fibrosis and hepatotoxicity in rats[J].J Ethnopharamacol,2003,87(2-3):175 - 80.
[10]李映菊,汪煜华,刘玉美,等.白屈菜红碱对肝纤维化大鼠肝脏病理学和肝脏羟脯氨酸含量的影响[J].实用肝脏病杂志,2009,12(3):167 -70.
[10]Li Y J,Wang Y H,Liu Y M,et al.Effects of chelerythine on hepatic pathology and hydroxyproline level in rats with CCl4-induced hepatic fibrosis[J].J Chin Hepatol,2009,12(3):167 - 70.
[11]周 滔,刘成海.肝细胞凋亡在肝纤维化中的作用[J].肝脏,2007,12(6):503.
[11]Zhou T,Liu C H.Hepatocyte apoptosis in liver fibrosis[J].Chin Hepatol,2007,12(6):503.
[12]潘 勤,谢渭芬,张忠兵,等.肝纤维化逆转中MAPK/ERK信号转导通路的活化及其特征[J].中国现代医学杂志,2006,16(15):2253-60.
[12]Pan Q,Xie W F,Zhang Z B,et al.Activation and characteristics of MAPK/ERK signal pathway during spontaneous resolution of hepatic fibrosis[J].China J Mod Med,2006,16(15):2253 -60.
[13]董秀山,赵浩亮,马晓明.低浓度胆酸上调JNK蛋白表达:可促进肝细胞DNA的合成[J]?中国组织工程研究与临床康复,2010,14(31):5818 -22.
[13]Dong X S,Zhao H L,Ma X M .Low concentration of cholic acid up-regulates JNK protein expression:Can it promote synthesis of liver cell DNA[J]?J Clin Rehabil Tissue Engin Res,2010,14(31),5818 -22.
[14]Ueki T,Kaneda Y,Tsutsui H,et al.Hepatocyte growth factor gene therapy of liver cirrhosis in rats[J].Nat Mod,1999,5(2):226-30.
[15]Ono K,Har J.The p38 signal transduction pathway:activation and function[J].Cell Signal,2000,12:1 - 13.
[16]吴文娟,杨妙芳,许小兵,等.p38MAPK在大鼠实验性肝纤维化发生中的表达及其意义[J].世界华人消化杂志,2008,16(34):3822-7.
[16]Wu W J,Yang M F,Xu X B,et a1.Expression and its location of p38MAPK in CCl4-induced hepatic fibrosis in rats[J].World Clin J Digestol,2008,16(34):3822 -7.

