影响辽宁绒山羊母羔胚胎体外生产因素的研究
豆兴堂 ,宋先忱,郭 丹 ,张兴会
(1.辽宁省辽宁绒山羊原种场有限公司,辽阳 111000;2.辽宁省畜牧科学研究院,辽阳 111000)
自然情况下,成年母羊不经激素处理,活体采卵仅能获得3.6~6.6枚可用卵母细胞[1],经生殖激素处理每次能获得10~20枚[2],而每只幼龄羔羊在生殖激素诱导卵泡发育下平均每次可获得80~120枚可用卵母细胞[3]。因此,如果将幼羔超排技术与羊体外受精技术、胚胎移植技术进行组装集成(juvenile in vitro embryo transfer,JIVET),运用于养羊生产,可将羊的繁殖效率较常规胚胎移植提高约20倍,较自然繁殖提高约60倍,并使世代间隔缩短到正常的1/3~1/4,这将充分挖掘和利用优良母羊的早期繁殖潜力,大大加快羊育种及品种改良进程,同时也将解决羊胚胎移植商业化所需胚胎来源匮乏及胚胎生产成本昂贵的问题,将大大促进胚胎生产的商业化应用,应用前景十分广阔。本试验利用4~8周龄辽宁绒山羊母羔,进行超排、卵母细胞成熟培养、体外受精等研究,期望建立绒山羊体外胚胎生产技术体系。
1 材料与方法
1.1 材料 4~8周龄辽宁绒山羊母羔羊。隔离饲养于辽宁省畜牧科学院内,母羔与大母羊同群舍饲,主要饲喂苜蓿草、羊草,补饲羔羊颗粒料、盐砖等,自由饮水。
1.2 主要仪器设备 CO2培养箱:HERA Cell 150,美国;立体显微镜:Minitube,德国;倒置显微镜:LEICA DMI 3 000 B,德国;电子天平:十万分之一克,北京赛多利斯天平公司。
1.3 主要试剂 FSH:批号R9D19A;LH:批号R8K03VB;均为加拿大产。PMSG:宁波激素厂;Heparin:Bioszune;EGS:采集发情辽宁绒山羊母羊血液,56℃灭活30 min,0.22 μm 滤过;TCM199、E2、N-EAA、EAA,Sigma;超纯水:Milli-Q纯水仪制;其余试剂均为Sigma产。
1.4 母羔超排采集卵母细胞 最后一次超排注射12~14 h后采集卵母细胞,常规手术法暴露卵巢,用10mL注射器逐一刺破卵泡抽取卵泡液及卵母细胞。应注意抽吸力量要轻。采卵液为:TCM-HCO3+10 ug/mL Heparin+5%EGS+2.2 mg/mL Na-pyrunate+0.146 mg/mL L-Glutamine+2.383 mg/mL HEPES+2.603 mg/mL HEPES-Na+10 μL/mL青链霉素。
1.5 卵母细胞成熟培养 采集的卵母细胞液在37℃40倍立体显微镜下,用捡卵针捡取卵母细胞。在采卵液、成熟培养液中各洗3遍,挑选A(卵丘细胞3层以上,胞质均匀)、B(1~2层卵丘细胞,胞质均匀)级卵母细胞进行成熟培养。用四孔板培养,每孔600 μL成熟液,上覆矿物油,38.5℃、5%CO2预先平衡2 h以上。将洗过的卵母细胞转入四孔板,每孔30~35枚卵母细胞在38.5℃、5%CO2下进行体外成熟培养24~26 h。
1.6 体外受精 精子获能处理:将自制细管冻精,放入38~40℃水浴解冻,检查活力。取100~200 μL精液轻轻加入到装有600~800 μL获能液(添加20 μg/mL肝素的SOF液,培养箱中平衡2 h以上)试管底部,将试管放入CO2培养箱,精子上游获能处理20~30 min。
卵母细胞处理:将成熟培养的卵母细胞从成熟培养液中移出,转入1%透明质酸酶的受精液中作用1~2 min,轻轻吹打,去掉颗粒细胞;在受精液中洗涤3次,再将卵母细胞转入含有受精液的四孔板(每孔400 μL受精液,上覆矿物油,培养箱中平衡2 h以上)中,每孔25~30枚卵母细胞,准备受精。
精卵体外受精:轻轻吸取上游获能处理试管内液体的上清液,在立体显微镜下,轻轻加入到含有卵母细胞的四孔板中,每孔100~150 μL上清液,加入时注意避免形成气泡。做好记录,将四孔板放入CO2培养箱,精卵受精作用 22~24 h。
1.7 早期胚胎体外发育培养 精卵受精作用后,轻轻吹打卵母细胞去掉粘附的精子,将假定合子在SOF-HCO3+BSA等发育液中洗涤3~5次,移入600 μL发育液四孔板培养孔中,每孔 25~30 枚,38.5 ℃、5%CO2、5%O2、饱和湿度下培养24 h。显微镜下观察卵裂情况,移出弃掉单细胞卵,统计卵裂率,做好记录。其余胚胎继续培养24 h,换SOF-HCO3+10%EGS等发育液继续培养,每48 h更换1/2新鲜培养液。4~5 d后观察囊胚发育情况,统计囊胚率。
1.8 实验设计
1.8.1 不同超排方法对超排效果、胚胎发育的影响 将12只母羔随机分成2组。Ⅰ组用PMSG+FSH超排处理,即先肌肉注射PMSG 400 u,以后间隔12 h分别肌肉注射FSH 40 mg 3次;Ⅱ组用FSH+PMSG超排处理,即先间隔12h分别肌肉注射FSH3次,最后再肌肉注射PMSG400u。用SOF-HCO3培养系做受精、发育培养。
1.8.2 成熟液添加EGF对卵母细胞成熟、胚胎发育的影响 用PMSG+FSH法超排母羔,2种成熟液进行成熟培养,将成熟后的卵母细胞用0.5%的透明质酸酶脱去卵丘细胞,在体视显微镜下用吸胚管反复拨动卵母细胞,观察是否排出第一极体,统计极体率。
TCM-HCO3+10 μg/mL FSH+10 μg/mL LH+1 μg/mL E2+10%EGS+2.2 mg/mL Na-pyrunate+0.146 mg/mL LGlutamine+0.012 mg/mL cysteine+10 μL/mL 青链霉素,为对照组。EGF组:对照组+20 ng/mL EGF。用SOF-HCO3培养系做受精、发育培养。
1.8.3 两种受精体系卵裂率、囊胚率比较 用PMSG+FSH法超排母羔,用添加EGF的成熟液成熟培养,分别用TALP液、SOF-HCO3液体外受精,Ⅰ组:用SOF-HCO3+20 μg/mL Heparin等做精子获能处理液,SOF-HCO3+BSA等做受精、发育培养。Ⅱ组:用sperm-mTyrode液做精子洗涤液,fert-mTyrode+20 μg/mL Heparin等液做精子获能、受精,SOF-HCO3+BSA等做发育培养。比较2组卵裂率、囊胚率。
1.9 统计分析 试验数据分析处理:采用SPSS 13.0软件“Independent-Samples T Test”对数据进行统计学比较分析。
2 结果与分析
2.1 超排方法对卵母细胞数、卵裂率、囊胚率的影响 由表1可知,2种超排方法获得的卵母细胞数无显著差异(P>0.05),但卵裂率和囊胚率均有极显著差异(P<0.01)。

表1 不同超排方法对超排效果、胚胎发育的影响
2.2 添加EGF对卵母细胞成熟、胚胎发育的影响 由表2可见,添加EGF组成熟率显著高于对照组(P<0.05),卵裂率差异不显著(P>0.05),但囊胚率差异显著(P<0.05)。见图1~4。

表2 添加EGF对卵母细胞成熟、胚胎发育的影响

图1 母羔超排卵巢

图2 卵母细胞(第一极体)400×

图3 2~4细胞胚胎200×
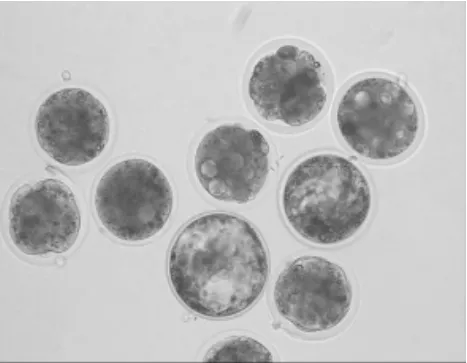
图4 囊胚100×
2.3 两种受精体系对胚胎发育的影响 由表3可见,SOF受精体系卵裂率显著高于TALP(P<0.05),囊胚率极显著高于 TALP(P<0.01)。

表3 受精体系对胚胎发育的影响
3 讨论
幼羔超排效果除了易受羔羊年龄、个体差异等影响外,超排方法对超排效果影响也较大。刘东军[4]等对2~4月龄羔山羊用FSH、FSH+LH(静脉注射)和FSH+LH(肌肉注射)3种方法进行超排处理,分别平均回收16.0、20.3和15.0枚卵母细胞。成熟卵母细胞经体外受精、体外发育培养后其2~4细胞胚胎的发生率分别为5.6%、6.7%和31.7%。张锁链[5]等以FSH或FSH-LH 4种不同处理方法对29只68~110日龄羔山羊进行超排处理,结果共采集卵泡卵母细胞708枚,平均每只羔羊采卵24.4枚。分别用经钙离子载体A-23178或肝素进行获能处理的精子对体外培养成熟的卵子进行体外受精,结果精子穿入卵率分别为54.8%和34.4%,发育至2~4细胞胚的卵裂率分别为28.6%和41.9%。PMSG是糖蛋白激素中唯一独特的促性腺激素,同一分子中具有黄体生成素(luteinizing hormone,LH)和促卵泡生成素(follicle stimulating hormone,FSH)2种促性腺激素的活性,由于PMSG在动物体内的半衰期较长,同一分子又具有FSH和LH的双重活性,在动物体内,其生理作用是对卵巢和睾丸的靶细胞受体,特异性极强。母羔超排中,大多数都是在最后注射PMSG。本实验结果显示,先注射PMSG组卵母细胞卵裂率、囊胚率极显著高于后注射PMSG组,可能与后注射PMSG作用时间短、卵母细胞成熟度不够,尤其胞质蛋白合成储存不足有关,还需进一步试验探讨。
EGF(epidermal growth factor),上皮生长因子,表皮细胞生长因子是人体内的一种活性物质,是由53个氨基组成的活细胞,由刺激表皮细胞生长因子受体之酪氨酸磷酸化,达到修补增生肌肤表层细胞,其最大特点是能够促进细胞的增殖分化,从而以新生的细胞代替衰老和死亡的细胞。王艾平[6]等在卵母细胞成熟液中添加EGF,结果含50 ng/mL EGF(表皮生长因子)组COCs成熟率(75.45%~75.80%)和卵裂率(72.4%~74.1%)均显著高于其它组。表明EGF对COCs体外成熟和卵裂发育具有明显的促进作用。刘丑生[7]等在绵羊卵母细胞成熟液中添加EGF,结果为50 ng/mL的EGF的成熟率和卵裂率分别为71.2%和45.5%,显著高于对照组和10、20、30、40 ng/mL组(P<0.05)。国外较多采用TALP液研究性成熟前山羊卵母细胞的体外受精,用添加了50 μg/mL肝素的mDM液获能,用添加1 μg/mL亚牛磺酸的TALP液受精[8]。张锁链等采集种公羊新鲜精液,以0.5 μMA 23187处理1 min或在培养液中添加50 μg/mL肝素获能,用2 mM咖啡因、20 μg/mL BSA的 BO液作受精液,2~4细胞胚的卵裂率分别为28.6%和41.9%。赵宏远[9]采集超排母山羊羔卵母细胞,成熟培养后用SOF液受精,受精培养23~26 h组,平均卵裂率为48.33%。PMSG+FSH超排、卵母细胞成熟液添加20 ng/mL EGF、SOF基础液作受精液、胚胎发育液较适合绒山羊母羔体外胚胎生产,如何进一步提高效率还需进一步探索。
[1]Shirazi A,Shams-Eafandabadi N,Hosseini S M.A comparison of two recovery methods of ovine oocytes for in vitro maturation[J].Small Ruminant Research,2005,58:283-286.
[2]Koeman J,Keefer C L,Baldassarre H,et al.Developmental competence of prepubertal and adult goat oocytes cultured in semi-defined media following laparoscopic recovery[J].Theriogenology,2003,60:879-889.
[3]Kelly J M,David O,Simon K,et al.Enhanced efficiency in the production of offspring from 4 to 8-week-old lambs[J].Theriogenology,2005,63:1876-1890.
[4]刘东军,张锁链,王建国,等.不同超数排卵方法所获羔山羊卵母细胞体外成熟率及体外受精率的比较[J].畜牧兽医学报,1996,27(5):422-427.
[5]张锁链,刘东军,廛洪武,等.羔山羊的超数排卵及体外受精[J].内蒙古大学学报:自然科学版,1994,25(2):205-208.
[6]王艾平,魏泓,孙新民,等.表皮生长因子、巯基乙醇和亚硫磺酸对山羊体外胚胎生产的影响研究[J].中国草食动物,2005,25(1):3-6.
[7]刘丑生,陆会宁,张利平,等.EGF和IGF-I对绵羊卵母细胞体外成熟和卵裂的影响[J].畜牧兽医学报,2008,39(5):588-593.
[8]武建朝.利用性成熟前山羊卵母细胞体外生产胚胎的研究[D].南京:南京农业大学,2007.
[9]赵宏远.影响山羊幼羔卵泡发育及体外受精效果主要因素的研究[D].保定:河北农业大学,2009.

