具抑菌活性的鱼腥草内生细菌的筛选*
胡汝晓,谢丙炎,谭周进,王春晖
(1.湖南省食用菌研究所,湖南 长沙 410013;2.中国农业科学院蔬菜花卉研究所,北京 100081;3.湖南中医药大学基础医学院,湖南 长沙 410208)
鱼腥草为三白草科多年生草本植物蕺菜 Houttuynia cordate Thunb.带根全草,又名侧耳根、紫蕺、猪鼻孔、九莲草等,广泛分布于我国中部、东南及西南各省区,具有抗菌、抗病毒、清热解毒、消痈排脓、尿通淋之功效,中医用于治疗肺痈吐脓、痰热喘咳、热痢、热淋、痈肿疮毒等病症[1]。植物内生菌可从多个层面影响其化学成分:独自合成化学物质[2-4],协助植物合成化学物质[5-6],影响植物合成与降解化学物质[2,5,7-8]。此外内生菌整体对植物化学成分也有影响[9],还可从进化水平上影响植物的化学成分[3,10]。从具有独特药用价值或生物多样性较为丰富地区生长的植物中较易分离出具有特殊代谢产物的菌株[11-14],同时能克服植物资源的不足,而鱼腥草正可满足这些要求。鱼腥草素对卡他球菌、溶血性链球菌、流感杆菌、肺炎双球菌、金黄色葡萄球菌和大肠杆菌有明显的抑制作用[15]。鱼腥草含有大量的内生菌,在寻找抗性微生物时,茎内生菌具有一定的优势[16]。因此,笔者以茎内生细菌为筛选抗性菌的重点,希望找到一些能合成鱼腥草素或其类似物的具有开发潜力的菌株。
1 材料与方法
1.1 主要材料
CR21G型高速冷冻智能离心机(日本日立公司);UV-2100型双光束紫外/可见分光光度计(中国北京瑞利分析仪器公司)。接种和培养仪器为国产,培养基Ⅰ配方为牛肉膏0.5 g,蛋白胨1 g,NaCl 0.5 g,琼脂 1.8 g,蒸馏水 100 mL,pH=7.0 ~7.6;培养基Ⅱ为培养基Ⅰ不加琼脂[17]。所用试剂为国产分析纯。鱼腥草采自湖南长沙周边菜园,生长环境为地下水位高、常年潮湿的地块;大肠杆菌(Escherichia coli)和金黄色葡萄球菌(Staphylococcus aureus)由本实验室提供。
1.2 内生菌分离
将鱼腥草连根挖起,先洗净根上泥土,再冲洗整株,室温下凉干表面明水,用无菌剪刀将根茎叶剪开,各取5 g,用75%酒精表面消毒5 min,然后用无菌水冲洗5次,取最后一次冲洗液(0.1 mL)涂布培养基Ⅰ平板,28℃下培养24 h,作为空白对照。在无菌条件下加10 mL无菌的磷酸盐缓冲液(0.05 mol/L,pH=7.8,W/V=1/2)碾磨样品,充分振荡15 min,以此为母液,梯度稀释至10-1,10-2,10-3,吸取菌液(0.1 mL)涂布培养基Ⅰ平板,28℃下培养24 h,根据外观形态特征,挑选单菌落一步纯化,做初步鉴定并保存。
1.3 点接法抑菌试验[18]
取大肠杆菌和金黄色葡萄球菌,用培养基Ⅰ培养,无菌操作,挑取适当菌量到装有无菌水的试管,打散摇匀制成菌悬液,取0.2 mL该菌悬液涂布培养基Ⅰ空白平板,放置20~30 min(至平板表面无明显菌液),作为检测平板备用。用接种环挑起芝麻大小的被检菌,接到检测平板上,28℃下培养24 h,观察有无抑菌圈。抑菌效果强弱用抑菌圈内外径之比表示。
1.4 发酵液滤纸片法抑菌试验[18]
取点接效果最好的一株菌株进行研究。具体操作为按检测平板制作方法制取检测平板。用培养基Ⅱ将目标菌在30℃和145 r/min条件下培养72 h(或处理后发酵液),用细菌过滤器(孔径为0.22 μm)过滤,用3层无菌干燥的小滤纸片(直径为6 mm)蘸取无菌发酵液,置检测平板上,28℃下培养24 h,观察有无抑菌圈,用抑菌圈外径 d(mm)表示抑菌作用强弱。
1.5 抗菌物质初步鉴定试验
发酵液制取:将目标菌接入培养基Ⅱ,在30℃和145 r/min条件下培养72 h,以 5 000 r/min转速(R20A2)离心 10 min,取上清液。
耐温试验:200 mL 发酵液,分别在 60,70,75,80,90 ℃下处理10 min,用滤纸片法做抑菌试验。
抗菌物质透析试验:取200 mL发酵液,装于5 000 Da透析袋,放入聚乙二醇(PEG-6000)中,4℃下浓缩至1/10体积,再在4℃蒸馏水中透析至AgNO3检测无沉淀(18 h),取透析袋中蛋白溶液,用滤纸片法做抑菌试验。
光吸收试验:取1 000 mL发酵液,55℃下旋转蒸发浓缩至100 mL,加300 mL无水乙醇,以10 000 r/min转速(R12A3)离心10 min,取上清,55℃下旋转蒸发浓缩至100 mL,以培养基Ⅱ同法操作溶液作为参比液校正基线,在200~800 nm波长范围内以2 nm为间隔进行扫描。将做完光吸收试验的溶液再在55℃下旋转蒸发浓缩至固体,加50 mL蒸馏水溶解,用滤纸片法做抑菌试验。
1.6 种属鉴定试验
按文献[17]方法,做目标菌的菌落形态,革兰氏染色和芽胞染色,鞭毛染色和细菌大小测定,糖、醇、糖苷类碳源的分解,淀粉水解,过氧化氢酶,明胶液化等试验。
2 结果与分析
2.1 鱼腥草内生菌的抗菌性特点
本试验分离出200个细菌菌株,由点接法测得结果。鱼腥草内生菌的抗菌性特点见表1。可见,刚分离时抗大肠杆菌和抗金黄色葡萄球菌株数比较接近,保存6个月并培养数代后抗菌菌株有所减少,且对大肠杆菌的抗性较易丧失,这就要求在筛选菌株中应重点关注对大肠杆菌抗性的稳定性。同时,可发现鱼腥草内生菌对两种菌的抗性具有连锁性,说明找到同时抗两种菌的物质是可能的。经点接法初选、滤纸片复选,笔者以抑菌圈内外圈之比、抑菌是否彻底、抑菌稳定性和形态差异性等为指标,从200个菌株中选出1个各项指标表现均较优良的细菌菌株。

表1 鱼腥草内生菌的抗菌性特点[株(%)]
2.2 目标菌抗菌能力
由表2可见,目标菌抗大肠杆菌和金黄色葡萄球菌的能力(抑菌圈内外径之比)分别为3.28和3.8,由于不同菌株在相同培养条件下菌落直径有较大差异(2~11 mm),因此筛选抗性菌株时不能只考虑抑菌圈内外径之比,对抑菌圈内径较大的菌株,还得考虑内外径之差。所选菌株菌落直径为5~7 mm。试验还表明,有些目标菌在对大肠杆菌和金黄色葡萄球菌有抑制作用的同时,大肠杆菌或金黄色葡萄球菌对目标菌也有一定的抑制或促进作用,即目标菌在抑菌试验中的菌落大小与纯培养试验中菌落大小(培养条件相同)有明显差异。

表2 目标菌抑菌能力
2.3 目标菌发酵液抑菌能力
以滤纸片法抑菌试验的抑菌效果差异不大,约为10 mm(滤纸片直径6 mm)。这主要是因为滤纸片所蘸发酵液量比较一致,放到无水平板上时,发酵液扩散直径比较一致,所以抑菌物质作用的范围也比较一致,但在作用时间以及抑菌是否彻底上存在较大差异。所选菌株抑菌时间在5 d以上,且抑菌彻底。
2.4 抗菌物质光吸收特性
发酵液光吸收特征见图1。可见,该菌株发酵液的初提液在鱼腥草素最大吸收峰283 nm波长[19-20]附近有特征吸收峰,说明目标菌确实分泌物质到发酵液中,至于该物质是不是抑菌物质、是何种物质,还有待于进一步研究。
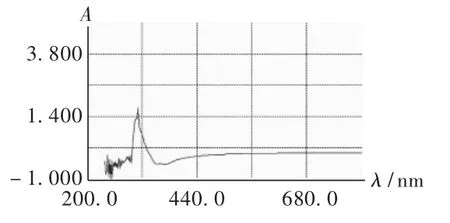
图1 发酵液光吸收特征
2.5 抑菌物质初步鉴定结果
耐温试验表明,抗菌物质对高温有较好的耐受性,在90℃水浴中10 min活性无明显变化。透析试验表明,发酵液经适当浓缩再透析后,透析袋中蛋白质等大分子物质无抑菌活性,说明抑菌物质为能透过透析袋的小分子物质,而不是留在透析袋中的蛋白质等大分子物质。结合耐温试验结果,可以初步判定该菌产生的抗菌物质不是常规的蛋白质类物质。经光吸收试验初处理后的提液基本上没有失去抗菌活性,即抗菌物质在初处理过程中大量保留于提取液中。
2.6 种属鉴定
目标菌菌落形态为煎饼状、不透明、褐色、表面湿润、边缘完整的直径为2 mm的圆形菌落;革兰染色、芽胞染色阳性,鞭毛染色阴性细菌大小为 0.75 μm ×2.4 μm;葡萄糖、乳糖、蔗糖、果糖、木糖、阿拉伯糖反应阳性,甘露醇反应阴性;淀粉水解试验阳性;过氧化氢酶试验阳性;明胶液化试验阳性。根据细菌分类学的标准可知,目标菌属于芽孢杆菌属(Bacillus)[21]。
3 讨论
本试验没采用最优稀释浓度,而是采用最大浓度范围,即只要有单菌落出现就进行分离,而不管该平板上菌落是否出现相连情况。这主要基于在分离过程中内生菌可能繁殖,而这种体外繁殖的菌株间速率比与体内繁殖的菌株间速率比可能不同,即分离过程表现为的优势菌落可能并非实际的优势菌。同时尤其注重相似菌株的筛选,如果两菌大部分形态指标相似,但有一两个形态指标明显不同,即被成对选出,并在后期试验中进行对比研究。
[1]巩聿清,武玉锦.鱼腥草的临床药理研究进展[J].中国药业,2005,14(3):73-74.
[2]彭小伟,陈洪章.南方红豆杉内生真菌产油及降解纤维素的研究[J].菌物学报,2005,24(3):457-461.
[3]张玲琪,郭 波,李海燕,等.长春花内生真菌的分离及发酵产生药用成分的初步研究[J].中草药,2000,31(11):805-807.
[4]金 涛,平文祥,刘 军,等.东北红豆杉内生真菌的分离及产紫杉醇的鉴定[J].中草药,2007,38(5):770-772.
[5]雷丽萍.烟草内生芽胞杆菌降低烟叶亚硝胺类物质含量的研究[J].西南农业学报,2007,20(3):513-520.
[6]杨水英,李振轮,青 玲,等.产几丁质酶烟草内生细菌的筛选及产酶条件研究[J].西北农业学报,2007,16(4):223-227.
[7]罗在柒,乙 引.3种内生真菌诱导子对金钗石斛部分生化指标的影响[J]. 贵州农业科学,2007,35(5):20-23.
[8]余承忠,王志勇,万开军,等.褐斑病胁迫下内生真菌感染对高羊茅叶内酶活性的影响[J].2006,34(12):2 720-2 721.
[9]李学森,张学渊,顾 祥,等.醉马草有毒物质与其内生真菌的关系[J].草食家畜,1998(4):44-46.
[10]严铸云,罗 静,郭晓恒,等.产银杏内酯内生真菌的筛选及培养条件研究[J].天然产物研究与开发,2007,19(4):554-558.
[11]陈华红,唐蜀昆,徐丽华,等.植物内生放线菌的分离方法[J].微生物学通报,2006,33(4):182-185.
[12]Stierle A,Strobel G,Stierle D.Taxol and taxane production by taxomyces andreanae,an endophytic fungus of Pacific yew[J].Science,1993,260(5 105):214-216.
[13]Filip P,Weber RW,Sterner O,et al.Honnonemate,a new cytotoxic and apoptosis-inducing compound from the endophytic fungus Honnonema dematioides.Identification of the producing strain,and isolation and biological properties of hommonemate[J].Z Naturforsch,2003,58(7-8):547-552.
[14]Ratnayake AS,Yoshida WY,Mooberry SL,et al.Nomofungin:a new mierofilament disrupting agent[J].J Org Chem,2001,66(26):8 717-8 721.
[15]江苏新医学院.中药大辞典[M].上海:上海人民出版社,1977:1 439.
[16]胡汝晓,李 珊,谭周进,等.鱼腥草内生微生物的分布特征初探[J].生物技术通报,2008(2):155-157.
[17]赵 斌,何绍江.微生物学实验[M].北京:科学出版社,2002:85-107.
[18]王利娟,杨小生,贺新生,等.银杏叶内生真菌抑菌菌株筛选[J].四川食品与发酵,2007(4):34-36.
[19]张亚中,张 彤,徐莲英,等.HPLC法测定复方四季青片中鱼腥草素含量[J].上海中医药杂志,2005,39(11):56-57.
[20]黄 虹,唐琦文,史德懿,等鱼腥草口服液中鱼腥草素含量测定[J]时珍国医国药,2000,11(2):115-116.
[21]卢振祖.细菌分类学[M].武汉:武汉大学出版社,1994:302-321.

