莲子红皮蛋白微波辅助盐提工艺优化
徐 虹,王馨仪,曹 杨,宋焕禄
莲子红皮蛋白微波辅助盐提工艺优化
徐 虹,王馨仪,曹 杨,宋焕禄
(北京工商大学 食品添加剂与配料北京高校工程研究中心,食品风味化学北京市重点实验室, 北京 100048)
采用微波辅助盐提法制备莲子红皮蛋白,探讨料液比、重复提取次数、NaCl浓度、提取温度、提取时间对蛋白提取率的影响。在单因素试验分析基础上设计正交试验,确定莲子红皮蛋白最佳提取工艺条件为微波功率600W、料液比1:12(g/mL)、提取温度35℃、0.20mol/L NaCl溶液提取20min并重复提取1次,在此条件下,蛋白提取率可达85.52%。以HCl为沉淀剂,在等电点pH4.9时,蛋白沉淀率可达35.96%。采用该方法提取莲子红皮蛋白,蛋白收率为30.75%,蛋白纯度为83.67%。由此可见莲子红皮粉具有可开发应用的良好前景。
莲子红皮;蛋白质;微波盐提
莲子由于其丰富的营养及特殊的滋补和疗效,历来被认为是药食佳品,广受我国及东南亚、日本人民青睐。据测定,每100g干莲子中含蛋白质17.2g、脂肪2.0g、碳水化合物67.2g、粗纤维3.0g、VC 5.0mg、VE 2.71mg、VB10.16mg、VB20.08mg。莲子中的矿物质元素含量也十分丰富,特别是其中的钙、磷、钾。另外,莲子心含有如莲心碱、异莲心碱、非结晶性生物碱、氧化黄心树宁碱等多种生物碱,还含有黄酮类、金丝桃甙、芸香甙等生物活性成分[1-3]。近年来,莲子提取物的抗氧化及抗衰老功能也是研究热点之一[4-9]。我国是产莲大国,莲在我国福建、湖北、湖南、浙江、江苏等地区都有广泛种植,年产销量上百万吨。随着人们生活水平的提高及保健意识的增强,莲子作为保健食品的用量还在逐年增加。
莲子的加工一般要经过干燥、分级、去壳、除皮去心等工序,正规的莲子加工采用手工除皮和机械磨皮两种方式。虽然生产工艺并不复杂,但用这两种方法生产率都较低,且损耗率高。例如采用机械磨皮法,每加工100kg红莲,就会磨去约15kg红皮粉,只能得到约85kg白莲。目前这层红皮粉尚无有效的利用方式,由于味涩甚至不能作为牲畜饲料,只能大量堆于田间地头,对环境造成污染。于是为了降低生产成本,就有非法的莲子加工作坊用有害的“化学方法”加工:用工业氢氧化钠和双氧水泡后,仅经简单的清水冲洗之后,便烘烤上市。而有的不法作坊为使莲子外观更诱人,甚至在加工过程中加入会对人体肝脏造成较大伤害的荧光增白剂。
到目前为止,关于莲子红皮营养价值的研究还未见有文献报道。因此,本实验室对机械磨皮加工中产生的莲子红皮粉进行深入研究,拟从中提取有效成分,以提高莲子的综合利用价值,借此削弱莲子加工行业中的不安全因素。据报道,莲子蛋白的氨基酸含量达到WHO规定标准,将其加入一些特定人群的饮食可以补充赖氨酸的摄入不足,提高蛋白质的生物效用[10-11]。传统的蛋白提取主要采用碱提酸沉法,该法耗费大量碱液,后处理复杂,且所得蛋白质纯度不高[12-14]。近年来,微波作为辅助提取方法已应用于蛋白质的提取[15]。微波提取操作简单,可大大缩短提取时间。本研究以莲子磨皮加工中产生的第二道红皮粉(机械磨皮加工过程中对莲子进行两道打磨,二道粉约占红皮粉总量的三分之一)为原材料,采用微波法协助NaCl溶液从中提取蛋白质,并对其工艺条件进行优化,以期为莲子的深加工探索新的领域并提供必要的技术参数。
1 材料与方法
1.1 材料与试剂
莲子红皮粉由浙江杭州三湘莲业贸易有限公司提供,过80目筛后置于洁净棕色瓶中避光保存。
浓硫酸、硫酸铜、硫酸钾、硼酸、甲基红、溴甲酚绿、盐酸、酒石酸钾钠、氯化钠、乙醇、氢氧化钠(以上均为分析纯)、牛血清蛋白。
1.2 仪器与设备
DHG-9246A电热恒温鼓风干燥箱 上海精宏实验设备有限公司;JA50033电子分析天平 上海精密科学仪器有限公司;XH-100A微波催化合成萃取仪 北京祥鹄科技发展有限公司;TGL-10C高台式离心机 上海安亭科学仪器厂;PHS-3D数显pH计 上海三信仪表厂;Spectrumlab 22pc可见分光光度计 上海棱光科技有限公司;FD-1冷冻干燥机 北京博医康技术公司;超低温冰箱 美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 莲子红皮蛋白的主要提取工艺流程

微波功率参照文献[7]采用600W,此功率条件下提取率较高,4000r/min离心25min。
1.3.2 工艺优化试验设计
通过莲子红皮粉提取蛋白的单因素试验分析,对影响其提取蛋白料液比、提取温度、NaCl浓度、提取时间4个重要因素进行正交试验。以蛋白提取率为指标,采用L9(34)设计进行正交试验获取最优工艺参数,以期获得这些因素对蛋白提取率影响的大致变化趋势,并考察各因素对提取率影响的主次顺序。
1.3.3 莲子红皮粉总蛋白含量和提取物蛋白纯度测定
总蛋白含量采用微量凯氏定氮法,换算系数为6.25。

1.3.4 提取液中蛋白质含量测定和蛋白提取率的计算
提取液中蛋白质含量采用双缩脲法测定,以牛血清蛋白为标准试样。

1.3.5 莲子红皮蛋白等电点的测定和蛋白沉淀率的计算
将莲子红皮蛋白提取液用0.01mol/L盐酸调pH值分别为4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5,使蛋白质沉淀,离心后取上清液进行比色测定,吸光度最小的即为等电点。

1.3.6 莲子红皮蛋白收率的计算

2 结果与分析
2.1 莲子红皮总蛋白含量测定结果
本研究测得莲子红皮二道粉中总蛋白的含量为17.65%。
2.2 影响莲子红皮蛋白提取率的单因素试验
2.2.1 料液比对蛋白质提取率的影响
取不同料液比1:6、1:9、1:12、1:15、1:18(g/mL)分别浸提,在NaCl溶液浓度0.15mol/L、提取温度35℃、微波600W辐射的条件下提取15min,测定莲子红皮蛋白的提取率,结果见图1。
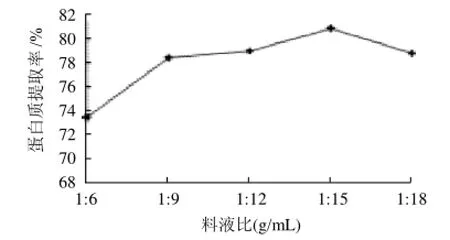
图1 料液比对蛋白质提取率的影响Fig.1 Effect of material/liquid ratio on protein yield
从图1可知,当提取液的料液比在1:6~1:15范围内,莲子蛋白的提取率随提取液用量的增大而升高,当料液比达到1:15时提取率最高。当提取液用量继续增大时,提取率基本趋于稳定,略有下降。这可能是因为有机溶剂萃取是固-液相之间的扩散过程,在一定范围增加盐液用量能增加固-液接触面积,提高溶剂扩散速率和传质速率。考虑到食品工业生产过程中,料液比太大会增加后处理的负担,使产品成本增大,因此选取料液比1:15进行提取比较适宜。
2.2.2 NaCl浓度对提取率的影响
分别配制0.05、0.10、0.15、0.20、0.25mol/L NaCl溶液作为提取液,在料液比1:15、提取温度35℃、微波600W辐射的条件下提取15min,测定莲子红皮蛋白的提取率,结果见图2。

图2 NaCl浓度对蛋白质提取率的影响Fig.2 Effect of NaCl concentration on protein yield
从图2看出,随NaCl浓度的加大,莲子蛋白质的提取率逐渐提高。当NaCl浓度为0.15mol/L时,其提取率为81.45%,继续加大NaCl浓度,其提取率反而急速下降。这可能是由于较低浓度NaCl溶液的盐溶作用可促进蛋白质溶解,而NaCl浓度过高,物料中的许多黏性物质和盐胶团的形成降低了蛋白质溶出,从而影响提取率。所以盐提莲子红皮蛋白最适NaCl浓度为0.15mol/L。
2.2.3 提取时间对提取率的影响
提取时间分别取5、10、15、20、25min,在NaCl浓度0.15mol/L、料液比1:15、提取温度35℃、微波600W辐射的条件下提取15min,测定莲子红皮蛋白的提取率,结果见图3。
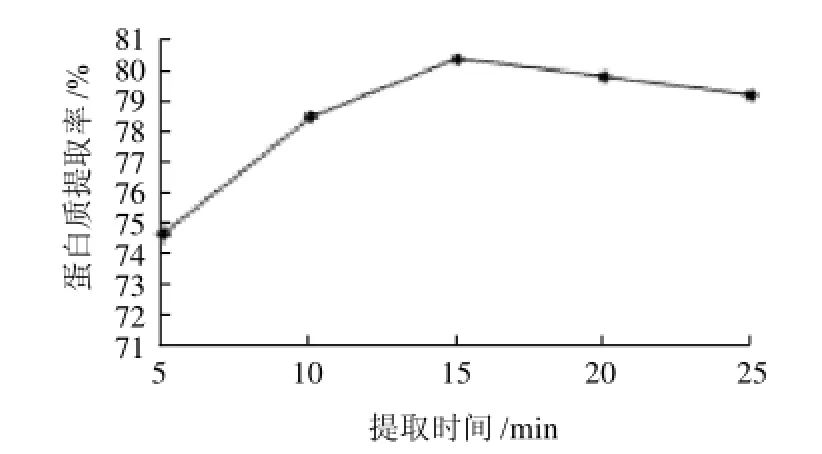
图3 提取时间对蛋白质提取率的影响Fig.3 Effect of extraction time on protein yield
由图3可知,在提取时间5~15min范围内,提取率升高比较明显,15min后蛋白提取率呈缓慢下降趋势。这可能由于莲子粉本身需要一定的溶胀时间。另外,微波萃取法使试样介质内各点受到的作用一致,降低蛋白质与试样基体的结合力,加速蛋白质从固相进入溶剂的过程,大大缩短了提取时间,避免长时间提取出现的不良因素(如蛋白质变性)。因此,确定15min为最佳提取时间。
2.2.4 提取温度对提取率的影响
设定提取温度分别为25、30、35、40、45℃,在NaCl浓度0.15mol/L、料液比1:15、微波600W辐射的条件下提取15min,测定莲子红皮蛋白的提取率,结果见图4。

图4 提取温度对蛋白质提取率的影响Fig.4 Effect of extraction temperature on protein yield
由图4可看出,在25~35℃范围内,提取率随着温度的升高而上升,这可能是因为体系温度升高,分子运动加速,蛋白质的渗透、溶解、扩散速度也加快,因而蛋白质更易于从原料中溶出。当温度到达35℃时,提取率达到最高80.49%。之后随着温度的升高,提取率明显降低,故提取温度取35℃为宜。
2.2.5 重复提取次数对蛋白质提取率的影响
设定重复提取次数分别为0、1、2次,在NaCl浓度0.15mol/L、料液比1:15、提取温度35℃、微波600W辐射的条件下提取15min,测定莲子红皮蛋白的提取率,结果见图5。
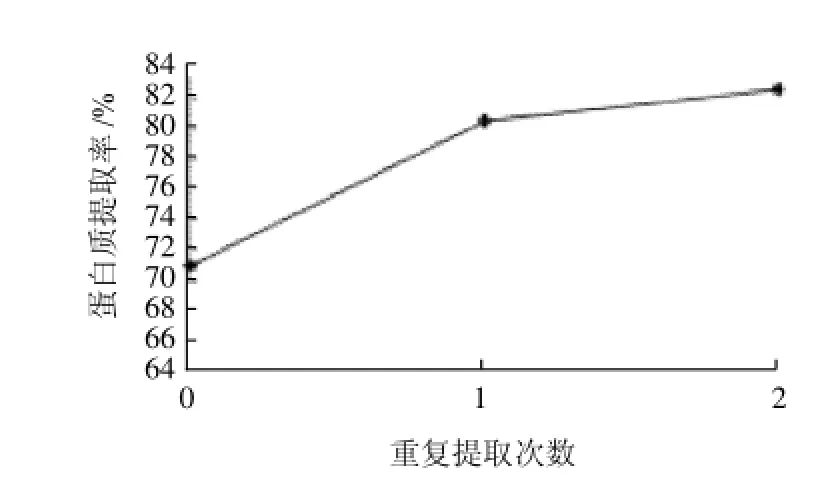
图5 重复提取次数对蛋白质提取率的影响Fig.5 Effect of repeat extraction times on protein yield
从图5可知,当进行1次重复提取的时候,莲子蛋白的提取率比不进行重复提取时的提取率升高约10%,而进行2次重复提取的时候,虽然蛋白质提取率比1次重复提取时稍有升高,但升高的空间仅仅在2%左右。在工业生产中,增加一次提取就会增大运行成本和降低生产效率,综合成本与收益,将重复提取次数定为1次较为适宜。
2.3 微波盐提莲子红皮蛋白工艺的优化
2.3.1 正交优化试验
在单因素试验基础上,对影响莲子红皮蛋白提取率的料液比、NaCl浓度、提取时间和提取温度进行L9(34)正交试验,因素水平见表1。正交试验中,以莲子红皮蛋白提取率作为工艺优化的指标,结果见表2。

表1 微波盐提莲子红皮蛋白工艺L9(34)正交试验因素水平表Table 1 Factors and levels of L9(34) orthogonal array design

图6 莲子红皮蛋白等电点Fig.6 Isoelectric point of proteins extracted from red skin of lotus seed

表2 微波盐提莲子红皮蛋白工艺正交试验方案及结果Table 2 Orthogonal array design matrix and experimental results
从表2可看出:影响莲子蛋白提取率的因素顺序(R值)依次为B(NaCl浓度)>C(提取时间)>A(料液比)>D (提取温度)。其中NaCl浓度对提取率的影响较为显著。并可知微波盐提法从莲子红皮中提取蛋白质的最佳提取条件为A1B3C3D2。
2.3.2 验证实验
由于正交试验所确定的最佳条件并未被包含在正交表的9个试验中,为验证结果,采用正交表中所包含的最优结果A1B3C3D3与正交试验最优水平A1B3C3D2各平行实验3次。验证实验结果显示,以A1B3C3D3工艺条件提取所得莲子红皮蛋白平均提取率为84.54%,以A1B3C3D2工艺条件提取所得莲子红皮蛋白平均提取率为85.52%。所以最终确定A1B3C3D2为最优微波盐提莲子红皮蛋白条件,即料液比1:12(g/mL)、NaCl浓度0.20mol/L、提取时间20min、提取温度35℃。
2.4 莲子红皮蛋白等电点测定结果
加酸至等电点是从提取液中分离蛋白的常用方法,它能确保提取液中蛋白质最大量的沉淀。本研究选用直接加酸调节pH值的方法。将微波盐提的莲子红皮蛋白提取液用0.01mol/L盐酸调pH值分别为4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5,使蛋白质沉淀,离心后取上清液进行比色测定,吸光度最小的即为等电点,结果见图6。
由图6可见,pH4.9时,上清液的吸光度最小,所以此点即为莲子红皮蛋白质等电点,故莲子红皮蛋白酸沉最佳pH值为4.9。在此pH值进行酸沉,莲子红皮蛋白的沉淀率为35.96%。
2.5 莲子红皮蛋白收率和纯度
经测定和计算,采用本工艺从莲子红皮粉中提取蛋白,最终收率为30.75%,蛋白纯度达83.67%。
3 结论与讨论
经测定,莲子红皮二道粉中总蛋白的含量为17.65%,与市售干白莲中总蛋白含量16.6%~24.9%[1-2,4-7]接近。采用微波辅助盐提法提取莲子红皮蛋白,通过单因素试验及正交试验,确定莲子红皮蛋白最佳提取工艺条件为微波功率600W、料液比1:12(g/mL),以0.20mol/L NaCl溶液为提取液在35℃提取20min并重复提取1次,在此条件下,蛋白提取率可达85.52%。通过实验验证,莲子红皮蛋白的等电点为pH4.9,此时蛋白的沉淀量最大,沉淀率为35.96%。用本方法从莲子红皮中提取蛋白,蛋白收率为30.75%,蛋白纯度达83.67%。
本法提取步骤简单可行,可适应工业化生产的需求。相比以白莲为蛋白提取原料[13,15],以莲子红皮粉为原料提取莲子蛋白可大大降低原料成本,又避免了莲子红皮粉目前对环境造成的污染,同时还可削弱莲子加工产业所存在的不安全因素。此法有望成为莲子深加工和综合利用的又一条新途径。
[1]赵文亚. 莲子的营养保健功能及开发利用[J]. 食品工程, 2007(3): 37-39.
[2]李卓瓦. 莲子的营养价值及加工利用[J]. 农产品加工, 2008(6): 42-44.
[3]郑宝东, 郑金贵, 曾绍校. 我国主要莲子品种中三种功效成分的研究[J]. 营养学报, 2004, 26(2): 158-160.
[4]YEN G C, DUH P D, SU H J, et al. Scavenging effects of lotus seed extracts on reactive nitrogen species[J]. Food Chemistry, 2006, 94(4): 596-602.
[5]YEN G C, DUH P D, SU H J. Antioxidant properties of lotus seed and its effect on DNA damage in human lymphocytes[J]. Food Chemistry, 2005, 89(3): 379-385.
[6]RAI S, WAHILE A, MUKHERJEE K, et al. Antioxidant activity of Nelumbo nucifera (scared lotus) seeds[J]. Journal of Ethnopharmacology, 2006, 104(3): 322-327.
[7]LI Jianlin, ZHANG Min, ZHENG Tiesong. The in vitro antioxidant activity of lotus germ oil from supercritical fluid carbon dioxide extraction [J]. Food Chemistry, 2009, 115(3): 939-944.
[8]BHAT R, SRIDHAR K R, KARIM A A. Microbial quality evaluation and effective decontamination of nutraceutically valued lotus seed by electron beams and gamma irradiation[J]. Radiation Physics and Chemistry, 2010, 79(9): 976-981.
[9]苗明三, 徐瑜玲, 方晓艳. 莲子多糖对衰老模型小鼠抗氧化作用的研究[J]. 中国现代应用药学杂志, 2005, 22(1): 11-12.
[10]周欣, 钟世江. 高效液相色谱测定莲子、薏仁米中17种氨基酸[J].贵州工学院学报, 1996, 25(5): 24-29.
[11]唐佩华, 姜在阶, 梅楚红, 等. 莲子蛋白的组成,溶性和品质[J]. 北京师范大学学报: 自然科学版, 1998, 34(4): 352-357.
[12]赖小玲, 徐尔尼. 二次原料中植物蛋白的开发与利用[J]. 南昌大学学报, 1994, 16(2): 72-75.
[13]张羽, 郑铁松, 陈静. 莲子蛋白质提取工艺研究[J]. 食品科学, 2007, 28(9): 144-147.
[14]丁丹华, 彭光华, 夏辉, 等. 油茶籽粕蛋白提取工艺研究[J]. 食品科学, 2010, 31(8): 102-105.
[15]王亚举, 廖晓珊, 曾虹燕, 等. 超声波-微波协同盐提莲子蛋白[J]. 生物加工过程, 2009(2): 35-38.
Optimization of Microwave-assisted Salt-extraction of Proteins from Red Skin of Locus Seed
XU Hong,WANG Xin-yi,CAO Yang,SONG Huan-lu
(Beijing Key Laboratory of Food Flavor Chemistry, Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients, Beijing Technology and Business University, Beijing 100048, China)
Red skin seeds of lotus usually produce about 15% of red skin powder in the resurfacing process. It was determined that protein content in red skin of lotus seed is 17.65%. In the present study, the conditions for the salt-extraction of proteins from red skin of lotus seed assisted by microwave, such as the ratio of solid to liquid (m/V), the concentration of NaCl solution, extraction temperature, extraction time and the repeat times of extraction, were investigated using the extraction rate of protein as an evaluation index. On the basis of single factor and orthogonal array design investigations, the optimal extraction conditions were obtained as follows: under the assistance of 600 W microwave irradiation twice-repeated extraction at 35 ℃ for 20 min each time at a ratio of solid to liquid 1:12 (g/mL). Under the above conditions, the extraction rate of protein was 85.52%. When HCl was used to precipitate protein, the precipitation rate of protein was 35.96% at an isoelectric point of pH 4.9. The yield and purity of lotus proteins extracted by this method were 30.75% and 83.67%, respectively. As a conclusion, lotus seed red skin has good development prospects.
red skin of lotus seed;protein;microwave-assisted salt-extraction
TS210.9
A
1002-6630(2011)04-0087-05
2010-10-06
徐虹(1977—),女,讲师,博士,研究方向为食品营养与安全。E-mail:xuhong@th.btbu.edu.cn

