鲜玉米中可溶性糖含量的测定
修 琳,刘景圣*,蔡 丹,郑明珠
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
鲜玉米中可溶性糖含量的测定
修 琳,刘景圣*,蔡 丹,郑明珠
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
采用高效液相色谱法对鲜玉米中可溶性糖含量进行检测。色谱柱为Agilent Zorbax carbohydrate柱(4.6mm×250mm,5μm),流动相为75%乙腈,柱温25℃,流速1mL/min。相关系数r在0.99839~0.99995(n=5)之间;精密度实验RSD为0.90%~3.80%(n=5);平均回收率在95.28%~101.02%之间。该方法准确、可靠,可以快速准确的对鲜玉米中可溶性糖进行定性定量分析。
鲜玉米;可溶性糖;高效液相色谱法
鲜玉米中富含淀粉、蛋白质以及氨基酸和可溶性糖等,玉米中淀粉组成和可溶性糖含量决定了玉米的品质[1-3]。可溶性糖含量是反映鲜玉米品质的重要指标,国标中对可溶性糖含量的检测采用比色法,耗时长、误差大,且无法检测糖的组分[4-6]。高效液相色谱法可用于检测可溶性糖含量,该方法操作简便,可以快速准确的测定组分中可溶性糖的组成及含量,可用于鲜玉米中可溶性糖的定性及定量分析[7-9]。
本实验利用超声波以及高速离心的方法对鲜玉米进行处理,采用高效液相色谱法检测鲜玉米中可溶性糖的组成及含量,为检测鲜玉米中可溶性糖组成及含量提供快速、准确而简便的方法。
1 材料与方法
1.1 材料与试剂
垦糯1号玉米 天景公司。
蔗糖、葡萄糖和果糖标准品 美国Sigma公司;乙腈(色谱纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
1200型高效液相色谱仪(配备G1311A型四元梯度泵、G1328型手动进样器、G1311A13162型示差折光检测器、G1316A型柱温箱、Zorbax carbohydrate柱(4.6mm×250mm,5μm)、化学工作站) 美国Agilent公司;Z 36HK型高速离心机 德国Hermle公司;JK 3200B型超声波清洗器 合肥金尼克机械制造有限公司;2mL一次性注射器 金坛市康兴医疗器械有限公司;0.2μm针式过滤头 天津市津腾实验设备有限公司。
1.3 方法
1.3.1 色谱条件
色谱柱:Agilent Zorbax carbohydrate柱(4.6mm×250mm,5μm),流动相为乙腈-水(75:25,V/V);柱温:25℃;检测池温度:35℃;流速1mL/min,进样量20μL。
1.3.2 糖标准溶液配制
用超纯水配制蔗糖、果糖和葡萄糖的单标溶液,配制质量浓度均为30mg/mL的储备液;准确吸取储备液混合、稀释,配制成蔗糖、果糖和葡萄糖质量浓度均为2、4、6、8、10mg/mL的混合标准溶液,备用[10-11]。
1.3.3 样品处理[12]
在乳熟期选取15穗生长状况相近,穗型粒型一致,籽粒饱满的玉米,每穗玉米竖向取粒1排,称质量,加入等质量超纯水,混匀打浆;玉米浆经超声波提取20min后过滤,取滤液经8000r/min高速离心10min后,取5mL上清液于10mL容量瓶中,用乙腈定容至10mL,经0.22μm滤膜过滤,待进样分析。
1.3.4 标准曲线的绘制
分别取各质量浓度混合标准溶液进行分析,进样量20μL,以标准品质量浓度为横坐标,标准品峰面积为纵坐标,绘制峰面积-质量浓度工作曲线。
1.3.5 样品检测
将处理后的样品溶液进行液相色谱分析,进样量为20μL,采用外标法定量,检测鲜玉米中蔗糖、果糖和葡萄糖含量。
2 结果与分析
2.1 样品前处理方法的选择
玉米中可溶性糖主要为蔗糖、果糖和葡萄糖,且均易溶于水,故可采取超声波水提的方法来提取玉米中的单糖。鲜玉米经搅拌后含有果皮等成分,可经离心后除去沉淀。乙腈是常用的蛋白质沉淀剂,因此,在上清液加入等体积乙腈,既可以除去蛋白质,又可以得到良好的峰形。在上清液中加入乙腈后,静止20min,经0.22μm滤膜过滤,上机分析。
2.2 流动相的选择

图1 果糖、葡萄糖和蔗糖混标色谱图Fig.1 HPLC chromatogram of mixed fructose, sucrose and glucose standards
本实验流动相采用乙腈-水比例分别为85:15、80:20、75:25、70:30(V/V),不同比例的流动相测定糖混合标准品和鲜玉米样品中各种糖的含量和分离情况[13-15]。实验证明随乙腈体积分数的增加,鲜玉米样品中糖的分离程度提高,流动相中乙腈和水的比例为85:15时分离效果最佳,但分离时间较长。当流动相中乙腈和水的比例为75:25时分离度较好,分离度R>2,且分离时间短,14min就可以分析一个样品,综合考虑各个因素,本实验采用流动相为乙腈和水的比例为75:25,标准品色谱图见图1,样品色谱图见图2。

图2 乳熟期玉米样品色谱图Fig.2 HPLC chromatogram of fresh corn sample
2.3 标准曲线、检出限和线性范围
分别取各质量浓度混合标准品溶液(2、4、6、8、10mg/mL)进行液相分析,进样量20μL。以标准品质量浓度为横坐标(x),标准品峰面积为纵坐标(y),绘制峰面积-质量浓度工作曲线。回归方程见表1。从表1可知,糖的线性相关系数r在0.99839~0.99995之间,可作为定量的依据。当信噪比(RSN)为3时,检测3种糖的最小检出限,结果见表1。

表1 回归方程、相关系数及检出限Table 1 Regression equations, correlation coefficients and detection limits
2.4 精密度实验
取同一玉米样品,按照1.3.3节进行处理,重复进样5次,记录峰面积,结果见表2,RSD 0.90%~3.80%(n=5),说明该方法的精密度很高。
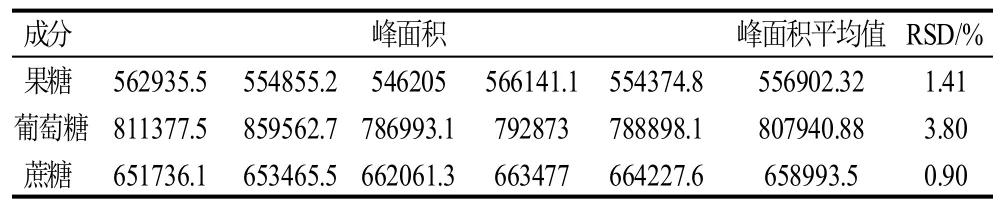
表2 方法的精密度实验(n=5)Table 2 Results of precision experiments (n=5)
2.5 加标回收率实验
精确称取鲜玉米样品2份,每份100g,其中一份加入果糖、葡萄糖和蔗糖标准品,添加量见表3,另一份不加,按照样品处理方法1.3.3节进行处理,每个梯度做3个平行,计算回收率,结果见表3。根据实验计算的平均回收率分别为101.02%、98.93%、95.28%,表明该方法准确度高。
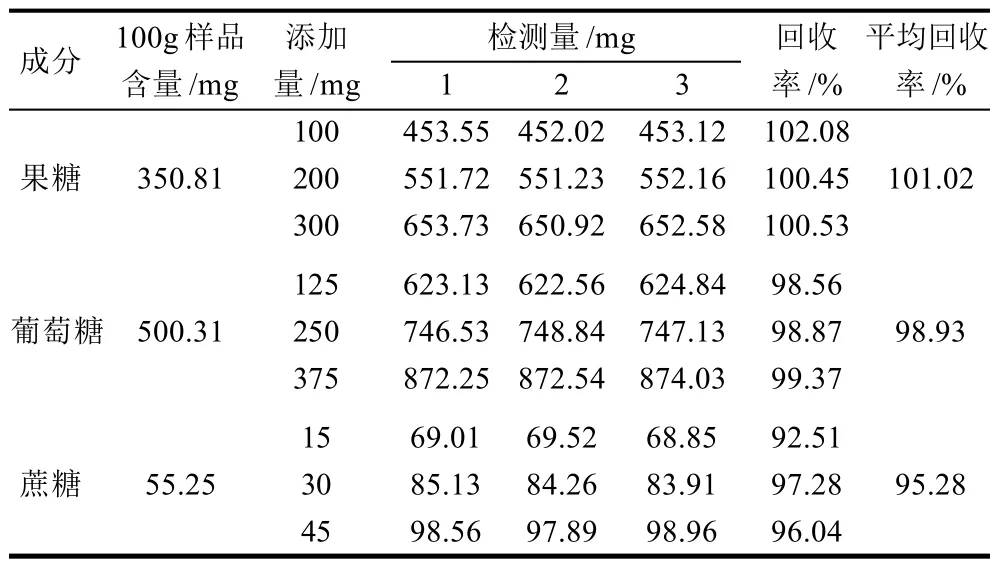
表3 方法的加标回收率实验(n=3)Table 3 Results of spike recovery experiments (n=3)
3 结 论
本研究建立高效液相色谱法检测鲜玉米中可溶性糖含量的方法,结果表明,该方法样品前处理简单,操作简便,结果准确、可靠,可以快速准确的对鲜玉米中可溶性糖含量进行定性定量分析。
[1] 刘萍, 陆卫平, 陆大雷. 鲜食糯玉米品质差异及品质评价理化指标的筛选[J]. 扬州大学学报, 2009, 30(3): 16-21.
[2] 宋雪娇, 马兴林, 关义新, 等. 影响糯玉米鲜食品质因素的研究[J].玉米科学, 2005, 13(1): 115-118.
[3] 翟广谦, 陈永欣, 田福海, 等. 甜、糯玉米鲜食期品质变化及保鲜技术研究[J]. 山西农业科学, 1997, 25(1): 24-27.
[4] 李霞辉, 赵铁男. GB/T 6194—86 水果、蔬菜可溶性糖测定法[S].
[5] 田艳玲, 王浩, 张曼玲, 等. 高效液相色谱法与化学法测定蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的比较与研究[J]. 食品研究与开发, 2008, 29(8): 126-129.
[6] 董爱军, 张迎春, 杨鑫, 等. 高效液相色谱法测定甜菜糖蜜中的葡萄糖、蔗糖和棉籽糖[J].食品工业科技, 2008, 29(12): 245-247.
[7] 刘玉峰, 李黎, 李东, 等. 高效液相色谱法测定食品中的单糖、双糖[J]. 食品科学, 2007, 28(3): 293-296.
[8] 汤丽芬, 吴珏珩, 陈红英, 等. 高效液相色谱法测定食品中五种糖的含量[J]. 华南预防医学, 2002, 28(3): 40-41.
[9] AGBLEVOR F A, HAMES B R, SCHELL D, et al. Analysis of biomass sugars using a novel HPLC method[J]. Applied Biochemistry and Biotechnology, 2009, 136(3): 309-326.
[10] 张龙翔, 张庭芳, 李令媛. 生化实验方法技术[M]. 北京: 高等教育出版社, 1981.
[11] YASHIN Ya I, YASHIN A Ya. Analysis of food products and beverages using high-performance liquid chromatography and ion chromatography with electrochemical detectors[J]. Journal of Analytical Chemistry, 2004,59(12): 1121-1127.
[12] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社,2001.
[13] 施耐德. 实用高效液相色谱法的建立 [M]. 2版. 北京: 科学出版社,1998.
[14] de CORTES SANCHEZ-MATA M, CMARA-HURTADO M, DEZMARQUS C. Identification and quantification of soluble sugars in green beans by HPLC[J]. European Food Research and Technology,2002, 214(3): 250-258.
Determination of Soluble Sugar Content in Fresh Corn
XIU Lin,LIU Jing-sheng*,CAI Dan,ZHENG Ming-zhu
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
A high performance liquid chromatography (HPLC) method was used to determine the contents three soluble sugars(fructose, sucrose and glucose) in fresh corn. The chromatographic column used was an Agilent Zorbax carbohydrate (4.6 mm ×250 mm, 5 μm) column held at 25 ℃, and the mobile phase was a mixture of acetonitrile and water (V/V, 75:25) at a flow rate of 1 mL/min. The established cabliration curves of fructose, sucrose and glucose displayed correlation coefficients ranging from 0.99839 to 0.99995 (n = 5). In precision experiments, relative standard deviations (RSDs) between 0.90% and 3.8% were obtained(n = 5). The average spike recoveries of the method ranged from 95.28% to 101.02%. This method can be used for accurate, reasonable and rapid analysis of soluble sugar in fresh corn.
fresh corn;soluble sugar;high performance liquid chromatography (HPLC)
TS210.7
A
1002-6630(2011)04-0174-03
2010-09-11
国家“863”计划项目(2008AA100802)
修琳(1979—),女,博士研究生,研究方向为食品资源深加工与综合利用。E-mail:jluxiulin1979@sina.com
*通信作者:刘景圣(1964—),男,教授,博士,研究方向为乳品科学与功能性食品开发。E-mail:liujs1007@vip.sina.com.cn

