高效液相色谱-串联质谱测定猪肝中阿维菌素、伊维菌素残留
郑卫东,胡江涛,阴文娅*,盛 毅,武志雄
(1.四川省产品质量监督检验检测院,四川 成都 610031;2.四川出入境检验检疫局,四川 成都 610041;3.四川大学华西公共卫生学院营养与食品卫生学教研室,四川 成都 610041)
高效液相色谱-串联质谱测定猪肝中阿维菌素、伊维菌素残留
郑卫东1,胡江涛2,阴文娅3,*,盛 毅2,武志雄3
(1.四川省产品质量监督检验检测院,四川 成都 610031;2.四川出入境检验检疫局,四川 成都 610041;3.四川大学华西公共卫生学院营养与食品卫生学教研室,四川 成都 610041)
目的:建立高效液相色谱-四极杆串联质谱仪(LC-MS/MS)同时测定猪肝脏中阿维菌素(AVM)和伊维菌素(IVM)的残留量。方法:猪肝样品均质后用乙腈提取,碱性氧化铝固相萃取柱(SPE)净化,采用串联质谱电喷雾电离ESI(+),多反应监测模式(MRM)检测,以保留时间和子离子比定性,外标法定量。结果:方法检出限(LOD)均为2.0μg/kg,定量限(LOQ)为5.0μg/L,两种药物的线性范围均为5~100μg/L,相关系数均为0.9999。添加水平在2~20μg/kg范围内,阿维菌素和伊维菌素的平均回收率分别为77.0%~83.3%和76.9%~79.8%之间,相对标准偏差(RSD)分别小于12.1%和13.0%。结论:方法操作简单,灵敏准确,可满足当前国内外该产品中此类药物的检测要求。
猪肝;阿维菌素;伊维菌素;高效液相色谱-串联质谱
阿维菌素(a v e r m e c t i n,A V M)和伊维菌素(ivermectin,IVM)[1-2]是由阿维链霉菌产生的一组广谱、高效、安全的大环内酯类抗寄生虫药,对体内外寄生虫特别是线虫和节肢动物均有良好的驱杀作用,国内外在猪、牛、羊等家畜中使用广泛。AVMs主要分布于动物肝脏和脂肪组织中,且在动物体内残留时间长,动物实验也证实阿维菌素具有生殖毒性,长期暴露可能对人体具有严重健康损害危险,且对水生环境有剧毒性。各国都制定了阿维菌素最高残留限量(MRLs)[3-5]。
据文献报道,目前阿维菌素的检测方法[6-13]主要有高效液相色谱法(HPLC)、酶联免疫法(ELISA)、液质联用法(LC-MS)等。已有方法主要是对药物制剂含量、植物、牛肉及尿液中阿维菌素残留量的测定。最新颁布的行业标准阿维菌素类药物残留的液相色谱-串联质谱分析方法也仅适用牛肉及牛肝[14],还没有针对猪肝的液相色谱-串联质谱检测方法。猪肝基质复杂,常规的检测方法易出现假阳性、色谱峰易受杂质干扰,因此对前处理要求也较高。本实验采用超高效液相色谱-电喷雾四极杆串联质谱同时测定猪肝中的阿维菌素和伊维菌素,并对提取溶剂、净化方法以及测定技术进行研究,方法操作简便,定性定量准确,灵敏度等各项技术指标满足残留检测的要求,以期为阿维菌素和伊维菌素的检测研究提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
新鲜猪肝组织,搅碎混匀。
标准品阿维菌素(纯度≥96%)、伊维菌素(纯度≥98%) 德国Augsburg公司;乙腈、正己烷、乙酸、乙酸铵(均为色谱纯) 美国Tedia公司;无水硫酸钠(分析纯,650℃灼烧4h,贮藏于干燥器中备用);氯化钠(分析纯,400℃灼烧2h,贮藏于干燥器中备用)。
1.2 仪器与设备
ABI4000高效液相色谱-三重四极质谱联用仪(配有电喷雾离子源) 美国ABI公司;IKA-WERKE型高速组织匀浆机 德国IKA公司;B8500S-DTH超声波清洗器上海必能信超声有限公司;LG10-2.4A离心机 北京医用离心机厂;Anpelclea碱性氧化铝SPE柱(6mL,1000mg,使用前用10mL乙腈活化) 上海安谱科学仪器有限公司;水浴氮吹仪。
1.3 方法
1.3.1 溶液的配制
乙腈饱和的正已烷:取50mL乙腈加入到1000mL正已烷中,充分混匀,分层后取正已烷层备用。
阿维菌素和伊维菌素标准储备溶液:准确称取适量标准品(精确至0.1mg),用乙腈配制成质量浓度为1.0 mg/mL的标准储备液,置-18℃冰箱中避光保存。
空白样品提取液:准确称取20g空白猪肝脏组织,加入100mL乙腈,样品的前处理提取后合并提取液用足量无水硫酸钠脱水,再用20mL乙腈饱和正已烷除脂,备用。
1.3.2 色谱与质谱条件
Pickering laboratories C8柱(150mm×4.6mm,5μ m);柱温:25℃;流动相:乙腈:(0.1%乙酸-5mmol/L乙酸铵)=90:10(V/V);等度洗脱;流速:0.6mL/min;进样量:2 0μL。
电喷雾离子源(ESI),正离子扫描,多反应监测(MRM)。高纯氮气为载气、碰撞气和气帘气,电喷雾电压(IS)+5500V,去簇电压(DP)12V,雾化气压力(GAS1)30psi,气帘气压力(CUR)20psi,辅助气压力(GAS2)40psi,离子源温度(TEM)400℃,驻留时间300ms。
1.3.3 样品的前处理
提取:称取5.0g匀浆后的新鲜猪肝脏组织至50mL离心管中,加5g无水硫酸钠、1g氯化钠和20mL乙腈,高速匀浆2min,超声30min,4000r/min离心10min。取上清液至容量瓶,残渣分别用15、10mL乙腈重复提取离心两次,合并上清液,用乙腈定容至50mL,待净化。
净化:取提取液25mL过碱性氧化铝小柱(已活化),之后用4mL乙腈淋洗,收集全部流出液,控制流出液的速度低于1.0mL/min。再经无水硫酸钠脱水后,在50℃水浴下用氮气吹至近干,用1.0 mL流动相溶解残渣,过有机微孔滤膜(0.22μm)后,供LC-MS/MS测定。
2 结果与分析
2.1 质谱条件的优化
本实验选用广泛使用的ESI作为离子源,[M+NH4]+离子为两待测物的母离子,在流动相中加乙酸和乙酸铵以增强待测物的离子化。对AVM和IVM混合标准溶液(1mg/L)在正离子模式下对母离子进行全扫描,找出AVM和IVM的[M+NH4]+峰,以该分子离子峰对离子源参数(IS、GAS1、GAS2、CUR、TEM等)进行优化,使仪器灵敏度达到最高。再对子离子进行二级质谱全扫描,选取二级质谱中没有干扰、信号相对较强的2个特征碎片离子,与其母离子组成两对离子对,对该药物进行定性和定量分析。AVM和IVM的母离子/子离子及碰撞能量见表1,提取离子色谱图见图1。
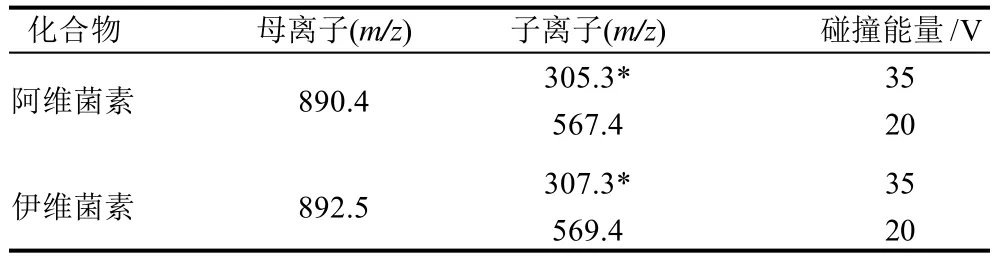
表1 AVM和IVM的母离子、子离子及碰撞能量Table 1 Parent and daughter ions and collision energy of avermectin and ivermectin

图1 AVM和IVM的提取离子色谱图(添加水平10μg/L)Fig.1 Ion chromatograms of avermectin and ivermectin standards
2.2 色谱条件的优化
2.2.1 色谱柱的选择
阿维菌素类药物是一类相对分子质量较高的弱极性化合物,选用反相高效液相色谱进行分离较合适。本实验对C8和C18两种色谱柱进行比较,结果发现:阿维菌素和伊维菌素在C18柱上出峰太快,不能完全和杂质分开,且响应强度较低;而其在C8柱上则能完全与杂质分离,且峰型更尖锐,响应强度也较C18上的大得多。进一步比较3个品牌的C8色谱柱,发现不同厂家的C8柱间存在着差别,最终选定产生峰形和响应强度最好的Carbamate Analysis C8(150mm×4.6mm,5μm)为实验所用色谱柱。
2.2.2 流速和柱温的选择
本实验比较0.2、0.4、0.5、0.6、0.7mL/min流速时,待测物的峰型和响应强度等指标,结果显示流速加大,待测物的响应有一定增加,增大质谱雾化气流速后,质谱的响应强度趋于稳定,最终确定0.6mL/min为理想流速。实验表明柱温对两种化合物的分离基本没有显影响,考虑室温,选定柱温为2 5℃。
2.2.3 流动相的选择

图2 空白猪肝脏组织的色谱图Fig.2 Chromatogram of blank pork liver tissue
本实验选用ESI正离子模式,[M+NH4]+离子为母离子,在流动相中加入5mmol/L乙酸铵可促进母离子的形成,同时加入0.1%乙酸来增强待测物的离子化。比较甲醇和乙腈,结果显示甲醇作流动相时,两待测物的峰形延展较宽,响应强度较低,有时会出现同物质的双峰现象;乙腈作流动相时,两物质出峰的峰型和响应强度均比甲醇好,特别是伊维菌素的响应有成倍的增强,最终选择乙腈:缓冲液(0.1%乙酸-5mmol/L乙酸铵)=90:10(V/V)为流动相。在所选的最佳仪器条件下,空白猪肝脏组织及其加混标10μg/kg阿维菌素和伊维菌素的色谱图分别见图2、3。

图3 空白猪肝脏组织添加10μg/kg标准品的色谱图Fig. 3 Chromatogram of blank swine liver tissue spiked at 10μg/kg
2.3 样品处理条件的选择及优化
2.3.1 提取条件的选择
参考国内外文献资料,大多选用乙腈作为样品提取溶剂。乙腈与水任一比混溶,很容易渗透到组织内部,提取效率高,且乙腈本身对样品中的糖、脂肪和蛋白质的溶解性较小,对蛋白又有沉淀作用,所以实验选用乙腈作为提取溶剂。
2.3.2 净化方法的选择
常用的净化方法有乙腈饱和的正己烷液-液萃取法和C18柱、中性氧化铝柱、碱性氧化铝柱固相萃取法。本实验比较几种净化方法的去脂效果,结果发现:乙腈饱和的正己烷、C18及中性氧化铝小柱的去脂效果均不甚理想,且回收率在60%以下,而碱性氧化铝小柱不仅去脂效果好,而且回收率也高,可达80%,完全能满足方法要求,所以本实验确定用碱性氧化铝柱净化。
同时进行碱性氧化铝柱洗脱效率的实验,以验证小柱对阿维菌素和伊维菌素的吸留作用。实验表明:样品提取液过柱后,固相萃取柱再用2mL乙腈即可将残留的阿维菌素和伊维菌素完全洗脱,过量的洗脱液可能将小柱吸附的杂质洗脱,综合考虑采用4mL乙腈来洗脱柱内吸留待测物。
2.4 方法线性方程和检出限
实验比较乙腈和空白样品提取液作为标准的稀释液配制标准系列,发现猪肝脏样中存在着基质减弱效应,使得阿维菌素和伊维菌素的仪器响应不理想,回收率偏低;本实验用空白猪肝样品提取液配制标准,以补偿基质效应[15]吸取标准贮备液,用阴性猪肝脏组织的空白提取液稀释成0.005、0.010、0.020、0.050、0.100mg/L标准溶液,按1.3.2节的仪器条件进行测定。用选定的定量离子峰面积(Y)对质量浓度(X)绘制标准曲线,得线性方程及相关系数见表2。

表2 阿维菌素和伊维菌素的线性方程、相关系数Table 2 Linear equations and correlation coefficients for the determination of avermectin and ivermectin
以10倍信噪比所对应的待测物质量浓度为最低定量质量浓度,根据样品的浓缩倍数,确定本方法定量限为5.0μg/L,样品定量限为2.0μg/kg,线性范围是5~100μg/L,在线性范围以外时,可适当增大样品最终定容体积或减小样品净化体积。
2.5 方法回收率和精密度
2.5.1 方法回收率
选取不含阿维菌素和伊维菌素本底的猪肝脏组织样品,进行不同添加水平的阿维菌素和伊维菌素加标回收实验,添加水平为2、10、20μg/kg三个添加水平,每个质量浓度做10个平行样,阿维菌素样品添加平均回收率在77.0%~83.3%之间,相对标准偏差在8.6%~12.1%之间;伊维菌素样品添加平均回收率在76.9%~79.8%之间,相对标准偏差在9.9%~13.0%之间。回收率满足要求。回收率结果见表3。
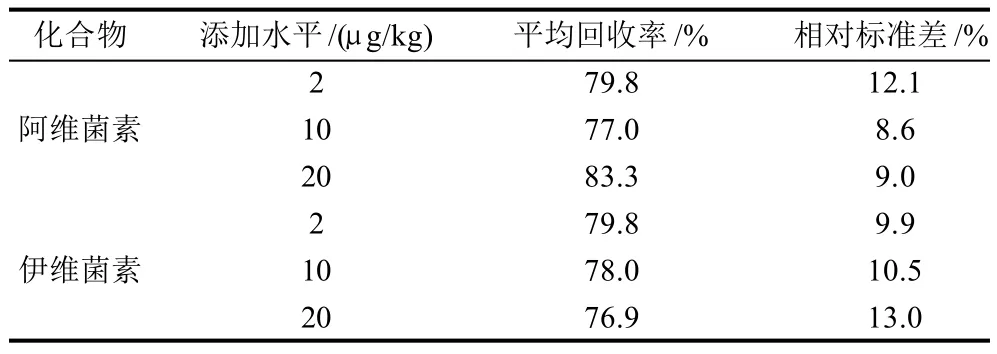
表3 阿维菌素和伊维菌素加标回收率实验(n=10)Table 3 Spike recovery rates for avermectin and ivermectin
2.5.2 方法精密度

表4 阿维菌素精密度实验结果 (n=10)Table 4 Precision of this method in avermectin determinationμg/kg

表5 伊维菌素精密度实验结果(n=10)Table 5 Precision of this method in ivermectin determinationμg/kg
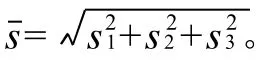
3 结 论
本实验建立猪肝脏组织中阿维菌素类药物残留的液相色谱-串联质谱法,其前处理过程简单,灵敏度高,准确度、精密度和各项技术指标均满足国内外残留检测的相关要求,可用于猪肝脏组织中阿维菌素类药物残留的检测。
[1] SAMSONOVA J V, BAXTER G A, CROOKS S R, et al. Determination of ivermectin in bovine liver by optical immunobiosensor[J].Biosensors and Bioelectronics, 2002, 17(6/7): 523-529.
[2] DANAHERK M, HOWELLS L C, CROOKS S R, et al. Review of methodology for the determination of macrocyclic lactone residues in biological matrices[J]. Journal of Chromatography B, 2006, 844(2):175-203.
[3] 中华人民共和国农业部公告第235号. 动物性食品中兽药最高残留限量[S]. 2002.
[4] Official Journal of the European Union. EU Pesticides database[EB/OL].(2010-11-10). http://ec.europa.eu/sanco_pesticides/public/index.cfm.
[5] FAO/WHO Food standards codex alimentarius. Pesticide residues in food[EB/OL]. (2010-07). http://www.codexalimentarius.net/mrls/pestdes/jsp/pest_q-e.jsp.
[6] DANAHERK M, OKEFFE M, GLENNON J D. Validation and robustness testing of a HPLC method for the determination of avermectins and moxidectin in animal liver samples using an alumina column clean-up[J]. Analyst, 2000, 125(10): 1741-1744.
[7] TURNIPSEED S B, ROYBAL J E, RUPP H S, et al. Confirmation of avermectin residues in food matrices with negative-ion atmospheric pressure chemical ionization liquid chromatography/mass spectrometry[J].Rapid Communications In Mass Spectrometry, 1999, 13(6): 493-499.
[8] 张启迪, 邹明, 刘文华, 等. 阿维菌素残留检测中不同SPE柱净化效果的比较研究[J]. 中国动物检疫, 2007, 24(12): 29-30.
[9] WANG Jian. Analysis of macrolide antibiotics, using liquid chromatography-mass spectrometry, in food, biological and environmental matrices[J]. Mass Spectrom Rev, 2009, 28(1): 50-92.
[10] RUDIK I, CUMMINGS M R, POPPENGA R H. Isolation and multiresidue detection of macrolide endectocides present in animal matrices[J]. J Vet Diagn Invest, 2002,14(4): 295-302.
[11] 赵东豪, 贺利民, 聂建荣, 等. 猪肉组织中阿维菌素类药物残留的高效液相色谱-串联质谱法测定[J]. 分析测试学报, 2008, 27(8): 862-865.
[12] HEERNANDO M D, SUAREZ-BARCENA J M, BUENO M J, et al.Fast separation liquid chromatography-tandem mass spectrometry for the confirmation and quantitative analysis of avermectin residues in food[J]. Journal of Chromatography A, 2007, 1155(1): 62-73.
[13] HOU Xiaolin, LI Xiaowei, DING Shuangyang, et al. Simultaneous analysis of avermectins in bovine tissues by LC-MS-MS with immunoaffnity chromatography[J]. Chromatographia, 2006, 63(11/12): 543-550.
[14] GB/T 21320—2007动物源食品中阿维菌素类药物残留量的测定: 液相色谱串联质谱法[S].
[15] HERNANDEZ F, SANCHO J V, POZO J. Critical review of the application of liquid chromatography/mass spectrometry to the determination of pesticide residues in biological samples[J]. Analytical and Bioanalytical Chemistry, 2005, 382(4): 934-946.
Determination of Avermectin and Ivermectin Residues in Pork Liver by High Performance Liquid Chromatography-Mass Spectrometry
ZHENG Wei-dong1,HU Jiang-tao2,YIN Wen-ya3,*,SHENG Yi2,WU Zhi-xiong3
(1. Sichuan Institute of Product Quality Supervision and Inspection, Chengdu 610031, China;
2. Sichuan Entry-exit Inspection and Quarantine Bureau, Chengdu 610041, China;
3. Department of Nutrition and Food Hygiene, West China School of Public Health, Sichuan University, Chengdu 610041, China)
Objective: To establish a method for the simultaneous determination of avermectin and ivermectin residues in pork liver using high performance liquid chromatography-electrospray ionization tandem mass spectrometry (HPLC-ESI-MS/MS).Methods: Avermectin and ivermectin residues were extracted with acetonitrile, cleaned up on a solid phase extraction (SPE)column containing alkaline aluminum oxide, separated on a C8 column, detected by tandem mass spectrometry with electrospray ionization and multiple reaction monitoring interface and quantitatively determined by high performance liquid chromatography in an external standard manner. Results: The limits of detection (LOD) for avermectin and ivermectin were 2μg/kg and limits of quantitation were 5μg/L. Both the linear ranges of avermectin and ivermectin were 5-100μg/L with correlation coefficients of both 0.9999. The recovery rate range of this method was 77.0%-83.3% for avermectin and 76.9%-79.8% for ivermectin with relative standard deviations (RSD) of 8.6%-12.1% and 9.9%-13.0% at spike levels of 2, 10μg/kg and 20μg/kg,respectively. Conclusion: This method is simple, sensitive and accurate, which can meet the domestic and international requirements for the detection of both veterinary drugs.
pork liver;avermectin;ivermectin;high performance liquid chromatography-tandem mass spectrometry
R155.5
A
1002-6630(2011)04-0185-04
2010-03-11
四川省科技厅应用基础研究项目(04JY029-033)
郑卫东(1964—),男,教授级高级工程师,硕士,研究方向为食品分析。E-mail:axlzwd2004@126.com
*通信作者:阴文娅(1972—),女,副教授,博士,研究方向为营养与食品卫生学。E-mail:yinwenya@126.com

