宫颈微腺体增生7例临床病理分析
车 超,李占林,燕东阳,车拴龙
(铁煤集团总医院 病理科, 辽宁 调兵山 112700)
宫颈微腺体增生(Micro gland hyperplasia,MGH)在妇科活检病例中较少见。它是一种良性病变,病理组织形态学易与宫颈内膜腺癌,尤其是易与宫颈微偏离腺癌相混淆。当MGH伴不典型增生时,更要结合病理组织形态学特征和免疫组化标记进行诊断,避免误诊。作者收集7例MGH,通过观察病变的病理组织形态学改变和免疫组化结果,复习文献资料分析本病的病理组织学形态特点,并对其诊断标准及鉴别诊断进行探讨。
1 材料和方法
1.1 材 料
收集铁煤集团总医院病理科1996~2010年妇科活检病理切片,病理诊断MGH 7例。7例MGH临床资料见表1。
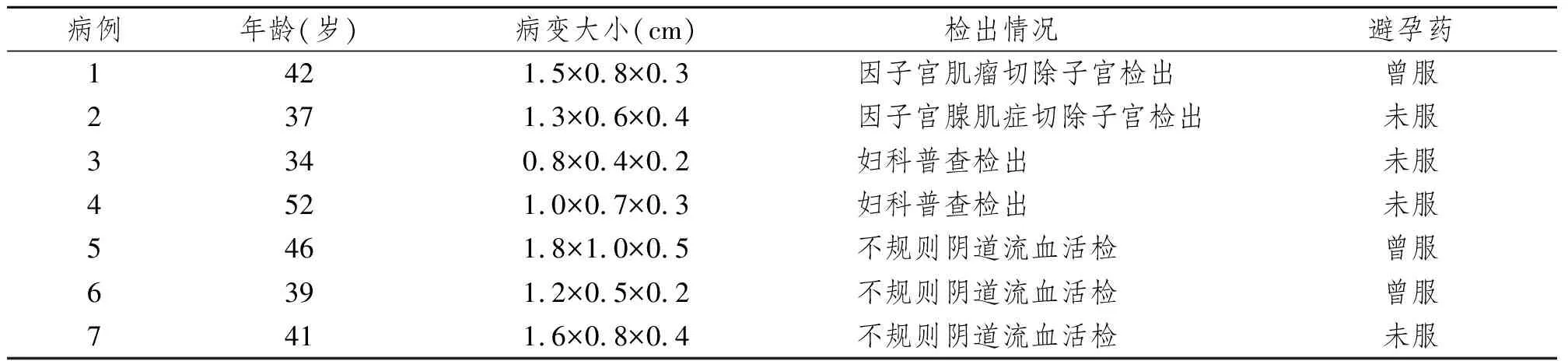
表1 7例MGH临床特点
1.2 方 法
标本均经4%中性甲醛固定,常规脱水,石蜡包埋切片,HE染色及免疫组化染色。免疫组化采用Envision二步法,所用CEA、P53、Ki-67、P16均为多克隆抗体,购自北京中彬金桥生物技术有限公司。
2 结 果
2.1 病理检查
大体观察:手术切除标本病变位于子宫颈管,呈息肉样或微小隆起改变。送检活检标本为白色小块碎组织。镜下观察:病变主要分布于子宫颈的浅表层,由较多腺体密集组成(图1),腺体大小形态不一致,排列紧密(图2),常常背靠背(图3),部分腺体分支或扩张呈囊状,部分腺腔内可见分泌物,本组3例局部腺体出现鳞状化生。腺体衬覆单层立方或低柱状上皮,细胞质丰富嗜酸性染色,部分胞质透明,个别胞质内可见位于细胞核底部的小空泡。细胞核形态较一致,呈圆形或卵圆形,染色质均细,不见或罕见核分裂象。腺体间有少量纤维组织,伴有多少不等以中性白细胞为主的急慢性炎细胞浸润。本组中1例不规则阴道流血患者(例5)病变组织中部分区域具有上述组织结构,部分区域可见腺上皮增生呈实性巢团状,细胞核呈轻度不典型性,偶见核分裂象。本例病理诊断为MGH伴不典型增生(图4)。
2.2 免疫组化
7例MGH免疫组化检测CEA、P53、Ki-67、P16均无表达。
3 讨 论
3.1 发病机制
宫颈微腺体增生(MGH)是主要发生在育龄期妇女的一种肿瘤样增生的良性病变,它也可发生在绝经后妇女。据文献报道,在宫颈活检及手术标本中MGH的发生率可高达27%[1]。有学者认为,MGH的发生与口服避孕药关系密切[2],本组口服避孕药者占42.3%。部分学者认为,MGH是宫颈储备细胞在孕激素的作用下活跃增生并向腺上皮分化的结果[3]。部分学者认为,本病与口服避孕药或其他激素紊乱之间的相关性仍有疑问[4]。本病变中常有多少不等的炎细胞浸润,所以炎症刺激也可能是本病发生的一个因素,但目前本病发病机制尚未完全明确。
3.2 MGH组织学诊断标准
作者通过7例MGH的病理组织形态学改变,并复习文献资料,对MGH的病理组织学诊断标准总结如下:(1)增生腺体分布于子宫颈浅层,腺体大小形态不一致,排列紧密,常常背靠背。(2)腺腔内常含粘液,可见分支腺体。(3)腺上皮多扁平或低立方状,胞质可出现核下粘液空泡,常常伴有鳞状化生。(4)细胞核小,规则,罕见核分裂象。(5)间质少,多少不等的急慢性炎细胞浸润。非典型MGH诊断标准:(1)腺上皮聚集成巢团或条索状。(2)细胞核轻度异型,不见或偶见核分裂象。(3)可同时伴有典型MGH组织结构。(4)间质可粘液样变。
3.3 鉴别诊断
(1)宫颈微偏离腺癌:本病常累及宫颈深部并常延伸至宫颈壁外1/3,最明显的特征为浸润性生长。增生的腺体有明显成角、小乳头及套叠,间质常水肿或硬化。而MGH增生腺体分布于子宫颈浅层,缺乏成角及小乳头,间质无硬化,亦无深部浸润。(2)宫颈内膜腺癌:本病的细胞异型性更明显,核分裂象易见,并可见病理性核分裂象。肿瘤性腺体具有浸润性,并伴促纤维增生性间质反应。免疫组化:宫颈内膜腺癌CEA(+);MGH则CEA(-)。另外,Ki-67、P53对病变的良恶性判断确有帮助[5]。(3)宫颈透明细胞癌:透明细胞癌与富含透明细胞的MGH在组织结构上十分相似,但前者常伴有乳头状结构,腺体缺乏分支。这一特征是区别透明细胞癌与MGH非常重要的鉴别点[6]。此外,透明细胞癌细胞内富含糖原,PAS及AB染色可鉴别。(4)宫颈中肾管腺癌:本病亦由小管状腺体构成,腺腔内含有嗜酸性胶样分泌物而非粘液,且常可见乳头状结构,上皮细胞异型性明显。免疫组化:中肾管腺癌:Vimentin、Calretinin、CD10(+);MGH:Vimentin、Calretinin、CD10(-)[7]。(5)子宫内膜样腺癌:本病形成宫颈肿块,肿瘤性异型腺体常伴有宫颈原位腺癌,HPV检测呈阳性。MGH与子宫内膜样腺癌不同,一般不形成宫颈肿块,无肿瘤性异常腺体,HPV检测呈阴性。(6)宫颈鳞癌:MGH中腺体发生广泛鳞化时,导致镜下表现复杂,可能与癌混淆[8]。但宫颈鳞癌细胞有明显异型性,可见核分裂象,浸润的上皮团常与表面异型上皮相延续。而MGH中鳞化上皮与表面上皮不相连,细胞分化成熟,无异型性。免疫组化:鳞癌P53、P16(+);MGH则P53、P16(-)。(7)宫颈内膜遂道状腺丛:本病呈多灶性小叶状分布,腺管间纤维间质较MGH多。腺管呈不同程度扩张,腔内含有浓稠嗜酸性分泌物,间质无明显炎细胞浸润,MGH则与之明显不同。此外,MGH还应与内胚窦癌相鉴别,后者通常发生于年轻女性,且其细胞更为幼稚[9]。MGH缺乏这些特征,认真观察即能将两者鉴别开来。
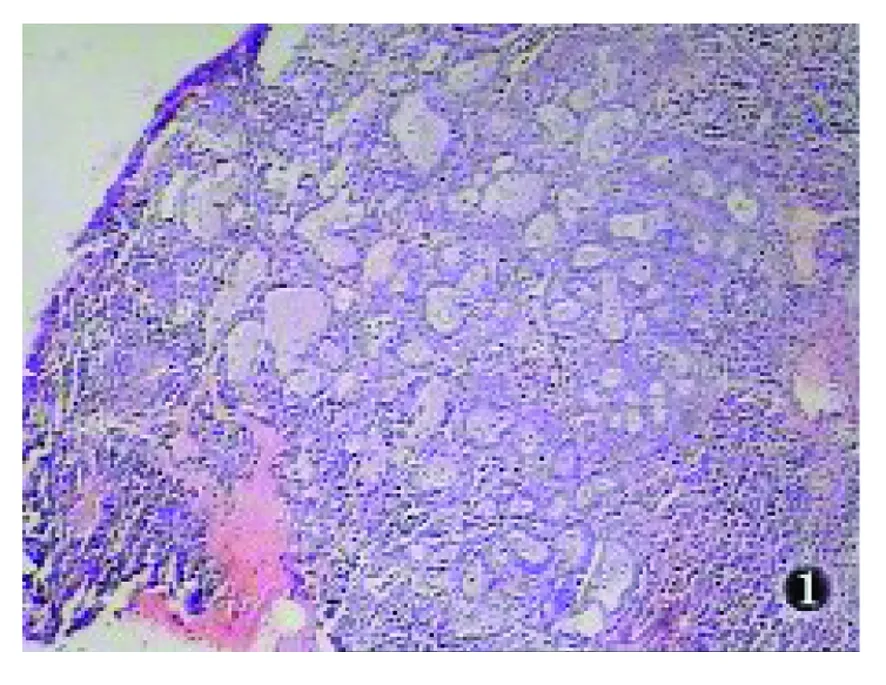
图1 MGH病变主要分布于子宫颈的浅表层,由较多腺体密集组成
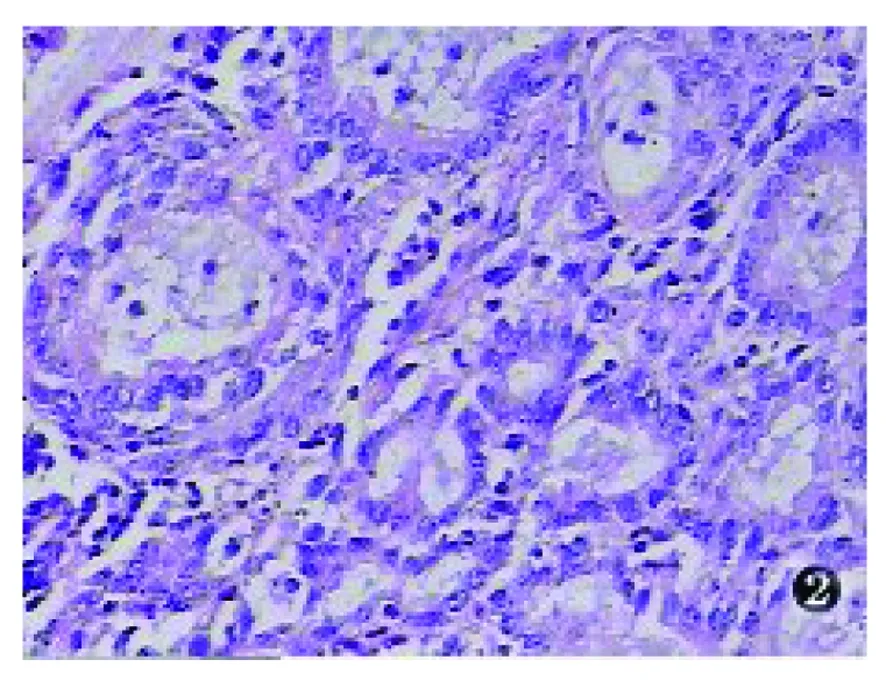
图2 MGH病变腺体大小形态不一致,排列紧密

图3 MGH病变中常常可见腺体背靠背
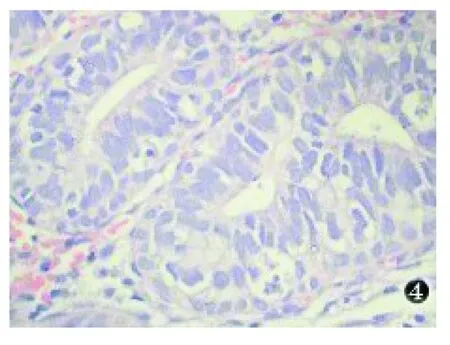
图4 MGH伴不典型增生中腺上皮细胞核显示不典型性
MGH是一种良性病变,认识该病变,对宫颈腺体发生的其它病变,尤其是癌的鉴别诊断十分重要。值得注意的是,MGH主要发生在生育期妇女,对绝经后妇女诊刮标本诊断MGH时应慎重,避免误诊。
参考文献:
[1] Nicolas RM,Filder HK.Microglandular hyperplasia in cervical cone biopsies taken for suspicious and positive cytology[J].Am J clin Pathol,1997,56:424-429.
[2] 涂小予,张廷璆.宫颈微腺体增生-易于误认为恶性肿瘤的良性病变[J].诊断病理学杂志,2000,7(3):174.
[3] Chumas JC,Nelson B,Mann WJ,et al.Microglandular hyperplasia of the uterine cervix[J].Obstet Gynecol,1985,66:406-409.
[4] GreeleyC,SchroederS,Silverberg SG.Microglandular hyperplasis of the cervix.A true "pill"lesion? [J].Int J Gynecol Pathol,1995,14:50-54.
[5] Cina SJ,Richardson MS,Austin RM,et al.Immunohistochemical staining for Ki-67 antigen,carcinoembryonic antigen,an p53 in the diffetential diagnosis of glandular olesions of the cervix[J].Mod pathol,1997,10:176-180.
[6] Robboy,S.J.回允中主译.女性生殖道病理学[M].北京:北京大学医学出版社,2005.130.
[7] Tavassoli,FA.程虹主译.乳腺及女性生殖器官肿瘤病理学和遗传学[M].北京:人民卫生出版社,2006.344.
[8] Rosai J.回允中主译.外科病理学[M].第9版.北京:北京大学医学出版社,2006.1528.
[9] Young RH,Scully RE.Atypical froms of microglandular hyperplasia of the cervix simulating carcinoma A report of five cases and review of the literature[J].Am J Surg Pathol,1989,13:50-56.

