hMSH2、MGMT在子宫内膜癌中的表达及其病理意义
李斯宁,李 玲,王长智
(1.大连医科大学 附属第二医院 妇产科,辽宁 大连116027;2.大连医科大学 附属第二医院 实验中心,辽宁 大连 116027)
子宫内膜癌(endometrial carcinoma,EC),又称子宫体癌,是女性生殖系统常见的三大恶性肿瘤之一,占女性生殖系统恶性肿瘤的20%~30%。近年来,其发病率呈明显上升趋势[1]。作为不稳定细胞,子宫内膜细胞周期性的脱落与增殖,伴随DNA复制,与稳定细胞以及永久性细胞相比,其基因损伤的几率较高。因此,子宫内膜细胞在复制过程中具有较高的修复依赖性。若基因发生损伤,修复系统则发挥其作用,维持基因的稳定性。当基因损伤无法修复时,基因突变产生,突变产物的累积是肿瘤发生的原因之一。在人体内存在多种基因修复方式,DNA复制过程中发生不同类型的损伤都会有相应的修复系统来修复这种损伤,即修复的种类可提示DNA损伤的类型。p53是研究最为广泛的抑癌基因,其突变是多种肿瘤发生的主要原因。p53的突变是目前对子宫内膜癌的研究中已明确的分子生物学改变[2]。由于野生型的P53蛋白半衰期较短,因此,目前认为通过免疫组织化学方法可以检测出的P53蛋白大多是突变型的p53。突变型p53失去了对肿瘤的抑制作用,反而促进细胞的恶性转化。因此,以已知的p53突变为指标,通过检测不同种类的修复方式所表达的蛋白与突变型p53的关系,推测导致p53突变的原因。hMSH2蛋白是错配修复蛋白的主要成员[3]。当细胞中的基因错配增加时,hMSH2蛋白的表达将反馈性增高。MGMT蛋白则具有中和修复DNA烷化损伤的作用[4]。当DNA出现烷化损伤时,MGMT蛋白表达上调。本研究用免疫组织化学法检测正常子宫内膜与子宫内膜癌组织中的hMSH2、MGMT两种修复蛋白的表达,通过分析二者表达与p53表达的关系,探讨子宫内膜癌的发生机制。
1 材料和方法
1.1 研究对象
选取大连医科大学附属第二医院2007~2009年期间诊断明确的子宫内膜癌手术切除标本66例。其中,子宫内膜样腺癌62例,其他类型4例;病理分级I级30例,II级24例,III级12例;无淋巴转移53例,有淋巴转移13例;浅肌层浸润50例,深肌层浸润16例。所有病例均未经放疗、化疗和性激素治疗。正常子宫内膜组织选取自大连医科大学附属第二医院,其中包括分泌期与增生期子宫内膜。
1.2 主要试剂
鼠抗人hMSH2单克隆抗体:Zymed公司(美国);兔抗人p53单克隆抗体: Santa Cruz公司(美国);鼠抗人MGMT单克隆抗体:北京中山试剂公司;SP试剂盒和DAB显色剂:北京中山试剂公司。
1.3 实验方法
(1)石蜡切片脱蜡至水;(2)蒸馏水冲洗,3%H2O2室温孵育;(3)pH6.0柠檬酸缓冲液行抗原修复;(4)加一抗 4℃过夜;(5)加二抗 37℃孵育;(6)加入辣根过氧化物酶;(7)DAB显色,苏木素复染,封片。PBS代替一抗作阴性对照。
1.4 结果判定
hMSH2蛋白阳性表达为细胞核、细胞质或两者均出现棕黄色颗粒,计数5个高倍镜视野或500个细胞,按照染色强度计分:无色记为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;按阳性细胞所占百分比计分:阴性为0分,阳性细胞占10%为1分,11%~50%为2分,51%~75%为3分,>75%为4分。染色强度与阳性细胞所占百分比的乘积≥3分为阳性,<3分为阴性[5]。MGMT蛋白阳性细胞染色为细胞质出现棕黄色颗粒,P53阳性细胞染色为细胞核出现棕黄色颗粒,阳性率(阳性细胞数与肿瘤细胞总数之比)≥20%为阳性表达,<20%为阴性。
1.5 统计学方法
实验结果应用SPSS17.0软件包分析,采用χ2检验和四格表确切概率法处理数据,P<0.05为差异有统计学意义。
2 结 果
2.1 hMSH2 、MGMT及P53在子宫内膜癌和正常子宫内膜组织的表达
hMSH2、MGMT 、P53在子宫内膜癌中表达的阳性率均明显高于正常子宫内膜组织,差异有显著性意义(P<0.05)(表1)。三者在子宫内膜癌中的阳性表达分别见图1~3。
2.2 P53蛋白的表达与子宫内膜癌的病理分级、淋巴转移以及浸润深度之间的关系
P53蛋白的阳性表达率在不同病理分级的子宫内膜癌中差异有显著性意义(P<0.05),Ⅰ~Ⅱ级的阳性表达率为35.2%,而Ⅲ级的阳性表达率为83.3%;有无淋巴结转移组间阳性表达率的差异无显著性意义(P>0.05);浅肌层浸润组阳性表达率明显低于深肌层浸润组(P<0.05)(表2)。
2.3 子宫内膜癌中P53蛋白的阳性表达率与hMSH2、MGMT阳性表达率之间的关系
子宫内膜癌中,hMSH2蛋白在P53阳性组的表达率为96.6%,与阴性组的70.3%比较差异有显著性意义,P53蛋白与hMSH2蛋白表达呈正相关(χ2=7.548,P<0.05);MGMT蛋白在P53阳性组的表达率为65.5%,与阴性组的75.7%比较差异无显著性意义,P53蛋白与MGMT蛋白表达无明显相关性(P>0.05)(表3)。

表1 hMSH2、MGMT 、P53在子宫内膜癌与正常子宫内膜中的阳性表达率
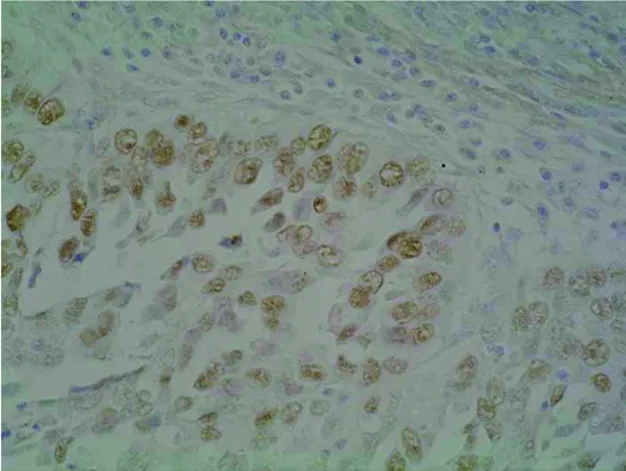
图1 P53蛋白在子宫内膜癌的阳性表达(SP 400×)
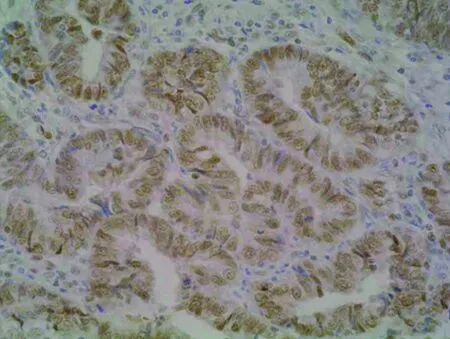
图2 hMSH2蛋白在子宫内膜癌的阳性表达(SP 400×)
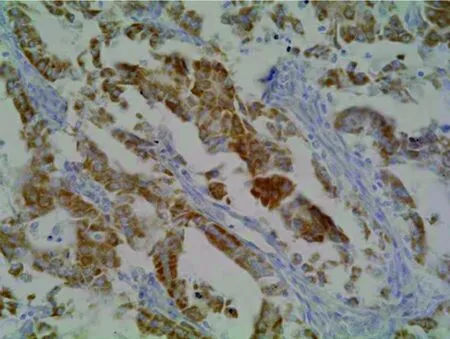
图3 MGMT蛋白在子宫内膜癌的阳性表达(SP 400×)

表2 P53在不同病理分级、有否淋巴转移、不同浸润深度的子宫内膜癌中的阳性表达率
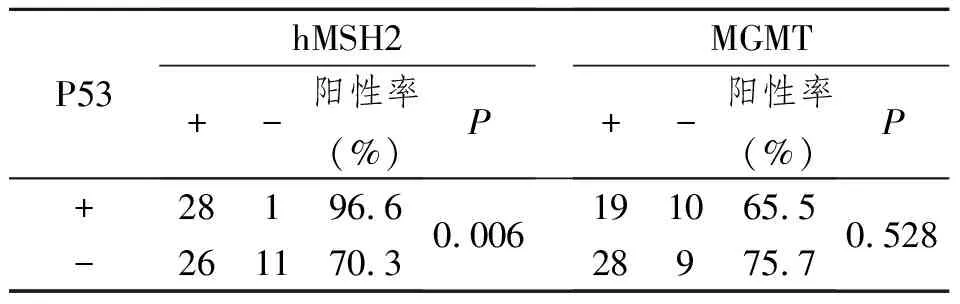
表3 子宫内膜癌中P53蛋白的阳性表达率与hMSH2、MGMT阳性表达率之间的关系
3 讨 论
子宫内膜癌组织学上多数为腺癌。虽然其病因尚不明确,但多数研究认为与持续雌激素刺激和遗传等因素有关。同其他恶性肿瘤一样,子宫内膜癌的发生也是一个包括癌基因激活、抑癌基因突变与失活等多因素参与的渐进过程。由于子宫内膜细胞是不稳定细胞,其DNA复制较其他细胞活跃,在复制过程中发生损伤的机会较高,相应的修复系统功能正常对维持基因组稳定性十分重要。本研究探讨了子宫内膜癌发生过程中DNA修复基因hMSH2和MGMT的表达对抑癌基因p53突变的影响,期望对子宫内膜癌发生机制的研究有所帮助。
目前,有研究认为p53是潜在的肿瘤诊断标志物。p53基因分为野生型和突变型。野生型p53基因是一种抑癌基因,它的失活对肿瘤形成起重要作用,p53是一个重要的抗癌基因,它促使癌细胞凋亡,防止癌变,还具有帮助细胞基因修复缺陷的功能。这种功能对于受化疗药物作用而受伤的癌细胞,则起修复作用,而不是使癌细胞凋亡,造成被修复的癌细胞在治疗后容易产生新的变异进而导致新的肿瘤产生[6]。因此,p53基因突变后不仅失去正常抑癌作用,还可促进细胞恶性转化[7]。hMSH2基因是第1个被分离出来的人类错配修复基因,其编码的蛋白具有识别并参与碱基错配修复的功能,从而能够维持基因组的稳定性[8]。Leach等[9]在对散发性肿瘤(如膀胧上皮恶性肿瘤)的研究中发现hMSH2蛋白的表达常表现为异常升高。董莉等[10]也在实验中发现hMSH2在子宫内膜癌中出现这种高表达的现象,与本实验结果相一致。这可能是癌细胞增殖较正常细胞活跃,DNA发生错配几率增高,hMSH2的表达代偿性增高的结果。MGMT是一种修复基因,其表达的蛋白产物主要是修复由烷化剂导致的DNA损伤。正常情况下MGMT可将DNA链中烷基移到自身半胱氨酸的残基上,从而修复烷化剂导致的DNA损伤[11]。许多学者研究表明,恶性肿瘤中的MGMT均有表达[11-13],而本实验中MGMT蛋白表达率在子宫内膜癌组也显著高于正常子宫内膜组,可能由于细胞发生过多的甲基化损伤而导致癌变,这些损伤需要MGMT表达上调来修复。因而甲基化损伤可能是子宫内膜癌发生的一个原因。本实验结果显示P53蛋白、hMSH2蛋白和MGMT蛋白表达率在子宫内膜癌组均显著高于正常子宫内膜组,提示P53蛋白可作为子宫内膜癌变的标志物之一;联合检测P53、hMSH2和MGMT蛋白可能有助于子宫内膜癌的诊断。
本研究还发现病理分级为Ⅲ级的子宫内膜癌P53蛋白表达率显著高于Ⅰ~Ⅱ级内膜癌,在深肌层浸润组明显高于浅肌层浸润组。许多学者分析,高度恶性的子宫内膜癌与低度恶性子宫内膜癌P53表达有明显差异,P53蛋白表达的量可作为良恶性程度判断的指标之一[14]。提示P53蛋白的阳性表达可视为恶性肿瘤的信号,p53突变的原因一直是探讨基因突变与肿瘤发生相关性的重要问题,本实验通过检测P53蛋白阳性组与阴性组中修复基因的表达差异来反应DNA损伤情况,从而推测突变发生的原因。
本研究检测发现hMSH2蛋白在P53阳性组的表达率显著高于阴性组。子宫内膜癌中的P53表达与hMSH2蛋白的表达呈显著正相关,即P53表达高的组中hMSH2也高表达。MGMT蛋白在P53阳性组的表达率与阴性组比较差异无显著性意义,P53蛋白与MGMT蛋白表达无明显相关性。存在p53突变的子宫内膜癌组织中hMSH2蛋白表达较高,说明突变过程中存在大量的DNA错配, hMSH2蛋白针对p53基因突变中的错配反应性表达上调,以修复受损基因。由此可见,在p53的突变过程中基因错配累积可能是其发生的原因之一。子宫内膜癌发生的根本原因之一可能是由于基因错配累积所引起。
hMSH2、MGMT、p53在子宫内膜癌的发生、发展中可能起着一定的作用,联合检测P53与hMSH2蛋白也可为子宫内膜癌的诊断和预后评估提供重要线索。在子宫内膜癌发生过程中p53突变的原因可能是恶性转化细胞的DNA错配。
参考文献:
[1] Jemal A,Siegel R,Ward E,et al.Cancer statistics[J].CA Cancer J Clin,2007,57(1):43-66.
[2] LAX S F,KENDALL B,TASHIRO H,et al.The trequency of p53,Krasmutations,and microsatellite instabiliey differs in utenine endonetroid and serous carcinoma.Evidence of diseinctmol-ecdlargenetic pathwas[J].Cancer,2000,88: 814-824.
[3] Lipkin SM,Wang V,Jacoby R,et al.MLH3:a DNA mismatch repair gene associated with ammalian microsatel-lite instability[J].Nat Genet,2000,24(1): 27-35.
[4] Dolan ME,Schilsky RL.Silence is golden gene hypernethylation and survival in large-cell lymphoma[J].National Carcinoma Institute,2002,94(1):6-7.
[5] 许良中,杨文涛.免疫组织化学结果的判定[J].中国癌症杂志,1996,6(4):229-231.
[6] 欧阳艳.p53和pten在子宫内膜癌的表达及其意义[J].西南军医,2010,512(3):421-422.
[7] Hoffman WH,Biade S,Zilfou JT,et al.Transcriptional repression of the anti-apoptotic survivin gene by wild type P53[J].J Biol Chem,2002,277:3247-3257.
[8] 王怡璐,李梅,吕申.子宫内膜癌hMSH2及P53蛋白表达的意义[J].大连医科大学学报,2005,27(6):427-429.
[9] Leach FS,Polyak K,Burrell M,et al,Expression of the human mismatch repair gene hMSH2 in normal and neoplastic tissues[J].Cancer,1996,56:235-240.
[10] 董莉,王文革,王莉.错配修复基因hMLH1、hMSH2及p53在子宫内膜癌中的表达及意义[J].实用药物与临床,2007,10(2):71-73.
[11] 费建东,王晓寅,薄爱华.胃癌中MGMT和EGFR表达及其意义[J].Modern oncology,2010,18(7):1346-1348.
[12] 赵健,雷建宾,姜海涛.MGMT在人脑胶质瘤中的表达及其意义[J].现代肿瘤医学,2008,16(1):26-29.
[13] 斯向东,舒畅,徐宾.O6-甲基鸟嘌呤-DNA甲基转移酶与P53蛋白在结直肠癌中的表达及临意义[J].实用医学杂志,2009,25(24):4116-4118.
[14] Sigurd F,Brian Kendall,Hironori Tashiro,et a1.The frequency of P53,k-ras mutations and micosatellite instability differs in uterine endometrial cancer cells [J].Cancer,2000,88(4): 814-824.

