布鲁菌外膜蛋白的糖基化及免疫效果检测
付景丽,董炳梅,王 若,王家鑫
(河北农业大学动物科技学院免疫学实验室,河北保定071000)
布鲁菌最主要毒力特征是在吞噬细胞内生存和复制,这是布鲁菌逃避宿主免疫监视的主要原因[1]。目前,对布鲁菌病的防控主要是接种疫苗,宿主产生的免疫应答以细胞免疫为主,体液免疫为辅。然而,目前使用的疫苗大都为布鲁菌减毒活疫苗[2],在实际应用中活疫苗存在残余毒力强、偶尔回复毒力等危险。为避免传统减毒疫苗的缺陷,根据布鲁菌特殊的致病机制与机体对布鲁菌的免疫应答机制,我们寻找了布鲁杆菌特异性外膜蛋白,并对其免疫效果做了相关研究。为研制安全、有效、新型靶化布鲁菌外膜蛋白(OMPs)疫苗提供研究基础。
1 材料与方法
1.1 材料 BALB/c小鼠(体重20~25 g,雄性,合格证编号904173)购自河北省实验动物中心,佐剂:Montanide IMS 251C VG由法国赛比克公司惠赠,Pro.Pure proteomics Grade 12.5%购自Amresco,α-D-甘露吡喃异硫氰酸苯酯、TritonX-100、DMSO、4-甲基吗啉购自Sigma公司,2,6,10,14-四甲基十五烷购自 Acros,Lysozyme Chicken Egg White、两性洗涤剂3-14购自Calbiochem,RPMI-1640购自Invitrogen Corporation,Mouse IFN-γQuantikine ELISA Kit购自R&D公司。
1.2 布鲁菌OMPs的分离与纯化
1.2.1 布鲁菌OMPs的提取 将布鲁菌猪种S2型约3×105亿活菌,用 PBS缓冲液 5 000 r/mim×20 min离心,洗涤3次,弃上清。之后按照文献[3]方法步骤操作,18 000 r/min4℃离心20 min,取上清,4℃保存。
1.2.2 布鲁菌的电洗脱OMPs纯化 (1)蛋白的浓缩与两性洗涤剂的去除:取上提取蛋白,以体积比1∶4加入丙酮,15 000 r/min离心20 min,收集沉淀,加入10 mmol/L Tris Buffer溶解,用紫外分光光度计测定蛋白含量,调整蛋白浓度为1 mg/mL。(2)使用Pro.Pure proteomics Grade 12.5%进行SDS-PAGE电泳。(3)SDS-PAGE电泳后,取出凝胶直接置于100 mmol/L的 KCl溶液中,4℃浸泡2 h;参照标准蛋白从凝胶上切下目的条带,装入透析袋中,加入适量pH值7.2 PBS,恒压80 V电泳45 min;收集电洗脱液,即纯化的目的蛋白。用紫外分光光度计测定样品在波长260 nm和280 nm时的光吸收值,按蛋白浓度(mg/mL)=(1.45×A280-0.74×A260)×稀释倍数,计算样品中蛋白含量,分装,用冷冻干燥机将所得目的蛋白冻干,-20℃保存备用。
1.3 布鲁菌OMPs的糖基化修饰与糖基化产物的鉴定
1.3.1 OMPs的糖基化修饰 把2 mg蛋白质加入200 μ L二甲基亚砜(DMSO)中混匀,然后加入4 mg α-D-甘露吡喃异硫氰酸苯酯和2 μ L 4-甲基吗啉,混合物150 r/min摇动过夜,再加入 100 μ L 1 mol/L T ris-HCl(pH值7.5)作用1 h,以水解甘露糖。之后,-20℃保存。
1.3.2 间苯二酚-硫酸法鉴定拟糖蛋白 将20 μ L梯度稀释的α-D-甘露糖标准溶液(100 μ g/mL)和修饰的蛋白、未修饰的蛋白分别加入200 μ L离心管中,再加入间苯二酚(6 mg/mL)20 μ L 、75%硫酸100 μ L 和姥蛟烷 50 μ L,混匀,置于 90 ℃水浴反应30 min,取出后暗盒静置30 min。从反应管中取90 μ L移入96孔板中,检测OD405nm吸光值[4]。
1.4 蛋白抗原与佐剂乳化成试验用疫苗。
1.5 免疫接种试验 采取完全随机资料的方差分析比较如下种类的免疫效果:60只6~8周龄BALB/c小鼠随机分成5组:A组、B组、C组、D组、E组,每组12只,分别接种:纯化蛋白质、糖基化蛋白质、试验用疫苗、布鲁菌病活疫苗(S2)、PBS;接种途径:皮下注射;接种剂量:s2疫苗组3亿CFU/只 ,其他组均为 15 μ g/只;免疫次数:两次 ;免疫间隔为两周。
1.5.1 试验取材 (1)一免后 4、7、10、14 d,二免后 4、7、10 、14 d,尾静脉 、隐静脉采血 ,分离血清 ,进行抗体 IgG检测。(2)一免后4、10 d;二免后4、10 d,进行眼眶静脉丛取血,置1.5 mL Eppendorf管中,室温静置30 min,5 000 r/min离心10 min,取上清,置-20℃低温冰箱中保存待测 γ-干扰素(IFN-γ)浓度。
1.5.2 试验结果指标的检测 血清中抗体采取ELISA法检测,结果读取450 nm处OD值;血清中IFN-γ采用Mouse IFN-γ Quantikine ELISA Kit检测,结果以pg/mL表示。
1.6 统计学处理 试验数据采用SPSS16.0软件进行处理,检验水准α=0.05,以P<0.05为有统计学意义。
2 结果
2.1 布鲁菌OMPs的分离与纯化后SDS PAGE电泳结果 见图1。

图1 布鲁菌全外膜蛋白(左),目的外膜蛋白(右)
2.2 糖基化产物的鉴定结果 根据标准甘露糖溶液的OD405值制作标准曲线,计算糖基化产物的含糖量为:0.301 mg/mL,未糖基化蛋白:0.045 mg/mL,糖基化蛋白的含糖量显著高于未糖基化蛋白,证明蛋白质已经成功被糖基化。
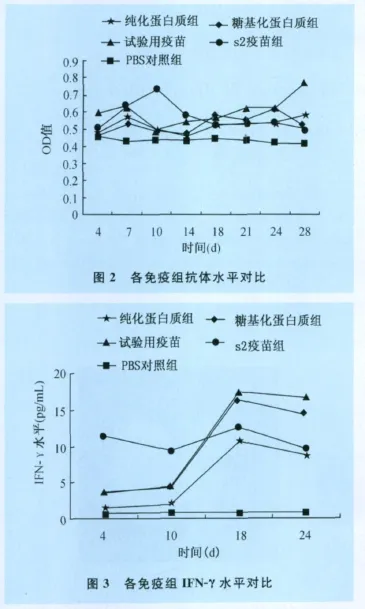
2.3 免疫接种试验结果 见图2、图3。
3 讨论
有研究发现利用布鲁菌蛋白或核酸组分免疫动物 ,可产生一定的保护作用[5]。组分苗具有无菌体毒力增强现象和致敏原性弱等优点。OMPs位于细菌的表面,容易被免疫系统识别,在与宿主的相互作用中发挥作用。另一方面,很多外膜蛋白都具有免疫原性,其中很大一部分是免疫保护抗原[6-7]。本试验选择了分子质量分别为37.5 kD与47.2 kD的布鲁菌OMPs进行了抗原性分析研究。
树突状细胞(dendritic cell,DC)是惟一能激活初始性T细胞的专职抗原提呈细胞。DC表面有丰富的甘露糖受体(mannose receptor,MR),MR可快速循环于胞膜和早期内体间,在较短的时间内即可内化大量的抗原[8]。基于MR可有效介导抗原的摄取及内化,我们将布鲁菌OMPs抗原进行了甘露糖修饰,使其含有DC表面MR的特异性配体,进行更有效的T细胞应答。结果说明,本试验筛选的布鲁菌OMPs具有良好的免疫原性,经α-D-甘露吡喃异硫氰酸苯酯糖基化修饰后有效提高了DC的吞噬与抗原提呈作用,增强了机体的细胞免疫应答。
纳米佐剂均匀性好,包裹或吸附抗原颗粒后成为巨噬细胞和DC的首选吞噬目标 ,而且纳米佐剂与多肽抗原或DNA疫苗连接后 ,可以避免常规佐剂的载体效应 ,保护抗原[9]。为此本试验侯选蛋白抗原经糖基化修饰后,与新型纳米颗粒佐剂乳化成试验用疫苗。BALB/c小鼠免疫接种试验结果显示,试验用疫苗与其他组相比,血清中IFN-γ水平呈逐渐升高趋势,特别是在二免后出现显著性升高(P<0.05)。说明试验用疫苗有效诱导了机体的免疫应答,且产生了免疫记忆;血清中IgG抗体水平各处理组均高于PBS对照组,试验用疫苗略好于其他处理组。
本试验基于实验室,对动物用布鲁菌靶向化疫苗进行了大胆的设计与研究,取得了理想的试验结果。
[1]AnaI Martí n-Martí n,Nieves Vizcaí no,LuisFernández-Lago.Cholesterol,ganglioside GM1 and class A scavenger receptor contribute to infection by Brucella ovis and Brucella canis in murine macrophages[J].Microbes and Infection,2010,12:246-251.
[2]Xinghong Yang,T heresa Thornburg,Nancy Walters,et al.Delta znuA DeltapurE Brucella abortus 2308 mutant as a live vaccine candidate[J].Vaccine,2010,28:1069-1074.
[3]黄新新,陆承平.迟缓爱德华菌外膜蛋白抗原性分析[J].中国免疫学杂志,2002(18):385-387.
[4]钟国成,许明.负载甘露糖化抗原的DC诱导的特异性杀伤[J].细胞与分子免疫学杂志,2007,23(2):117-123.
[5]Commander N J,Spencer S A,Wren B W,et al.T he identification of two protective DNA vaccines from a panel of five plasmid constructs encoding Brucella melitensis 16M genes[J].Vaccine,2007,25(1):43-54.
[6]Cassataro J,Estein S M,Pasquevich K A,et al.Vaccination with the recombinant Brucella outer membrane protein 31 or a derived 27-amino-acid synthetic peptide elicits a CD4+T helper 1 response that protects against Brucella melitensis infection[J].Infect Immun,2005,73(12):8079-8088.
[7]Cassataro J,Pasquevich K A,Estein S M,et al.A recombinant subunit vaccine based on the insertion of 27 amino acids from Omp31 to the N-terminus of BLS induced a similar deg ree of protection against B.ovis than Rev.1 vaccination[J].Vaccine,2007,25(22):4437-4446.
[8]McKenzie E J,Tay lor P R,Stillion R J,et al.Mannose recepto r expression and function define a new population of murine dendritic cells[J].J Immunol,2007,178(8):4975-4983.
[9]梁存军,黎晓敏,吕凤林.无机纳米佐剂研究进展[J].中国生物制品学杂志,2007,20(7):543-546.

