细胞凋亡相关的斑点样蛋白与半胱氨酸蛋白酶-1在淋巴瘤中的表达及临床意义
江兴林,左云飞
1.怀化医学高等专科学校,湖南怀化 418000;2.大连医科大学,辽宁大连 116044
细胞凋亡相关的斑点样蛋白(apoptosis-associated specklike protein,ASC)是含有胱天蛋白酶募集结构域(caspase recruitment domain,CARD)的与细胞凋亡相关的蛋白活化因子,细胞凋亡或程序性细胞死亡是正常发育和体内稳态的必要过程[1]。很多研究证实在许多肿瘤中,肿瘤样改变和肿瘤细胞的生长与细胞凋亡的抑制密切相关。有报道在一些肿瘤细胞株中ASC表达增高时能导致细胞凋亡,并且其定位可使细胞溶质结构更清晰[2];细胞凋亡程序被触发后,执行细胞凋亡程序,需依赖Caspase(半胱氨酸蛋白酶)家族的激活[3-5]。因此,ASC、Caspase家族在细胞凋亡的信号通路中均具有重要作用。已有研究表明ASC表达增高能通过肿瘤坏死因子和活化caspase-8使凋亡信号放大[6]。同时有研究证实,ASC基因启动子的频繁甲基化在前列腺癌、肝癌、乳腺癌及黑色素瘤中普遍存在[3-4,7-8]。说明ASC基因被甲基化而不表达,不能触发细胞凋亡,从而导致癌的发生。该基因编码的衔接蛋白ASC还参与免疫反应、炎性反应的信号转导通路,通过Caspase结构域与Caspase-1结合,进一步使Caspase-1活化,引起致炎细胞因子、IL-1和IL-18的激活与分泌,实现对肿瘤的抑制。本实验通过对淋巴瘤及癌旁组织中ASC、Caspase-1的表达情况采用免疫组织化学方法测定,探讨其表达跟淋巴瘤发生和发展及与临床的联系。
1 资料与方法
1.1 一般资料
从大连医科大学附二院和湖南肿瘤医院选取1995年1月~2007年1月通过病理学证实的淋巴瘤和相应癌旁组织石蜡包埋标本各30例,术前均未接受放、化疗,其中,男21例,女9例;年龄33~85岁,平均47岁。由病理医师对切片进行复查确诊,按Dukes分期进行临床病理分期,其中,A期6例,B期15例,C期6例,D期3例。
1.2 方法
免疫组化操作按LSAB免疫组化试剂盒说明进行,阴性对照中一抗采用PBS代替,阳性对照采用已知的阳性标本。具体操作:石蜡切片依次用二甲苯、无水乙醇、95%乙醇、70%乙醇、自来水洗脱蜡水化,98℃枸橼酸钠液中修复抗原,3%H2O2消除内源性过氧化物酶。正常山羊血清封闭非特异性抗原,分别滴加 ASC、Caspase-1 一抗(1∶200 稀释),4℃冰箱过夜,滴加生物素标记的二抗。加入LSAB复合物。DAB显色,苏木素染液复染,65℃水中蓝化,依次在75%乙醇、85%乙醇、95%乙醇、无水乙醇、二甲苯中脱水,中性树胶封片,显微镜下观察。
1.3 观察指标
阳性细胞为在细胞中染棕黄色。随机观察5个高倍视野(×400),计算阳性细胞数百分比。 ASC、Caspase-1阳性细胞百分数<25%为阴性,≥25%为阳性。
1.4 统计学分析
采用SPSS 11.0软件进行统计学分析,率的比较用χ2检验或 Fisher's Exact Test。
2 结果
2.1 在淋巴瘤及癌旁组织中ASC的表达
ASC阳性染色主要在细胞浆中染棕黄色,胞核少数可见,见图1A。淋巴瘤组织及癌旁组织中ASC阳性率分别为16.67%(5/30)与 76.67%(23/30),组间阳性表达率差异有高度统计学意义(P<0.01),见表 1。
2.2 在淋巴瘤及癌旁组织中Caspase-1的表达
Caspase-1阳性染色主要在细胞浆中染棕黄色,胞核少数可见,见图1B。淋巴瘤组织及癌旁组织阳性率分别为26.67%(8/30)与 63.33%(19/30),组间阳性表达率比较,差异有统计学意义(P<0.01),见表 1。

2.3 在淋巴瘤及癌旁组织中ASC与Caspase-1表达分析
ASC与Caspase-1两指标在淋巴瘤组织中的表达均低,但差异无统计学意义(P>0.05),见表2;而在癌旁组织中两指标表达均增高,且高度相关(P<0.01),见表 3。
3 讨论
SC是一种与细胞凋亡相关的抑癌基因,属于CED4/Apaf1基因家族,其基因定位于16p11.2-12[2],编码的蛋白质分子量为22 kDa,C-末端含有半胱氨酸蛋白酶募集结构域(a caspase recruitment domain, CARD),是与细胞凋亡信号有关的蛋白质,N-末端为热蛋白样结构域(a pyrin domain,PYD),是参与免疫反应有关的蛋白质。ASC可在许多正常组织中表达,如在结肠组织中,ASC在高分化的上皮细胞绒毛端表达高,这样通过细胞凋亡以维持细胞的不断更新[9],而ASC在低分化的毛囊细胞中不表达[3]。其他组织如甲状腺、脾、小肠、肺、中性粒细胞、单核细胞等中亦有同样现象,依此可推测,在构建和维持细胞分化状态中ASC可能起作用,与正常上皮细胞的增殖及分化信号相关。提示:在肿瘤细胞和肿瘤组织中ASC表达是降低的。许多研究证实ASC在不同类型细胞凋亡的调节中具有明显的作用,成为癌治疗的新靶点[10]。当ASC表达缺失时组织易发生癌变。如在黑色素瘤、乳腺癌、前列腺癌、胆管癌、人类结肠癌细胞株中的研究中均发现由于ASC基因的异常甲基化,导致ASC不表达或表达减少[4-5,11]。同样在肝癌的研究中也发现,具有与ASC的Pyrin结构域同源性很高的蛋白(ASC-Like,ASCL)的编码基因,甲基化程度在肝细胞癌细胞株中高达80%,而在肝细胞正常样本中甲基化不明显。在肝细胞癌样品中,观察到ASCL和ASC的甲基化均为53%。用脱甲基化试剂5′-乙酰唑胺2′-脱氧胞苷酸能使ASCL因甲基化不表达的细胞再生[8]。另外,ASC缺少可激活NF-κB途径,NF-κB激活可引起肿瘤细胞增殖,引起肿瘤在血管生成及转移。在上皮源性肿瘤和白血病、淋巴瘤中,由于ASC基因表达缺失而抑制细胞凋亡,也可能激活NF-κB。表明ASC基因在淋巴瘤中的发展起重要作用,能成为淋巴瘤防治的一个有希望的靶点。本实验的结果显示,在淋巴瘤中ASC的表达显著低于癌旁组织(P<0.01),跟以往报道的因ASC基因甲基化而在各类癌中表达减少一致。
Caspase为半胱氨酸蛋白水解酶家族,包括3大类型:启动型、效应型和炎症型。与细胞凋亡和机体免疫反应密切相关。其中Caspase-2、8、9、10属于启动型,活化后可启动细胞凋亡和调节效应型 Caspase;Caspase-3、6、7属于效应型,可水解细胞蛋白,引起细胞凋亡;Caspase-1、4、5等属于炎症型,活化后可引起一系列的炎症因子的释放,进一步导致炎症反应[12]。Caspase-1为炎症反应过程的重要作用物质。很多的研究证实,ASC可作为衔接蛋白通过Caspase补充区域(CARD),以CARD/CARD途径与原Caspase-1特异结合,使其活化,然后引起IL-1和IL-18等炎症细胞因子的成熟与活化[11-13],推测ASC可能通过激活caspase-1信号途径来实现它的抗肿瘤效应。机体可通过免疫系统达到识别和杀死癌细胞之目的。有报道IL-18在多发性鼠肿瘤模型中有显著的抗肿瘤效应。如T细胞受到肿瘤细胞的刺激而活化,或释放细胞因子,活化IL-18、IL-1B,实现抗肿瘤功能。当ASC缺失时,能使免疫细胞活化、增殖和抗肿瘤效应受影响[14]。本实验表明,淋巴瘤组织与癌旁组织中Caspase-1表达存在显著差异(P<0.01),虽在淋巴瘤组织中ASC与Caspase-1两者表达都减少,但差异不明显(P>0.05),而在癌旁组织中表达均显著增高(P<0.01)。结果显示,Caspase-1的表达可能依赖ASC的介导。
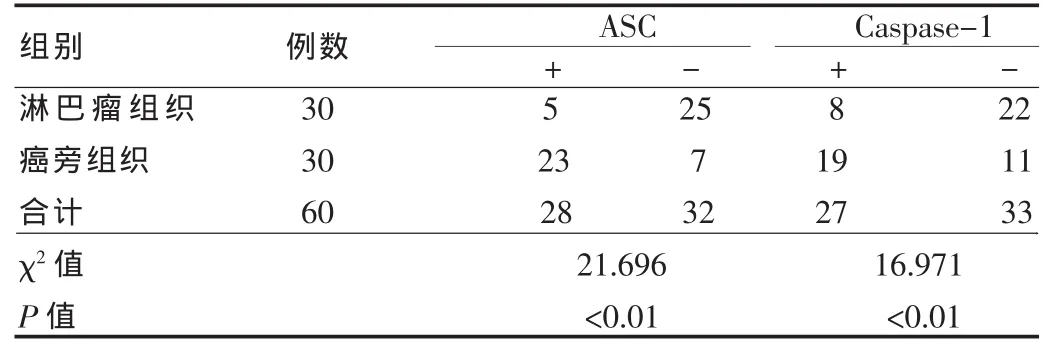
表1 在淋巴瘤组织及癌旁组织中ASC、Caspase-1表达结果的比较(例)

表2 在淋巴瘤组织中ASC与Caspase-1表达结果的比较(例)
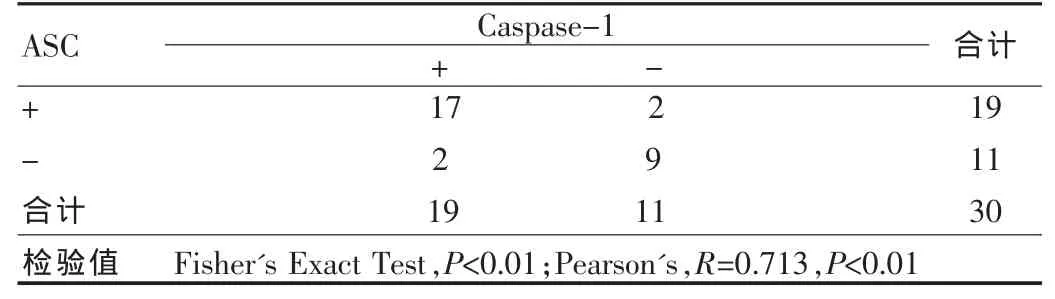
表3 在癌旁组织中ASC与Caspase-1表达结果的比较(例)
总之,本实验表明在淋巴瘤组织中ASC、Caspase-1表达减少;虽在淋巴瘤组织中2个指标表达都降低,但无相关性;而在癌旁组织中2个指标中表达均增高,且高度相关。提示,在淋巴瘤的凋亡、发生和发展过程中,ASC、Caspase-1与之密切相关,可成为淋巴瘤的诊断及治疗有希望的靶点。
[1]Minno Y,Sengoku K,Nakao M,et al.Mouse/human sequence divergence in a region with a paternal-specific methylation imprint at the human H19 locus[J].Hum Mol Genet,1996,5(8):1155-1161.
[2]Masumoto J,Taniguchi S,Ayukawa K,et al.Sagara,ASCnovel 22-kDa protein,aggregates during apoptosis of human promyelocytic leukemia HL-60 cells[J].JBiol Chem,1999,274:33835-33838.
[3]Guan X,Sagara J,Yokoyama T,et al.ASC/TMS1,a caspase-1 activating adaptor,is downregulated by aberrant methylation in human melanoma[J].Int JCancer,2003,107(2):202-208.
[4]Das PM,Ramachandran K,Vanwert J,et al.Methylation mediated silencing of TMS1/ASCgene in prostate cancer[J].Mol Cancer,2006,5:28.
[5]Liu XF,Zhu SG,Zhang H,et al.The methylation status of the TMS1/ASC gene in cholangiocarcinoma and its clinical significance[J].Hepatobiliary Pancreat Dis Int,2006,53:449-453.
[6]Parsons MJ,Vertino PM.Dual roleof TMSI/ASCin death receptor signaling[J].Oncogene,2006,25(52):6948-6958.
[7]Mc Connell BB,VertinoPM.TMSI/ASC:thecenner connection[J].Apoptosis,2004,9(1):5-18.
[8]Kubo T,Yamamoto J,Shikauchi Y,et al.Apoptotic speck protein-like,a highly homologous protein to apoptotic speck protein in the pyrin domain,is silenced by DNA methylation and induces apoptosis in human hepatocellular carcinoma[J].Cancer Res,2004,64(15):5172-7.
[9]McConnell BB,Vertino PM.Activation of acaspase-9-mediated apoptotic pathway by subcellular redistribution of the novel caspase recruitment domain protein TMS1[J].Cancer Res,2000,60:6243-6247.
[10]Motani K,Kawase K,Imamura R,et al.Activation of ASC induces apoptosis or necrosis,depending on the cell type,and causes tumor eradication[J].Cancer Sci,2010,101(8):1822-1827.
[11]Yokoyama T,Sagara J,Guan X,et al.Methylation of ASC/TMSI,a proapoptotic gene responsible for activating procaspase-1,in human colorectal cancer[J].Cancer Lett,2003,202(1):101-108.
[12]Nicholson DW.Caspase structure,proteolytic substrates,and function during apoptotic cell death[J].Cell Death and Dif-fermentation,1999,6(11):102-108.
[13]Fernandes-Alnemri T,Wu JW,Datta P,et al.The pyropto-some:a supramolecular assembly of ASC immers mediating in flammatory cell death via caspase-1 activation[J].Cell Death Differ,2007,14(9):1590-1604.
[14]StoneAR,Bobo W,Brat DJ,etal.Aberrantmethylationand down-regulation of TMS/ASC in Human Glioblastoma [J].Am J Pathol,2004,165(4):1151-1161.

