感染A型产气荚膜梭菌小鼠体内α毒素的分布及定位
王苗利,蔡玉梅,柴同杰,张红娜
(山东农业大学动物科技学院环境微生物实验室,山东泰安271000)
感染A型产气荚膜梭菌小鼠体内α毒素的分布及定位
王苗利,蔡玉梅*,柴同杰*,张红娜
(山东农业大学动物科技学院环境微生物实验室,山东泰安271000)
为了研究α毒素在感染A型产气荚膜梭菌动物的体内的分布情况,自制了高效价的兔抗α毒素多克隆抗体作为一抗,HRP和FITC分别标记的羊抗兔IgG作为二抗,通过免疫组化法对α毒素进行了定位检测。结果表明,在小鼠延髓、肠、肾、肺、胃的间充质细胞胞浆中发现了阳性颗粒,在脾、肝的间充质细胞中未发现毒素分布。结果提示,首次在延髓的细胞胞浆中发现了α毒素,表明α毒素能突破血脑屏障进入延髓损坏生命中枢,这可能是引起动物死亡的一个重要原因。
A型产气荚膜梭菌;α毒素;蛋白表达;免疫组化
*通讯作者
产气荚膜梭菌(Clostridiumperfringens)又称魏氏梭菌,是引起各种动物坏死性肠炎、肠毒血症和人创伤性气性坏疽的主要病原菌之一[1]。该菌分为A、B、C、D、E 5个型,其致病因子是菌体产生的外毒素[2]。在家畜,主要引起牛羊“猝死症”[3]。在家禽,主要引起坏死性肠炎而危害养禽业[4]。其中A型产气荚膜梭菌病是影响养殖业的主要疾病之一,给养殖业带来了巨大的经济损失。此外,A型产气荚膜梭菌还可引起人的食物中毒[5]。该型菌的主要致病毒素是α毒素,它具有细胞毒性、溶血活性、致死性、皮肤坏死性、血小板聚集和增加血管渗透性等特性[6]。
国内外对产气荚膜梭菌α毒素的致病性进行了许多方面的研究[7],但缺少具体的有关检测A型产气荚膜梭菌α毒素在患病动物体内各组织中的分布情况的研究。本试验以小鼠为试验动物,采用免疫组化方法探讨α毒素在小鼠体内的分布,方法简便,操作简单,周期短,便于保存,可为进一步阐明α毒素致病机理提供科学的理论依据。
1 材料与方法
1.1 材料
产气荚膜梭菌A528型菌株(ATCC528标准菌株,由德国柏林大学提供),本实验室保存;新西兰兔(2.5kg)及昆明小鼠(18g~20g),购自泰邦生物公司;引物由上海生工生物工程技术服务有限公司合成;限制性内切酶、DNA凝胶回收试剂盒和克隆载体、表达载体pET28a为宝生物工程(大连)有限公司产品;感受态细胞Top10、BL21(DE3)PlysS及其DNA抽提试剂为北京全式金生物技术有限公司产品;Ni-Agarose His标签蛋白纯化柱、抗体亲和层析纯化柱及T-MaxTM佐剂为南京金斯瑞生物科技有限公司产品;HRP标记羊抗兔二抗、FITC标记羊抗兔二抗、过氧化物酶DAB底物显色液为北京博奥森生物公司产品。
1.2 方法
1.2.1 α毒素全基因的PCR扩增、克隆及表达载体的构建 通过引物软件DNA Star以及primmer5.0,设 计 上 游 引 物 5′-GCGGAATTCATGAAAAGAAAGATTTGT-3′,下游引物 5′-GCGGCGAAGCTTTTATTTTATATTATAAGTT-3′,预期产物长度1 228bp。回收PCR产物,与T载体连接、转化,蓝白斑筛选阳性重组菌。将重组质粒与表达载体pET28a用EcoRⅠ/XhoⅠ双酶切,回收片段和线性pET28a,将两者连接、转化,筛选阳性重组菌落,接种于含100mg/mL Kan的LB培养液中扩增,提取质粒,送金斯特工程有限公司测序。
1.2.2 α毒素蛋白的诱导表达与纯化 将重组菌液接种到LB培养基中,分为4组,37℃振荡培养,IPTG终浓度分别为0 、0.1、0.6、1.0mmol/L,将不同时间的菌液取样,SDS-PAGE电泳分析,同时做空载体对照组,根据电泳结果判定最佳诱导条件。将最佳条件下表达的菌液超声裂解,4℃离心,分离上清与沉淀。沉淀用尿素重悬,与上清分别上柱纯化,透析。
1.2.3 制备兔抗α毒素多克隆抗体 将透析后蛋白与佐剂混合制成疫苗免疫兔,同时设对照组,14d后第2次免疫,28d后第3次免疫,35d后采血ELISA测滴度,38d后颈部采血,经亲和层析柱纯化去除杂抗体,测定效价。
1.2.4 A型产气荚膜梭菌攻毒试验 将A528菌株接种于Gordon产毒肉汤,42℃厌氧震荡培养6h~9h,取培养液常规硫酸铵沉淀法提取外毒素,用灭菌生理盐水稀释,腹腔皮下注射于6只小鼠,同时设生理盐水注射阴性对照组,取72h内死亡小鼠的组织,投入40g/L多聚甲醛固定液中,阴性对照组操作同上。
1.2.5 组织切片的制备及病理组织学检查 组织于多聚甲醛中固定48h后,常规脱水、透明、包埋、切片。取对照组和攻毒组的切片做常规HE染色,观察病理组织学变化。操作步骤如下:切片经二甲苯脱蜡,梯度酒精脱水,水化,置入Gill苏木素中染色10min,水冲至不脱色。盐酸酒精溶液分化、返蓝。取出切片置于850mL/L酒精溶液2s,再置于10g/L伊红染液染色0.5min~1min,水冲至不脱色为止。取出切片进行酒精脱水,二甲苯透明,封片、镜检。
1.2.6 α毒素蛋白的免疫组织化学检测 取攻毒组的组织切片,分别进行酶标及荧光标记免疫组化实验。将兔抗α毒素一抗稀释倍数依次设为1∶50、1∶100、1∶300,1∶600、1∶1 000,HRP标记二抗稀释倍数为1∶100、1∶200,FITC标记二抗稀释倍数为1∶100、1∶200。同时设阴性对照,阴性对照使用未攻毒小鼠组织,摸索一抗、二抗的最佳稀释倍数。步骤如下:将各组织切片于57℃烤箱内烘烤4 h后,二甲苯脱蜡,梯度酒精脱水,水化;取出切片于3mL/L过氧甲醇中室温孵育20min,再用PBS漂洗2min×3次,置于0.5mL/L Teween-20中室温孵育3min~5min;将切片浸于柠檬酸盐缓冲液中,进行微波修复,每次修复5min,共修复3次,中间室温冷却,冷却后PBS漂洗2min×3次;滴加50g/L BSA封闭液,于37℃湿盒内孵育20min;弃去孵化液,滴加1∶300稀释浓度的兔抗α毒素抗体,4℃湿盒内孵育14h~18h后,取出湿盒于37℃复温45 min,PBS漂洗2min×3次;切片置0.5mL/L Teween-20中室温孵育2min,弃去多余液体,滴加浓度为1∶200的HRP标记的山羊抗兔IgG,37℃湿盒孵育40min,用PBS漂洗2min×3次;滴加辣根过氧化物酶DAB显色液至标本上,显色5min~10min,蒸馏水充分洗涤终止反应;切片置入Gill苏木素中染色1min,脱水,透明封片,镜检。
FITC荧光标记免疫组化操作方法同免疫组织化学检测,只是在HRP标记的山羊抗兔IgG,37℃湿盒孵育40min后,PBS漂洗2min×3次后,即可封片于荧光显微镜下进行镜检。
2 结果
2.1 α毒素全基因PCR扩增、克隆及表达载体的构建结果
在进行了32个循环的扩增后,经10g/L琼脂糖凝胶电泳,结果表明,成功扩增出1 228bp的α毒素基因片段(图1)。
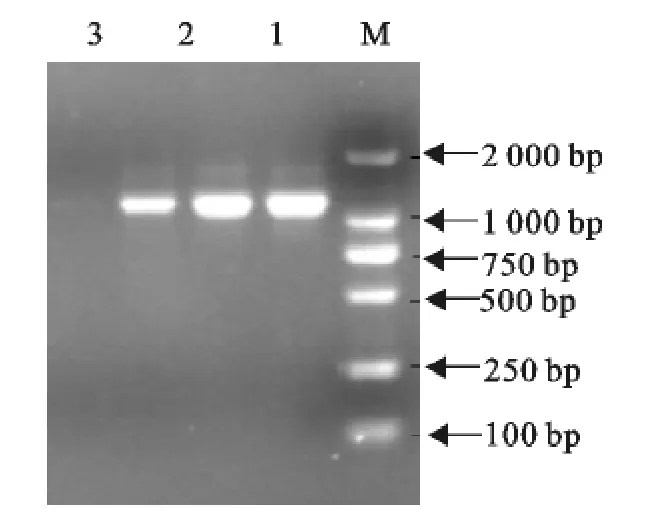
图1 PCR结果电泳图Fig.1 Electrphoresis of PCR products
阳性重组质粒经EcoRⅠ/HindⅢ双酶切后能被切成约1.2kb和5kb的2个片段,与预期的酶切图谱相一致(图2)。
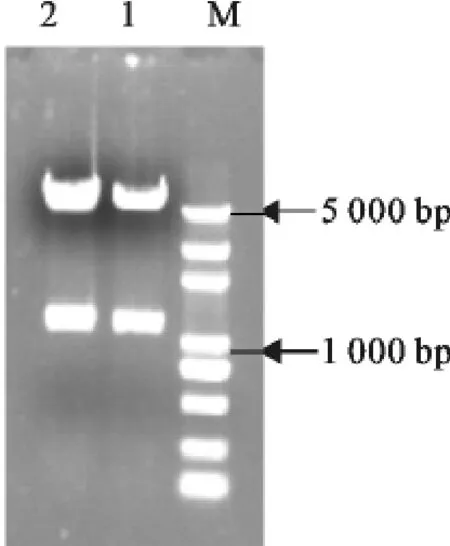
图2 重组表达质粒双酶切产物电泳图Fig.2 Electrophoresis of restriction enzyme digestion products of recombinant expression plasmid
2.2 α毒素蛋白的诱导表达与纯化结果
取不同IPTG浓度、不同诱导时间的样品进行SDS-PAGE电泳(图3),结果表明,IPTG浓度为0.1 mmol/L时诱导6h表达量最高;选取此条件下诱导的菌液超声裂解,上清及沉淀样品分别上样纯化,经SDS-PAGE电泳,考马斯亮蓝染色及脱色液脱色(图4),说明目标蛋白主要以包涵体的形式存在。
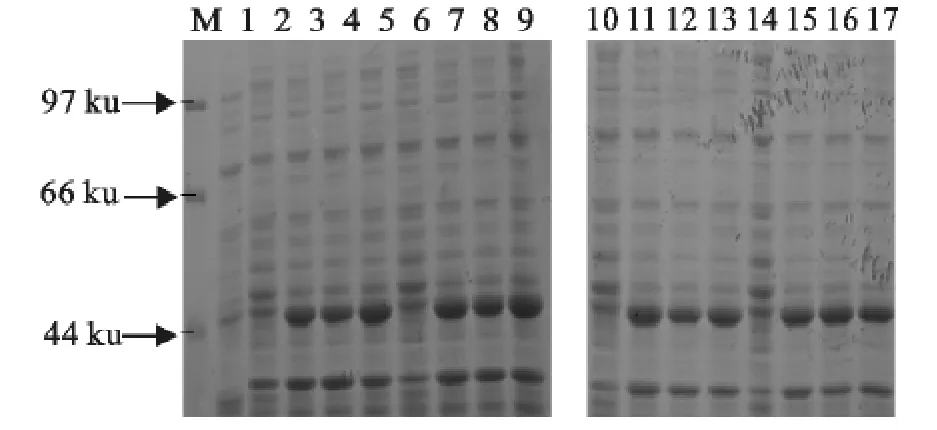
图3 不同IPTG浓度不同时间样品SDS-PAGE电泳图Fig.3 SDS-PAGE of samples with different IPTG concentrations and induction time
2.3 兔抗α毒素多克隆抗体ELISA结果
抗体经纯化后进行ELISA效价测定,结果表明,抗体效价达1∶512 000以上,说明表达的α毒素蛋白免疫原性强,免疫程序合理,符合免疫组化检测的要求。
2.4 患病小鼠病理组织学检查结果
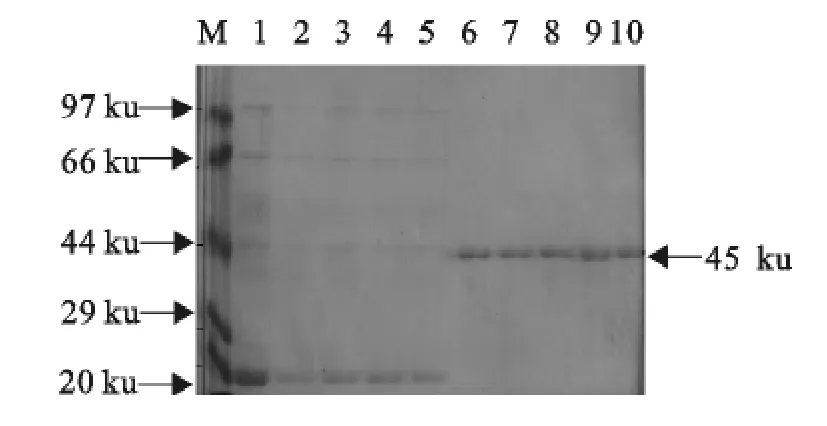
图4 Ni-NTA柱提纯后蛋白SDS-PAGE电泳Fig.4 SDS-PAGE electrophoresis figure of protein purified by Ni-NTA column
经最佳稀释度摸索实验后,最终确定一抗最佳稀释倍数为1∶300,HRP标记二抗稀释倍数为1∶200,FITC标记二抗稀释倍数为1∶100。A528产气荚膜梭菌外毒素致死小鼠的病理变化主要以出血性变化为主,天然孔出血,组织广泛性出血,胃黏膜出血、部分脱落,小肠出血、肠黏膜脱落。延髓脑膜充血、出血;肺严重的出血,肺泡破裂,肺泡壁增厚、间质增宽,间质内可见大量红细胞浸润,小动脉及肺泡壁毛细血管扩张充血;肾脏充血、肿胀,肾小管之间有散在的红细胞,肾小球毛细血管扩张充血,肾间质增生、出血;胃黏膜层部分脱落,胃壁变薄;小肠黏膜层脱落,黏膜层和黏膜下层出血;心脏肌纤维束间出血、充血;肝脏淤血、肿胀、可见有坏死灶;肝组织充血、血管扩张严重充血、肝细胞显著肿大;脾脏淤血、肿胀,红髓区显著充血、出血,脾小梁变性坏死(图5A~图5D)。阴性对照组则无上述病变(图5E~图5H)。
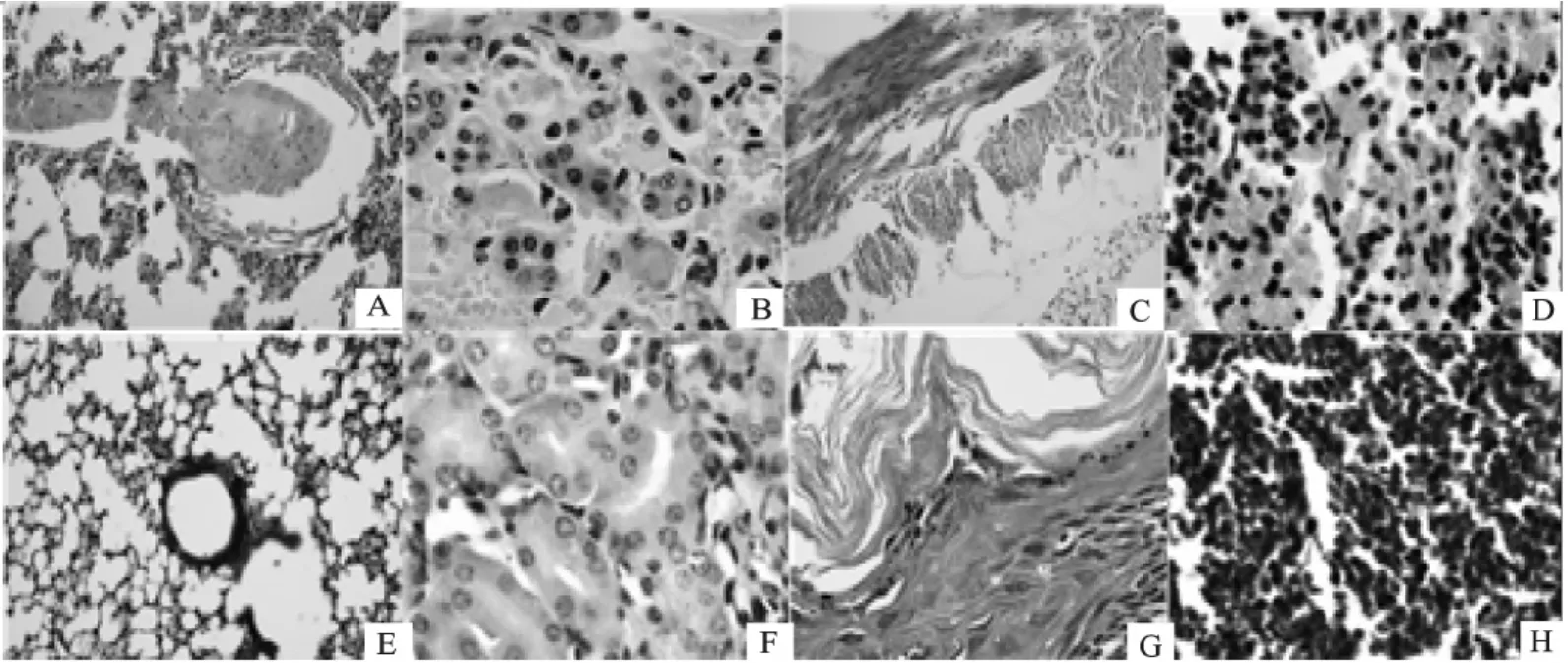
图5 部分组织病理切片图Fig.5 Histopathological section of Part organic
2.5 患病小鼠免疫组织化学检查结果
在延髓、胃肠黏膜、肾脏及肺泡上皮的主质细胞的胞浆中发现了阳性颗粒,在脾、心、肝的主质细胞中未发现毒素分布(图6A~图6C,图7A~图7C),阴性对照组则无阳性细胞(图6D~图6F,图7D~图7F)。
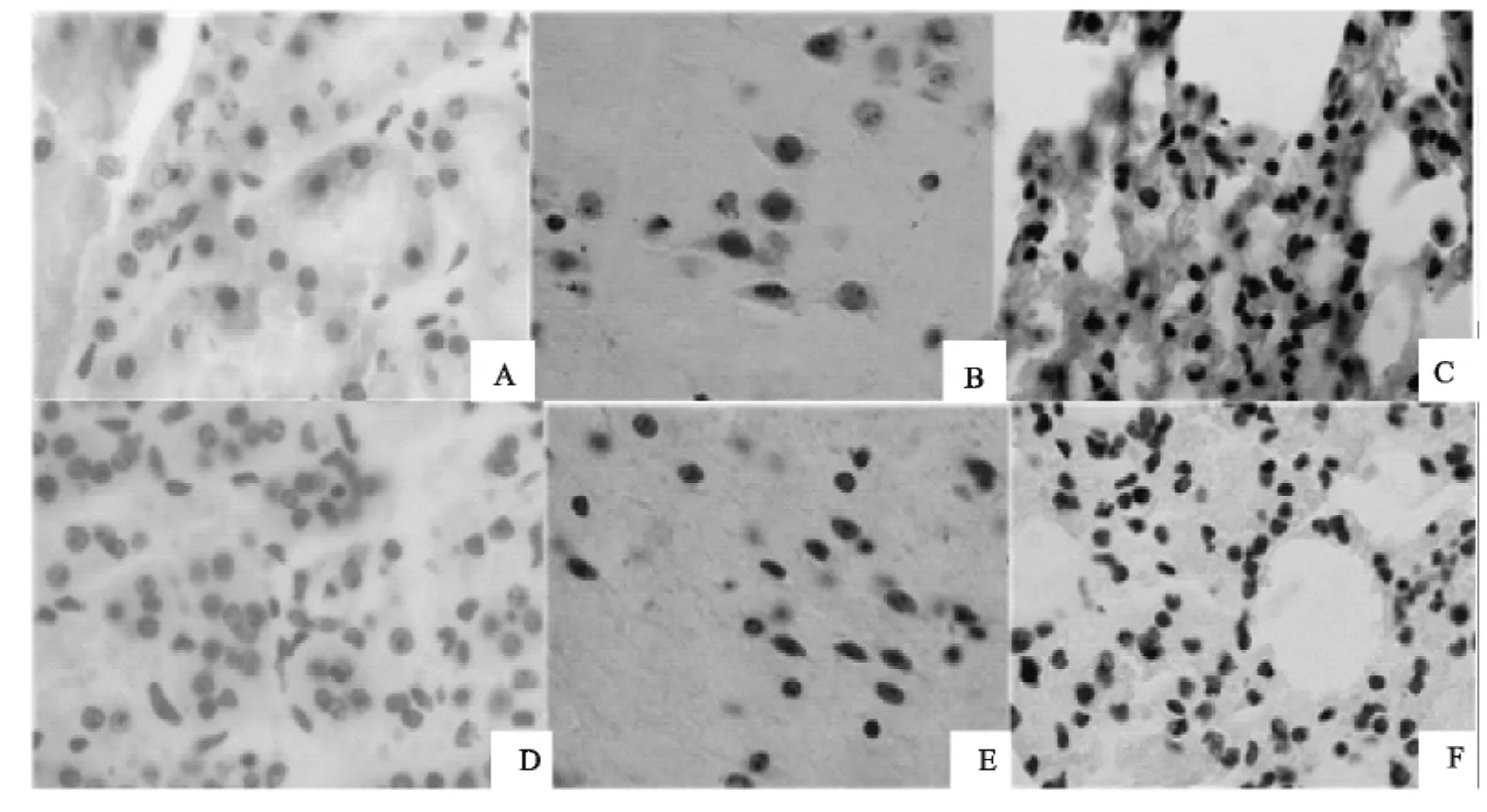
图6 部分组织HRP标记免疫组化结果图(1 000×)Fig.6 The resrults of immunohistochemistry marked with HRP of part organs(1 000×)
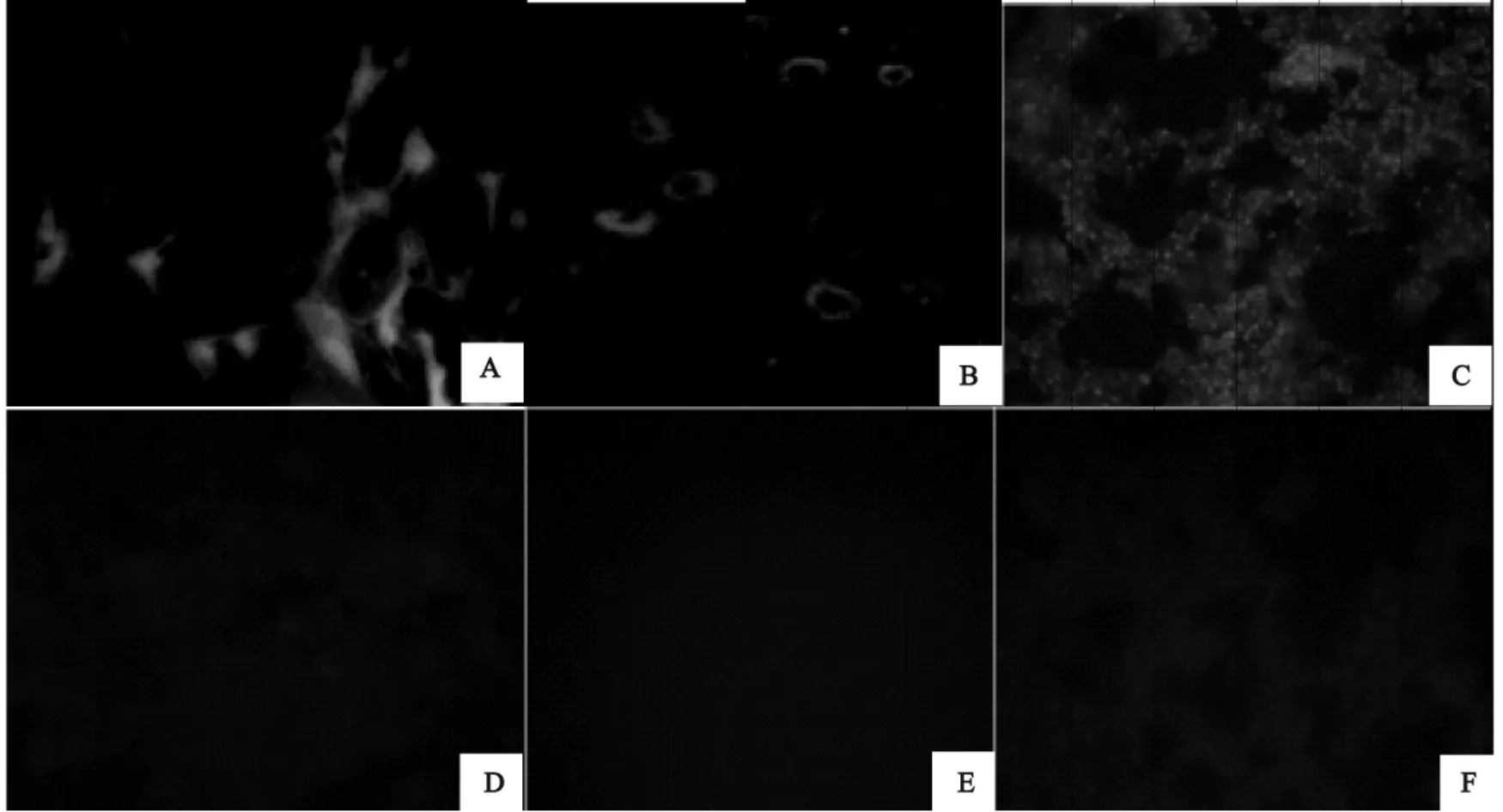
图7 部分组织FITC标记免疫组化结果图(1 000×)Fig.7 The resrults of immunohistochemistry marked with FITC of part organs(1 000×)
3 讨论
本试验利用自制高效价兔抗α毒素多克隆抗体对攻毒小鼠进行α毒素定位,结果表明,粗制外毒素攻毒死亡的小鼠呈全身出血性变化,胃黏膜和肠黏膜脱落、出血,肾、肝、脾、心脏、肺、脑、泄殖腔的充血、出血;经免疫组织化学检测后,发现毒素主要定位在肺、肾、胃、小肠、延髓间充质细胞的细胞质内,在肝、脾的间充质细胞内没有发现阳性颗粒。根据HE染色及免疫组化检测结果,推测A型产气荚膜梭菌ɑ毒素的致死的原因如下:细菌在动物体内大量繁殖,产生毒素,毒素随血液循环系统到达全身,因α毒素具有磷脂酶C和鞘磷脂酶的活性,破坏细胞膜结构的完整性[8-13],所以在攻毒致死小鼠的心、肝、脑、脾、肺、肾、小肠、胃等组织器官中发现出血、充血、坏死等病变,并在肺、肾、胃、小肠、延髓间充质细胞的细胞质内发现了免疫阳性颗粒。而进入肝脏门静脉的血液由于之前已流经脾脏,经过脾脏的吞噬作用后,进入肝脏的ɑ毒素量已经大量减少,又经肝脏自身的解毒作用,因此在肝脏的间充质细胞内没有发现ɑ毒素的存在。ɑ毒素突破了血脑屏障的防御作用,侵害延髓的神经元细胞质,影响心脏、肺的自主神经活动。控制动物心跳、呼吸的生理功能中枢正是位于延髓,因此,延髓一旦受到破坏,心、肺等器官不能正常工作,动物的生命就会发生危险。
本试验已证实,产气荚膜梭菌ɑ毒素能破坏肺、肾、胃、肠等间充质细胞的细胞膜进入细胞质内,损害脏器功能,但关键的因素很可能是ɑ毒素能突破血脑屏障,侵害延髓的生命中枢,破坏呼吸系统及心脏的传导系统,从而导致"猝死症"的发生。本试验对A型产气荚膜梭菌的ɑ毒素进行了定位,有关其他型产气荚膜梭菌的ɑ毒素及其他毒素在患病动物体内分布情况的研究也具有重要的意义,有待于进一步的研究。
[1] Sheedy S A,Ingham A B,Rood J I,et al.Highly conserved al-pha-toxin sequences of avian isolates ofClostridium perfringens[J].Clin Microbiol,2004,42:1345-1347.
[2] Schotte U,Truyen U,Neubauer H.Significance of beta-toxigenicClostridiumperfringensinfections in animals and their predisposing factors?a review[J].Vet Med B Infect Dis Vet Public Health,2004,51:423-426.
[3] Wages D P,Opengart K.Necrotic enteritis,Diseases of poultry[M].Iowa State University Press:Ames Iowa,2003:781-783.
[4] Parish W E.Necrotic enteritis in the fowl(Gallusgallus domesticus)I.Histopathology of the disease and isolation of a strain ofClostridiumwelchii[J].Comp Pathol,1961,71:377-393.
[5] Fach P,Guillou J P.Detection byinvitroamplification of the alpha-toxin (phospholipase C) gene fromClostridium perfringens[J].Appl Bacteriol,1993,74:61-66.
[6] 吴信法.兽医细菌学[M].北京:中国农业出版社,1996.
[7] 陈小云,关孚时,张存帅,等.产气荚膜梭菌主要外毒素最新研究进展[J].中国兽药杂志,2005,39(6):29-33.
[8] 吕存女,张敬友,赵 红,等.微量法测定产气荚膜梭菌毒素[J].兰州大学学报,2000,36(6):101-104.
[9] 赵宝华,杨 虹,顾为望.产气荚膜梭菌毒素研究进展[J].河北师范大学学报:自然科学版,2002,26(5):506-512.
[10] Merrill G A,Rivera V R,Neal D D,et al.Aquantitative electrochem ilum inescence assay forClotridiumperfringensalpha toxin[J].Anal Biochem,2006,357(2):181-187.
[11] Oda M,Kihara A,Yoshioka H,et al.Effect of erythro mycin on biological activities induced byClostridiumperfringensalpha toxin[J].J Pharmacol Exp Ther,2008,327(3):934-940.
[12] Carman R J,Sayeed S,Li J,et al.Clostridiumperfringenstoxin genotypes in the feces of healthy North Americans[J].Anaerobe,2008,14(2):102-108.
[13] Dittmar E,Beyer P,Fischer D,et al.Necrotizing en terocolitis of the neonate withClostridiumperfringens:diagnosis,clinical course,and role of alpha toxin[J].Eur J Pediatr,2008,167(8):891-895.
Distribution and Localization of Aalpha Toxin in Mice Infected WithClostridiumperfringensType A
WANG Miao-li,CAI Yu-mei,CHAI Tong-jie,ZHANG Hong-na
(CollegeofAnimalScienceandTechnology,ShandongAgriculturalUniversity,Tai'an,Shandong,271017,China)
In order to test the distribution of alpha-toxin in animals infected byClostridiumperfringenstype A,the high titer rabbit anti-alpha-toxin polyclonal antibodies prepared as primary antibodies and HRP or FITC conjugated secondary antibodies were used to detect the alpha-toxin by immunohistochemistry method.Results showed that positive particles were located in the main qualitative cell plasma of medulla,intestine,kidney,lungs and stomach except liver and spleen.The result indicated that the alpha-toxin was firstly found in cell plasma of medulla which broke through the blood brain barrier to damage the vital center.It may be an important reason why the alpha-toxin could cause animal death.
Clostridiumperfringens;α-toxin;protein expression;immunohistochemistry
S852.616.3
A
1007-5038(2011)10-00019-05
2011-04-12
山东农业大学青年科技创新基金(23655);中国国际合作项目“动物疫源性人畜共患病的监测”(2009DFA32890)
王苗利(1987-),女,山东泰安人,硕士研究生,主要从事产气荚膜梭菌致病性的研究。

