猪圆环病毒2型不同地区毒株的分离鉴定及基因型分析*
王贵华,陈义锋,刘明明,陈翠云,赵亚荣
(北京大北农动物医学研究中心,北京 100097)
由猪圆环病毒2型(Porcine circovirus type 2,PCV-2)引起的断奶仔猪多系统衰竭综合征(Postweaning multisystemic wasting syndrome,PMWS)自20世纪90年代初被鉴定以来,该病已给世界养猪业造成了严重危害。研究表明,PCV-2感染除了造成PMWS,同时还与猪呼吸道综合症(Porcine respiratory disease complex,PRDC)、猪皮炎和肾病综合 征 (porcine dermatitis and nephropathy syndrome,PNDS)、先天性震颤、繁殖障碍、胎儿心肌炎和扩张性坏死性肺炎等猪圆环病毒病(Porcine circovirus associated-disease,PCVAD)密切相关[1],已成为影响世界养猪业的最重要的病毒性传染病。
流行病学调查[2-3]表明,当前我国猪场的 PCV-2感染已相当普遍,由PCV-2感染引起的PCVAD已经给我国养猪业造成了巨大的经济损失,而且PCV-2基因组在不断地发生变异,PCV-2b基因型已取代PCV-2a成为当前的优垫基因型毒株[4],新毒株或新基因型仍在不断出现[5]。为了解当前国内感染猪群中PCV-2的基因变异情况,并为PCV-2的分子流行病学、感染及预防控制提供参考,本研究对来自山东、山西、北京和河北的PCV-2PCR检测核酸阳性的病料进行PCV-2分离鉴定。
1 材料与方法
1.1 材料
1.1.1 组织病料 采自山东、山西、北京和河北的具有PMWS症状和剖检病变的自然病例的淋巴结(气管支气管淋巴结、肠系膜淋巴结、腹股沟淋巴结)、肺脏、脾脏和扁桃体等组织,置于-80℃冰箱中保存备用。
1.1.2 细胞和血清 PK-15A细胞由北京大北农动物医学研究中心实验室保存;感受态JM109细胞为北京索来宝公司产品;胎牛血清为Gibco公司产品;PCV-2阳性血清由周继勇教授惠赠。
1.1.3 试剂 EX-Taq DNA聚合酶(含10×buffer,dNTPs)为宝生物工程(大连)有限公司产品;DNA Marker DL 2 000为北京博迈德公司产品;PCV-1和PCV-2PCR检测试剂盒为中国动物卫生与流行病学中心产品;FITC标记羊抗猪IgG为Lifeholder公司产品;MEM、EDTA、胰酶(1/250)为Gibco公司产品;D-Glucosmine-HCl,为Sigma公司产品,pMD-18TSimple载体和DNA Ligase为宝生物工程(大连)有限公司产品;细菌质粒DNA抽提试剂盒、DNA凝胶回收试剂盒和血液、组织细胞DNA抽提试剂盒均为北京天根生化科技有限公司产品。
1.2 方法
1.2.1 PCR检测 按照猪圆环病毒聚合酶链反应试剂盒说明书进行检测,即同时用三条引物P1(5′-CCGCGGGCTGGCTGAACTT-3′)、P2(5′-CTCGGCTATGCGCTCCAAAATG-3′)和 P3 (5′-ACCCCCGCCACCGCTACC-3′)分别对病料中 PCV-1(P1和P2扩增产物为652bp)和PCV-2(P1和P3扩增产物为1 154bp)进行检测。反应条件为:94℃预变性5min;94℃30s,62℃45s,72℃45s,35个循环;最后72℃延伸10min。
1.2.2 病毒分离 取PCR检测PCV-2阳性的病料,经处理后按50mL/L的比例接种60%~70%融合的PCV阴性的PK-15A细胞,置37℃,体积分数为5%的CO2培养箱中吸附30min,加入含20 mL/L新生牛血清和3mmol/L的D-氨基葡萄糖盐酸的MEM细胞维持液,37℃继续培养48h,连续盲传3代。观察是否有病变产生,并将第3代细胞置-15℃/室温反复冻融3次,3 000r/min离心20 min,取上清进行PCR(同1.2.1法)和IFA鉴定。
1.2.3 特异性鉴定(用IFA法) 将已长成单层的PK-15A细胞(24孔板)倒去生长液,以50mL/L的比例接入各分离株的盲传细胞培养物并设重复孔4孔,同时设阴阳性对照。置37℃,体积分数为5%的CO2培养箱中继续培养24h,换含3mmol/L的D-氨基葡萄糖盐酸的MEM维持液,继续培养24h。弃去维持液,用0.01mol/L pH 7.4PBS洗涤3次,冷丙酮固定细胞,50μL/孔,4℃30min,弃丙酮,室温下干燥,用0.01mol/L pH7.4PBS洗涤1次,加入1∶100稀释的PCV-2抗体,50μL/孔,37℃1h;移去孔内液体,用0.01mol/L pH7.4PBS洗涤5次,每次3min;加入1:20稀释的FITC标记的羊抗猪二抗,50μL/孔,37℃1h;移去孔内液体,用0.01 mol/L pH7.4PBS洗涤5次,每次3min,在荧光显微镜下观察结果。
1.2.4 全基因组克隆和测序 参考文献[6]合成了两 对 引 物 P1:5′-CGAATTCAACCTTA ACCTTTCTTATTC -3 和 P2:5′-ATGAATTCTGGCCCTGCTCCC-3′,扩增条件为:95℃变性5min;94℃45s,54℃45s,72℃1min;共进行35个循环;最后72℃延伸10min,PCR产物凝胶回收,连接至pMD-18TSimple载体,转化至JM109细胞,摇菌扩增,并将鉴定为阳性的重组质粒送检测序。并用MEGA5的Neighbor-Joining法绘制系统进化树。PCR检测结果表明,5个分离株均可扩增出1 154bp片段,与PCV-2阳性对照一致,均未检测到与PCV-1阳性对照一致大小(652bp)的特异性片段。
2 结果
2.1 PCR检测结果
PCV-2各 分 离 株 DBN-SD02、DBN-SX07、DBNBJ08、DBN-HB12和DBN-HB13PCR检验结果见图1。

图1 病料中PCV-2的PCR检测结果Fig.1 PCR detection result of PCV-2in samples
2.2 特异性鉴定结果
PCV-2各分离株DBN-SD02、DBN-SX07、DBNBJ08、DBN-HB12和 DBN-HB13株感染PK15A 细胞后,感染细胞均可与PCV-2阳性血清特异性结合,并被FITC标记的羊抗猪二抗结合,荧光显微镜下见到感染细胞的细胞浆内和胞核内均有大量绿色荧光物质着染,而健康细胞对照孔则未见到特异性荧光(图2)。表明PCV-2各分离株均可被PCV-2阳性血清特异性识别。
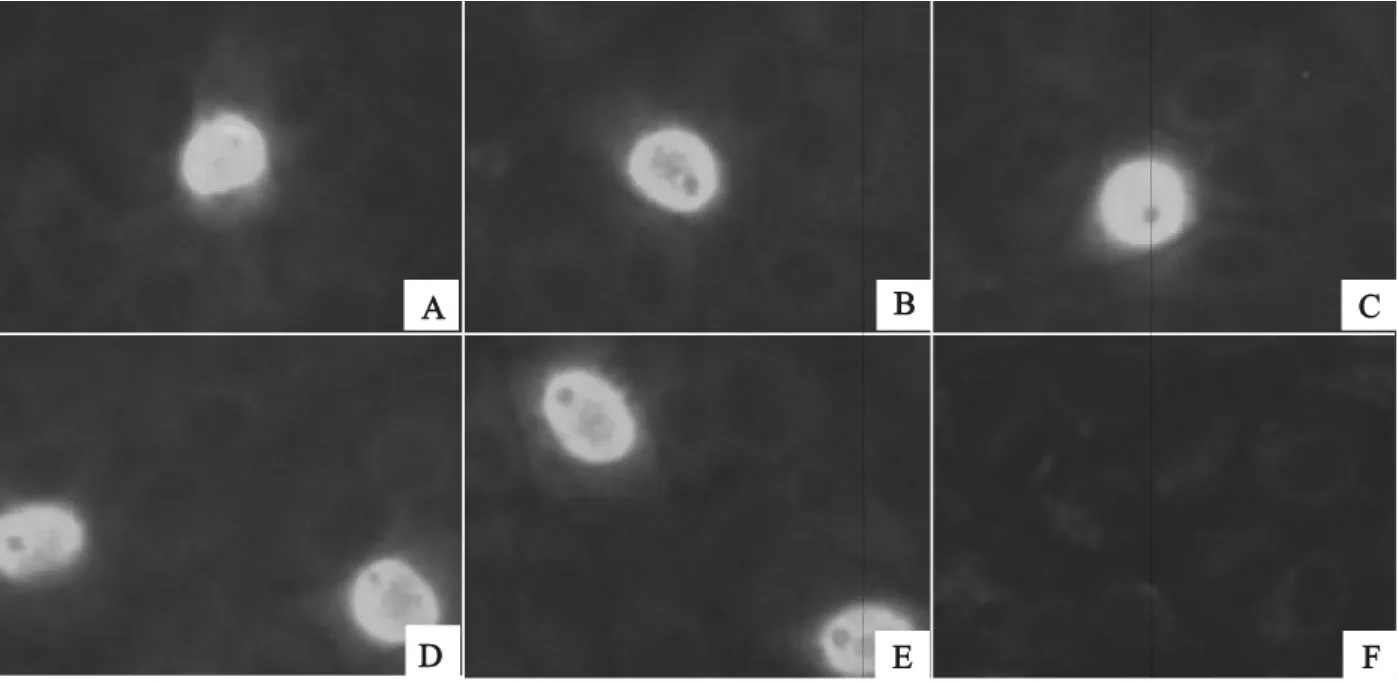
图2 PCV-2各分离株特异性鉴定结果(200×)Fig.2 Specificity identification of PCV-2isolates by IFA (200×)
2.3基因组克隆及测序
用全基因组序列扩增引物分别对PCV-2DBNSD02、DBN-SX07、DBN-BJ08、DBN-HB12和 DBNHB13株的基因组进行PCR扩增(图3)。
全基因组PCR产物分别经切胶回收,连接至T载体,送博迈德测序,测序结果提交GenBank,登录号分别为FJ660967、FJ660968、FJ660969、FJ660970和FJ660971。
2.4 同源性比对和系统进化分析
利用MEGA5的Neighbor-Joining法将所分离5株PCV-2(带下划线)的ORF2和全基因组序列分别与PCV-2aPCV-2bPCV-2c基因型参考毒株进行比对和系统进化分析,大于50% 的Bootstrap Test(1 000replicates)的Bootstrap值显示在邻支之间,结果见图4。
图4上为依据ORF2推导氨基酸序列比对结果绘制的系统进化树;图4下为依据全基因组核苷酸序列比对结果绘制的系统根据进化树。由图可知,两种方法所绘制的系统进化树均表明所分离的5株PCV-2(下划线)中有4株(DBN-HB12、DBN-SD02、DBN-SX07和DBN-HB13)属于PCV-2b基因型,仅DBN-BJ 08株为PCV-2a基因型。
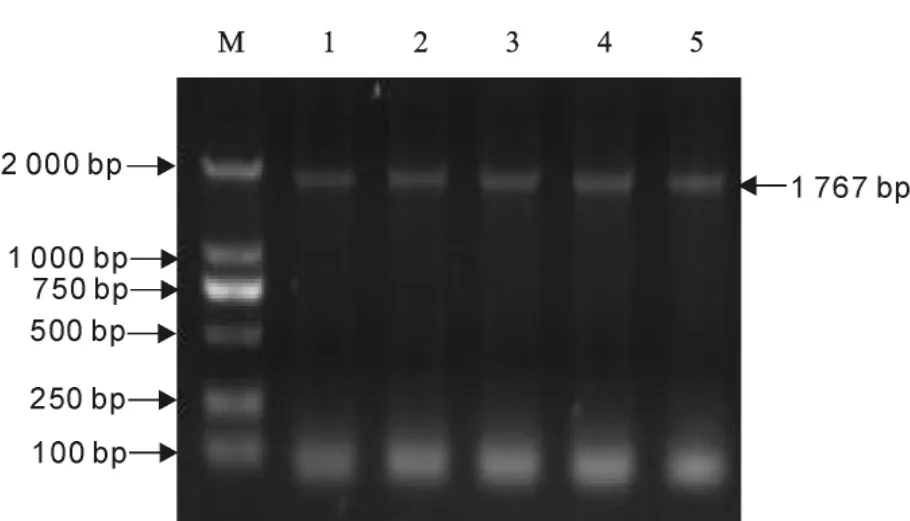
图3 PCV-2各分离毒株全基因扩增结果Fig.3 The genome amplification results of PCV-2isolates
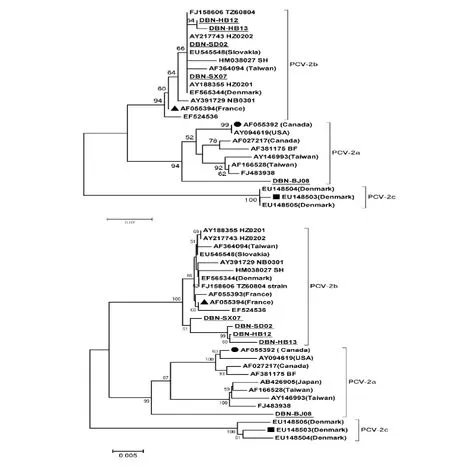
图4 系统进化树分析Fig.4 Phylogenetic tree analysis
3 讨论
关于PCV-2两种基因型的命名,不同的研究组织常使用不同的命名,如“A”和“B”、“SG1”和“SG2”、“1”和“2”、“b”和“a”,以及根据限制性多态性片段(RFLP)模式分成的“321”和“422”等,面对这种局面,Grau-Roma L等[8]提出了一种客观精确命名PCV-2基因型的方法,该方法根据序列间遗传距离(p-distance)不同进行分类,遗传距离的计算方法是用差异的核苷酸位点数除以总位点数[9],通过构建遗传距离直方图,确定不同基因型间的最低检测值。通过这项技术,已经有3种基因型的PCV-2病毒被鉴定出来,分别为 PCV-2a、PCV-2b、PCV-2c。并且分别将GenBank中最早的报道的原型毒株AF055392和 AF055394分别作为PCV-2a和PCV-2b参考株,将20世纪80年代只有在丹麦发现的PCV-2EU148503作为PCV-2c的参考株。有证据显示,在1997年-2003年之间,不论是否存在PMWS疾病,猪场当中都是PCV-2a基因型病毒占主导地位,而从2004年PMWS暴发之后,PCV-2b毒株则变得越来越普遍。PCV-2c型病毒只有20世纪80年代在丹麦发现过,那时PMWS尚未出现,或者至少尚未被发现[10]。
本研究从疑似PMWS病例中分离鉴定了5个PCV-2毒株,并且对其全基因组进行了克隆和测序,分别以推导ORF2氨基酸序列和全基因组核苷酸序列与参考株进行了系统进化分析,结果均显示有4株为PCV-2b亚型,1株为PCV-2a亚型,表明基于PCV-2全基因组序列或ORF2序列对其基因型进行鉴定所获得的结果是一致的,这与Olvera A等[11]的研究结果一致,同时也表明PCV-2b基因型是我国当前PCV-2的主要流行血清型。
[1]Chae C.A review of porcine circovirus 2-associated syndromes and diseases[J].Vet J,2005,169(3):326-336.
[2]周继勇,陈庆新,叶菊秀,等.猪圆环病毒2型感染的血清学分析[J].中国兽医学报,2004,24(1):1-3.
[3]王忠田,杨汉春,郭 鑫.规模化猪场猪圆环病毒2型感染的流行病学调查[J].中国兽医杂志,2002,38(10):3-6.
[4]Guo LJ,Lu YH,Wei YW,et al.Porcine circovirus type 2(PCV-2):genetic variation and newly emerging genotypes in China[J].Virol J,2010,7:273.
[5]郭抗抗,张彦明,张 红,等.猪圆环病毒2型分离株优势基因型分析与检测[J].中国预防兽医学报,2010,32(10):808-811.
[6]冯志新,范伟兴,李晓成,等.PMWS病猪猪圆环病毒2型全基因组序列分析[J].中国病毒学,2004,19(5):454-457.
[7]李文洁,李文涛,严伟东,等.中国部分地区猪圆环病毒2型的基因型分析[J].畜牧兽医学报,2009,40(9):1358-1362.
[8]Grau-RomalL,Criscie E,SibIla M,et al.A proposal on porcine circovirus type 2 (PCV-2)genotype definition and their relation with postweaning multisystemic wasting syndrome(PMWS)occurrence[J].Vet Microbiol,2008,128:23-35.
[9]Kumar S,Tamura K,Jakobseni B,et al.MEGA2:molecular evolutionary genetics analysis software[J].Bioinformatics,2001,17:1244-1245.
[10]Segalés J,Olvera A,Grau-Roma L,et al.PCV-2genotype definition and nomenclature[J].Vet Rec,2008,162:867-868.
[11]Olvera A,Cortey M,Segalés J.Molecular evolution of porcine circovirus type 2genomes:phylogeny and clonality[J].Virology,2007,357:175-185.

