H5N1亚型高致病性禽流感病毒对鸽的致病性分析
乔立旺,焦培荣,张东霞,李 芳,胡自立,刘海玲,辛朝安,廖 明,罗开健
(华南农业大学兽医学院 农业部动物疫病防控重点开放实验室,广东省动物源性人兽共患病预防与控制重点实验室,广东广州510642)
H5N1亚型高致病性禽流感病毒对鸽的致病性分析
乔立旺,焦培荣△,张东霞,李 芳,胡自立,刘海玲,辛朝安,廖 明,罗开健*
(华南农业大学兽医学院 农业部动物疫病防控重点开放实验室,广东省动物源性人兽共患病预防与控制重点实验室,广东广州510642)
为评估H5N1亚型禽流感病毒对鸽的致病性,用我国2004年分离的一株H5N1亚型禽流感病毒A/pigeon/GD/C2/2004(H5N1)人工感染4周龄鸽,进行了致病性试验。结果表明,该株病毒以106EID50/100μL剂量感染能致死鸽,致死率为22.2%,病毒能在感染鸽体内广泛分布,其中肺脏和肾脏中病毒含量达到104.50EID50/mL,表明该株病毒对鸽具有感染性,且感染鸽未通过喉头和泄殖腔向外排毒。
禽流感病毒;H5N1;鸽;感染
*通讯作者
禽流感(Avian influenza,AI)是由A型流感病毒引起的一种禽类的感染/疾病综合征。该病被世界动物卫生组织(OIE)规定为必须报告的动物传染病,我国将其列为一类动物疫病[1]。H5N1亚型高致病性禽流感病毒(Avian influenza virus,AIV)可引起多种禽类感染,给养禽业造成重大经济损失。多种野鸟、家禽(特别是鸡和火鸡)及野生动物都可感染H5N1亚型高致病性AIV[2-4]。由于野鸟和野生水禽的存在,H5N1亚型AIV可被带到世界各地,给公共卫生造成巨大危害[5]。2002年,香港首次报道在野生鸽体内分离到H5N1亚型AIV[6],但鸽对H5N1亚型AIV的易感性以及其在禽流感病毒传播中所起的作用尚未明确。在以往的研究中,不少学者报道鸽对AIV仅有极弱的敏感性或对其具有耐受力[7-10]。然而,最近的研究表明,近年分离到的H5N1亚型AIV可引起鸽的感染发病,且病毒能在鸽体内复制[11]。
2004年华南农业大学兽医学院禽病研究室从广东某养鸽场发病鸽体内分离到一株H5N1亚型AIV,为了检测该毒株对鸽的致病性,以点眼滴鼻的途径人工感染实验鸽,通过对其在鸽体内脏器中的复制情况以及血清转化的分析,研究其对鸽的致病性。
1 材料与方法
1.1 实验室条件
本研究中有关活毒的操作均在3级生物安全(P3)实验室内进行,动物实验在P3实验室的负压隔离器中进行。
1.2 材料
H5N1 亚 型 禽 流 感 病 毒 A/pigeon/GD/C2/2004(H5N1)由华南农业大学兽医学院禽病研究室分离、鉴定和保存。4周龄未免疫鸽购自江门市翔胜鸽业有限公司,试验前用HI试验检验证明无抗H5N1亚型AIV、H9N2亚型AIV和新城疫病毒HI抗体。
1.3 方法
1.3.1 病毒复壮 将 H5N1亚型AIV以1 000倍稀释,按每枚胚0.1mL的剂量经尿囊腔接种9日龄~11日龄SPF鸡胚,置于37℃孵育。将24h~48h内死亡或存活的鸡胚置4℃保存12h后,无菌收获鸡胚绒毛尿囊液,分装,于-70℃保存备用。
1.3.2 鸡胚半数感染量(EID50)的测定 取病毒尿囊液用灭菌PBS做10倍系列稀释,将105~1010每稀释度按每胚0.1mL剂量接种5枚鸡胚,37℃孵育,将24h~48h内死亡的鸡胚置于4℃冰箱保存,37℃孵化48h后测所有死亡和未死胚尿囊液的血凝活性,以判断其是否感染。按Reed-Muench法计算EID50[12]。
1.3.3 鸽感染试验 12只4周龄鸽,9只经点眼滴鼻途径接种106EID50/100μL的含病毒尿囊液,每只100μL,于负压隔离器中隔离饲养观察。3只不感染,但与接种病毒的鸽同隔离器、同条件饲养作为同居对照。感染后14d内,每天观察并记录试验鸽的发病和死亡情况。
1.3.4 病毒在鸽体内的复制和排泄试验 在试验鸽接种病毒后第1、3、5、7天,无菌条件下分别采集喉头拭子和泄殖腔拭子,置于1mL含有双抗的PBS中。离心取上清,接种9日龄~11日龄鸡胚,孵育24h~48h收集尿囊液通过血凝试验检测其血凝活性。血凝试验以常规方法在96孔板上进行,具体操作程序按照世界动物卫生组织(OIE)的标准[12]进行。试验鸽接种病毒后第3天和第5天,各处死3只试验鸽,分别采集脑、心脏、肝脏、脾脏、肺、肾、胰、盲肠、气管和法氏囊等组织,各称取1g放入灭菌研磨器中,加入含青霉素和链霉素的PBS液,制成组织匀浆。转入灭菌离心管中,离心取上清液做10倍系列稀释,每个稀释度接种3枚9日龄~11日龄鸡胚,接种剂量每枚胚0.1mL,孵育24h~48 h,收集尿囊液检测其血凝活性,并计算病毒含量。
1.3.5 感染鸽的血清转化检测 于接种病毒后第3天、第5天、第7天和第14天分别采集感染鸽血液,每只0.5mL(死亡鸽在濒死时采集血液),分离血清后用 A/pigeon/GD/C2/2004(H5N1)为抗原通过血凝抑制试验检测其HI抗体。HI试验在96孔板上进行,根据抗原效价计算4单位抗原量,4单位抗原的配制在冰上操作,具体操作程序按照世界动物卫生组织(OIE)的方法进行[12]。
1.3.6 同居鸽的感染发病记录及血清转化检测
每天观察并记录3只同居鸽的发病情况,并于感染鸽接种病毒后第14天采集同居鸽血液,每只0.5 mL,分离血清后用 A/pigeon/GD/C2/2004(H5N1)为抗原检测其HI抗体。
2 结果
2.1 感染鸽病死率和发病症状
在14d的感染期内,9只试验感染鸽中有2只发病死亡,病死率为22.2%,死亡时间分别为感染后第4天和第11天。感染的9只试验鸽均有较明显的临床症状,表现为羽毛逆立,精神萎靡,多数鸽在72h内自愈。感染较重的试验鸽可见食欲废绝,站立不稳,精神极度沉郁,头颈歪曲。随着病情加重,神经症状愈加明显,病鸽呈角弓反张,头颈震颤,不断呈转圈运动。
感染鸽的病理变化:感染后第3天和第5天处死的6只鸽均可见肠道出现明显的出血坏死,内容物腐败有恶臭味;感染后第3天的1只鸽的肝组织出现黄白色的条状坏死灶。第4天和第11天发病死亡的2只鸽还可观察到脑膜出血,脑组织液化坏死。
2.2 病毒在鸽体内的复制和排毒测定
第3天处死的3只鸽中,其中1只鸽除胰腺和肠道未分离到病毒外,在脑、气管、心脏、肝脏、脾脏、肺、肾和法氏囊中均能分离到H5N1亚型AIV,其中气管的病毒含量达到103.50EID50/mL。其他2只以及第5天处死的3只鸽子体内未检测到病毒存在。在感染后第4天发病死亡的1只鸽体内,从所采集的气管、心脏、肝脏、肺、肾、胰和肠道中均可分离到H5N1亚型AIV,其中肺和肾的病毒含量达到104.50EID50/mL;感染后第11天死亡的1只鸽体内,从所采集的脑、气管、心脏、脾脏、肺和肾中分离到H5N1亚型 AIV,其中肺脏病毒含量达到104.25EID50/mL(表1)。本试验未从感染鸽所有拭子中分离到病毒。
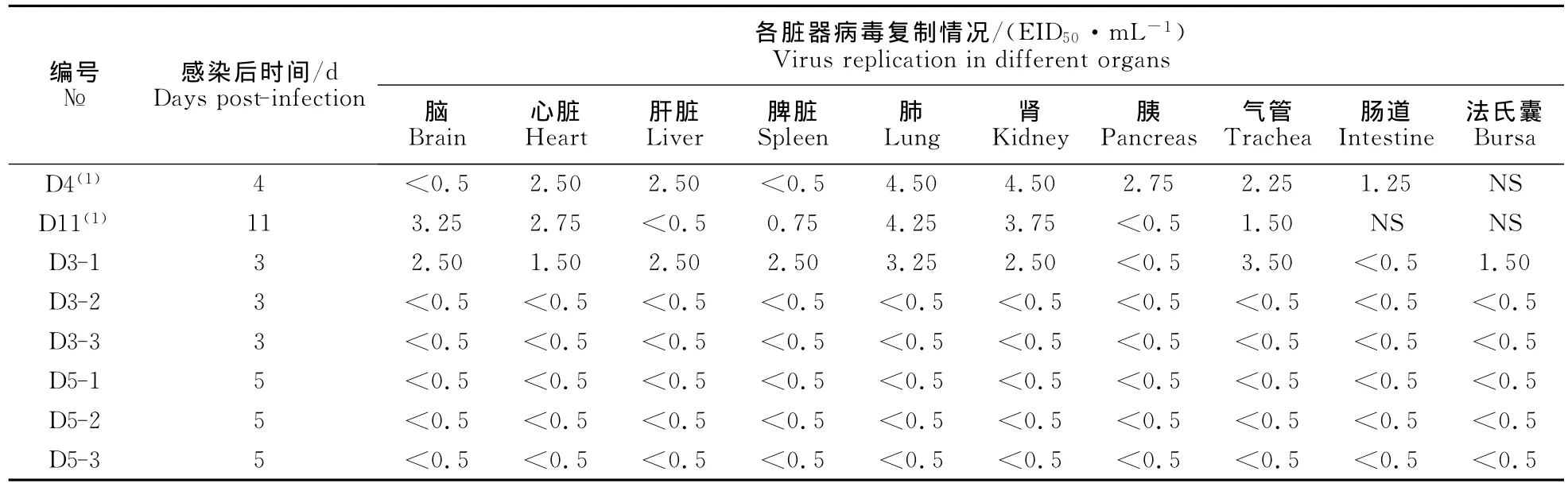
表1 病毒感染鸽后在鸽体内脏器的复制情况Table1 Replication of the H5N1virus in orgens of pigeons
2.3 感染鸽的血清转化结果
在第3天、第5天和第7天,感染鸽的血清样品以及第4天死亡的鸽血清样品中未发现血清阳转,第14天的1份血清样品及第11天死亡的1只鸽的血清样品,可检测到血清呈H5亚型HI抗体阳性,HI效价均为3log2(表2)。
2.4 同居鸽的感染情况及血清转化结果
在14d的感染期内,3只同居鸽均表现正常。采集的喉头和泄殖腔拭子中,均未分离到H5N1亚型AIV。试验第14天,3只同居鸽的血清样品用A/pigeon/GD/C2/2004(H5N1)为抗原进行 HI检测,也均未发现血清H5阳性转化。
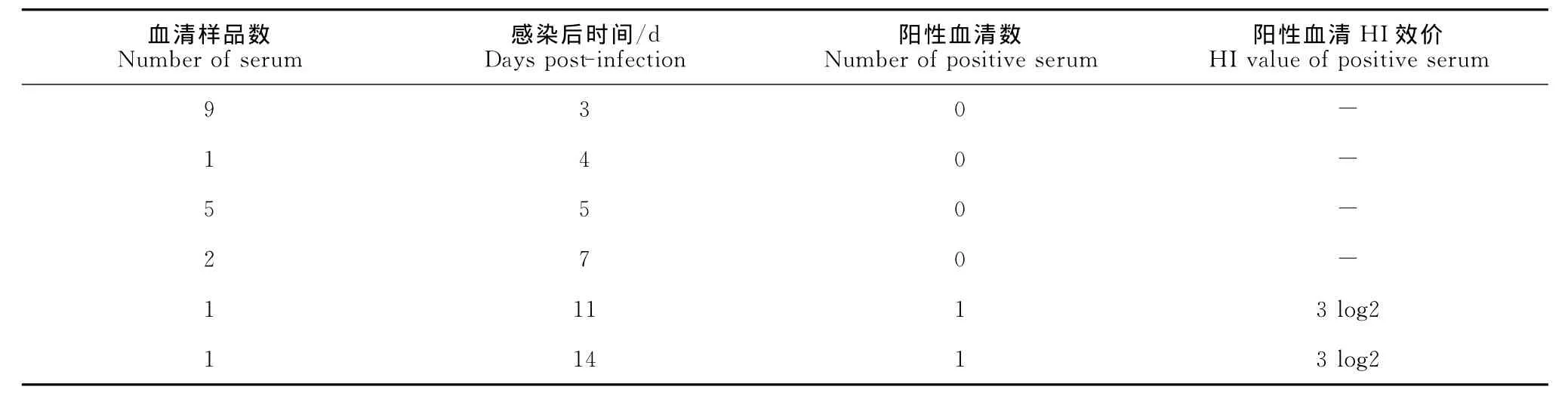
表2 感染鸽血清转化情况Table 2 Seroconversion of infected pigeons
3 讨论
以往的研究中,不少学者报道鸽对H5N1亚型AIV仅有极弱的易感性或对其具有耐受力,这种观点主要基于感染高致病性AIV或低致病性AIV后的鸽不表现明显的临床症状,病毒不能在鸽体内有效地复制,也 不 能 引 起 感 染 鸽 的 血 清 转 化[7-8,14,16]。我们的试验发现,人工感染所用的H5N1亚型AIV引起试验鸽表现出较明显的临床症状。从致病性试验结果来看,鸽感染病毒后的第3天可在部分鸽体内进行有效地复制;从感染鸽的喉头和泄殖腔拭子中未能分离到病毒,感染后的第11天、第14天,2只感染鸽血清中检测为H5亚型AIV抗体阳性,表明本试验所用的 A/pigeon/GD/C2/2004(H5N1)对试验鸽有一定致病性。同居试验鸽的脏器中不能分离到病毒,14d内的血清中也未检测到H5亚型AIV HI抗体,这说明鸽可能不具备水平传播H5N1亚型AIV的能力。
Liu Y H等[14]利用2004年-2006年分离到的不同宿主来源的H5N1亚型AIV以较低剂量(5×104EID50)感染鸽,试验鸽不表现临床症状,也检测不到病毒复制。Werner O 等[15]用高剂 量 (108.1EID50)的 A/chicken/Indonesia/2003(H5N1)感染成年试验鸽,感染鸽表现明显的神经症状,病毒可在部分感染鸽的脑、气管、肺、心脏、脾、肾、腺胃和小肠复制。这说明,H5N1亚型AIV对鸽的致病能力可能受鸽的个体差异、感染剂量、攻毒方式以及外界环境等因素的影响。
Perkins L E等[16]的报道中认为,野生鸽对A/chicken/Hong Kong/220/97(H5N1)毒株不敏感。Yu Z J等[17]研究认为,家鸽对2004年分离到的H5N1亚型AIV具有感染性,并能从鸽组织,特别是腺胃中分离到病毒。贾贝贝[11]研究发现,鸽对近年分离到的不同源性的H5N1亚型AIV具有敏感性。这些研究说明,不同H5N1亚型AIV毒株对鸽的致病能力不同。通过分析这些病毒的基因序列,利用反向遗传技术等分子生物学手段,可望从分子水平上揭示不同H5N1亚型AIV对鸽致病性差异的原因。
[1] 万秀峰,辛朝安.禽流感的预防与控制[J].养禽与禽病防治,1998(6):526.
[2] Perkins L E,Swayne D E.Susceptibility of laughing gulls(Larusatricilla)to H5N1and H5N3highly pathogenic avian influenza viruses[J].Avian Dis,2002,46:877-885.
[3] Keawcharoen J,Oraveerakul K,Kuiken T,et al.Avian influenza H5N1in tigers and leopards[J].Emerging Infect Dis,2004,10(12):2189-2191.
[4] Liu J,Xiao H,Lei F,et al.Highly pathogenic H5N1influenza virus infection in migratory birds[J].Science,2005,309:1206.
[5] 郑旭灿,焦培荣,单 芬,等.一株天鹅源H5N1亚型禽流感病毒的分离鉴定[J].动物医学进展,2010,31(5):5-8.
[6] Ellis T M,Bousfield R B,Bissett L A,et al.Investigation of outbreaks of highly pathogenic H5N1avian influenza in waterfowl and wild birds in Hong Kong in late 2002[J].Avian Pathol,2004,33(5):492-505.
[7] Panigrahy B,Senne D A,Pedersen J C,et al.Susceptibility of pigeons to avian influenza[J].Avian Dis,1998,40(3):600-604.
[8] Kaleta E F,HÖnicke A.Review of the literature on avian influenza A viruses in pigeons and experimental studies on the susceptibility of domestic pigeons to influenza A viruses of the haemagglutinin subtype H7[J].Dtsch Tierarztl Wochenschr,2004,111(12):467-472.
[9] Lillehaug A,Monceyron Jonassen C,Bergsjo B,et al.Screening of feral pigeon (Colombalivia), mallard (Anas platyrhynchos)and graylag goose(Anseranser)populations forCampylobacterspp.,Salmonella spp.,avian influenza virus and avian paramyxovirus[J].Acta Veterinaria Scandinavica,2005,46:193-202.
[10] Fang T H,Lien Y Y,Cheng M C,et al.Resistance of immunesuppressed pigeons to subtypes H5N2and H6N1low pathogenic avian influenza virus[J].Avian Dis,2006,50:269-272.
[11] Jia B B.Pathogenicity of Chinese H5N1highly pathogenic avian influenza viruses in pigeons[J].Arch Virol,2008,153:1821-1826.
[12] 殷 震,刘景华.动物病毒学[M].北京:科学出版社,1997.
[13] Vallat B,Allen G P.Manual of diagnostic test s and vaccines for terrestrial animals(mammals,birds and bees)[M].Paris France:World Organisation for Animal Health(OIE),2004:261-263.
[14] Liu Y H,Zhou J,Yang H C,et al.Susceptibility and transmissibility of pigeons to Asian lineage highly pathogenic avian influenza virus subtype H5N1[J].Avian Pathol,2007,36(6):461-465.
[15] Werner O,Starick E,Teifke J,et al.Minute excretion of highly pathogenic avian influenza virus A/chicken/Indonesia/2003(H5N1)from experimentally infected domestic pigeons(Columbialivia)and lack of transmission to sentinel chickens[J].J Gene Virol,2007,88:3089-3093.
[16] Perkins L E,Swayne D E.Pathogenicity of a Hong Kong-origin H5N1highly pathogenic avian influenza virus for emus,geese,ducks,and pigeons[J].Avian Dis,2002,46(1):53-63.
[17] Yu Z J,Song Y F,Zhou H B,et al.Avian influenza(H5N1)virus in waterfowl and chickens,central China[J].Emerging Infect Dis,2007,13(5):772-775.
Pathogenicity of H5N1 Highly Pathogenic Avian Influenza Virus in Pigeons
QIAO Li-wang,JIAO Pei-rong,ZHANG Dong-xia,LI Fang,HU Zi-li,LIU Hai-ling,XIN Chao-an,LIAO Ming,LUO Kai-jian
(KeyLaboratoryofZoosisDiseaseControlandPreventionofGuangdongProvince/KeyLaboratoryofAnimal DiseaseControlandPreventionoftheMinistryofAgriculture/CollegeofVeterinaryMedicine,South ChinaAgriculturalUniversity,Guangzhou,Guangdong,510642,China)
To evaluate the pathogenicity of H5N1subtype Avian influenza viruse(AIV)in pigeons,4-weekold pigeons were infected artificially with A/pigeon/GD/C2/2004(H5N1)which isolated from China in 2004.The results showed that the pigeons could be killed with 106EID50/100μL dose of virus and the lethality was 22.2%.The virus could be isolated from nearly all organs of the infected pigeons,especially in the lung and the kidney reaching titers of 104.50EID50/mL.The result showed H5N1AIV had the pathogenicity to pigeons.Besides,we found that all the infected pigeons have not shed virus via the oropharynx and the cloaca.
Avian influenza virus;H5N1;pigeons;infection
S852.659.5
A
1007-5038(2011)10-00015-04
2011-01-29
教育部创新团队项目(IRT0723);国家肉鸡产业技术体系项目(nycytx-42-G3-03);广东省自然科学基金项目(10151064201000021,10251064201000004);广东省科技计划项目(2010B020307005)
乔立旺(1982-),男,山东济宁人,硕士研究生,主要从事动物病毒分子生物学及动物传染病防控研究。△对本文贡献与第一作者相同,

