CRY1基因单核苷酸多态性与乳腺癌风险的关联研究
朱晓灵 张丽娜 戴弘季 郑红 赵妍蕊 宋丰举 陈可欣
天津医科大学附属肿瘤医院肿瘤研究所流行病室,
乳腺癌防治教育部重点实验室,天津市“肿瘤防治”重点实验室,天津 300060
乳腺癌是女性常见的恶性肿瘤,随着生活水平的提高,我国乳腺癌发病率正以每年3%的速率递增。其影响因素除了已经明确的如月经失调、生育、饮食、家族史等因素外,生物钟基因破坏已受到广泛关注[1],大量流行病学数据表明昼夜节律紊乱导致乳腺癌发病率上升[2-5]。
隐花色素-1 (cryptochrome-1,CRY1)基因属于生物钟基因家族,它最早在植物体内发现,起到蓝光感光色素的作用,从而使得植物根据太阳周期调校其本身生物钟。在研究哺乳动物DNA修复光解酶过程中发现该基因包括Cry1和Cry2,与Pers形成异源二聚体,是生物钟基因负反馈环的主要部分[6]。近年来生物钟基因多态性与乳腺癌易感性的关系引起国内外研究者的广泛关注,本研究旨在探讨生物钟基因CRY1rs1056560 T>G单核苷酸多态性与乳腺癌发病风险的关联。
1 资料和方法
1.1 研究对象
本研究采用大规模病例对照研究,包括1 523例原发乳腺癌患者和1 599例非肿瘤对照,均为天津女性居民。病例为2005年1月—2009年12月在天津医科大学附属肿瘤医院住院的女性乳腺癌患者;对照为同时期在该院参加健康体检合格的妇女,并与病例按年龄频数匹配。对病例和对照使用统一的调查表进行流行病学调查,内容包括:人口统计学特征、月经生育情况、疾病史、疾病家族史等资料。
1.2 标本收集和基因组DNA制备
取静脉血5 mL (清晨空腹),所有标本留取均获得研究对象同意。基因组DNA提取采用饱和盐析方法,紫外分光光度计检测DNA浓度和纯度,分装于4℃备用,其余DNA放于-20 ℃保存。
1.3 TaqMan SNP分型
采用TaqMan SNP分型技术(ABI7500实时定量荧光PCR仪),针对CRY1rs1056560 T>G位点设计TaqMan MGB探针(ABI公司提供)。上游引物:5’-ATGTTGTTTCTAATGACAT TTCTGTGGTTTTT-3’,下游引物:5’-CATTAA GCAAATTCTCTTGCCAAGTTCT-3’。PCR反应体积为5 μL,内含2×TaqMan Master Mix 2.5 μL、40×探针0.125 μL、模板DNA(10 ng/μL) 2.5 μL、dH2O 1.875 μL。反应条件:95 ℃变性10 min,92 ℃ 30 s,60 ℃60 s,共40个循环,以灭菌水为阴性对照。随机抽取10%的样品重复实验,一致性为100%。
1.4 统计学处理
采用SPSS 16.0统计软件包进行分析。采用双侧χ2检验比较病例组和对照组一般人口学变量、主要环境危险因素及CRY1基因型分布的差异。在对照人群中检测CRY1基因型分布的Hardy-Weinberg平衡,检验水准α=0.05。应用单因素和多因素非条件Logistic回归分析估计相对危险度(odds ratios,OR)及95%可信区间(confidence intervals,CI),并按相关因素分层,分析各因素对乳腺癌发病危险的影响,P<0.05为差异有统计学意义。
2 结 果
2.1 研究对象的一般情况
本次病例对照共纳入1 523例乳腺癌病例和1 599例健康对照,病例和对照按年龄匹配(P=0.877),其他已知环境危险因素信息表见表1,病例组的月经初潮年龄及母乳喂养时间显著小于对照组(P=0.000),初孕年龄显著高于对照组(P=0.000)。对照组中活产次数显著较病例组多(P=0.000),而流产次数则较病例组少(P=0.000),病例组中具有乳腺良性病史及肿瘤家族史者显著多于对照组(P=0.000和0.000),提示可能为乳腺癌的危险因素。
2.2 两组CRY1基因型及等位基因频率的比较
TaqMan基因分型结果见图1。等位基因分布频率见表2,在对照组中,CRY1基因TT型、GT型和GG型分布频率分别为55.0%、39.3%和5.7%,符合Hardy-Weinberg平衡定律(χ2=2.444,P=0.118),说明对照组人群具有较好的代表性。病例组中相应频率分别为58.4%、35.1%和6.6%,两组基因型分布差异有统计学意义(χ2=6.394,P=0.041)。G等位基因(GT/GG)在病例和对照间分布无显著差异(χ2=3.671,P=0.055)。

表 1 研究对象一般情况Tab.1 General distributions in breast cancers and the healthy controls
2.3 CRY1基因多态性与乳腺癌危险性的关系
单因素Logistic回归分析发现,相对于TT型,GT型可以显著降低乳腺癌发病率(OR=0.839,95%CI:0.724~0.974)(表2),G等位基因可以降低12.9%的乳腺癌发病风险(OR=0.871,95%CI:0.756~1.003)。调整年龄、初潮年龄、初孕年龄、母乳喂养时间、绝经年龄、活产次数、流产次数、良性病史及肿瘤家族史后,GT型能够降低25.7%乳腺癌发病风险(OR=0.743,95%CI:0.580~0.951),携带G等位基因个体乳腺癌发病风险降低23.2%(OR=0.768,95%CI:0.606~0.971)。
2.4 对混杂因素分层分析
本研究进而按绝经状态、初潮年龄、初孕年龄、母乳喂养时间、活产次数、流产次数、良性病史及肿瘤家族史对CRY1基因多态性进行分层分析(表3)发现,携带G等位基因保护作用在绝经后妇女、初潮≥13岁、初孕≥25岁、无肿瘤家族史者、无乳腺良性病史及流产0~1次妇女中更加显著(P<0.05)。
2.5 非条件Logistic回归分析
对初潮年龄、初孕年龄、家族史等相关因素进行多因素非条件Logistic回归分析(表4),活产次数、流产次数、良性病史、家族史及CRY1杂合GT型与乳腺癌发病相关(P<0.05),其中乳腺良性病史及家族史为较强的危险因素。
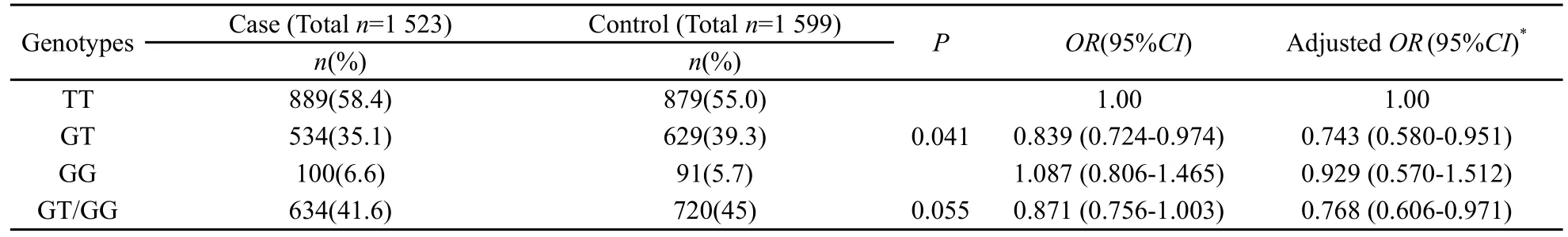
表 2 CRY1基因型频率分布及其与乳腺癌风险的关系Tab.2 Distributions of the SNP genotypes of CRY1 gene in case and control and its relationship with the susceptibility of breast cancer

表 3 CRY1基因型频率按混杂因素的分层分析Tab.3 The stratif i ed analysis of CRY1 gene by confounding factors

表 4 乳腺癌多因素非条件Logistic回归分析结果Tab.4 Multivariate logistic regression analysis of susceptibility of breast cancer
3 讨 论
国内外学者多次进行乳腺癌的流行病学研究,Ma等[7]的Meta分析认为乳腺癌与能够影响人体内源性雌激素暴露水平及遗传家族史密切相关。本研究同样发现初潮年龄早、孕年龄晚、母乳喂养时间短、流产次数多、有乳腺良性病史及家族史阳性为乳腺癌危险因素,而活产次数多则为保护因素,其中乳腺良性病史(OR=4.067,95%CI:2.779~5.950)及家族史为较强的危险因素(OR=3.075,95%CI:2.298~4.115)。
生物节律与乳腺癌形成的相互关联首先在一系列流行病调查中提出。Megdal等[4]针对多项流行病学调查进行Meta分析:长期轮换班、夜间工作以及长期工作于跨时区飞行航班的女性乘务员因昼夜节律经常被打乱,乳腺癌的发病率较之对照组增高约48%(OR=1.48,95%CI:1.36~1.61)。流行病学数据在小鼠模型研究中也得到证实。无论外科切除SCN[8]还是慢性暴露于灯光下打乱昼夜节律(人为的将24 h昼夜变化提前8 h)[9],植入性肿瘤生长速度都增加。就其发生机制,国内外大多数学者支持褪黑素假说[10],乳腺癌是激素依赖性肿瘤之一,夜间光照使得褪黑素分泌减少,而褪黑素可以作用于雌激素系统抑制卵巢雌激素的分泌,故昼夜节律的紊乱最终导致雌激素分泌的增多,从而促进乳腺癌的发生。
在研究生物钟基因突变与乳腺癌危险因素关系时,Zhu等[11]首次发现在绝经前的高加索妇女中,PER3的突变基因型(含有5次重复序列的纯合子+杂合子)会增加乳腺癌的发病危险(OR=1.7,95%CI:1.0~3.0)。后来又连续发现生物钟基因NPAS2杂合子Ala394Thr与野生型Ala394Ala相比,可以降低乳腺癌发病率(OR=0.66,95%CI:0.51~0.85)[12],同时发现该位点多态性可以降低非霍其金淋巴瘤的危险性(OR=0.61,95%CI:0.47~0.80)[13]。而关于其他激素依赖性肿瘤,Chu等[14]报道生物钟基因CRY2rs2305160 G>C是前列腺癌发病危险因素(OR=1.7,95%CI:1.1~2.7),并且与胰岛素抵抗有协同作用(OR=4.1,95%CI:2.2~8.0)。
CRY1基因定位于12号染色体12q23.3,其蛋白产物与PER形成异源二聚体,反馈抑制Clock-Bmal1异源二聚体介导的转录,是生物钟基因负反馈环的主要部分,其基因缺失或突变将导致生物节律发生改变。Rs1056560位点位于CRY1基因3’非翻译区,真核生物mRNA 3’非翻译区与miRNA靶序列通过Waston-Crick配对结合,影响靶基因的表达和功能介导的功能,从而调节转录本的稳定性、亚细胞定位和翻译水平,是许多基因表达所必需的一个调节区。若3’非翻译区单核苷酸多态性发生改变,可使基因表达发生改变,最终导致疾病的发生。本研究首次探讨关于CRY1基因单核苷酸多态性与乳腺癌易感性之间的关联。结果显示,CRY1三种基因型在病例组和对照组分布具有显著差异(χ2=6.394,P=0.041),携带杂合GT基因型的个体患乳腺癌风险降低25.7% (OR=0.743,95%CI:0.580~0.951),而携带GG可能由于例数少,其保护作用不显著(OR=0.929,95%CI:0.570~1.512)。至少携带一个G等位基因(GT/GG)的个体患乳腺癌发病风险降低23.2%(OR=0.768,95%CI:0.606~0.971)。
本研究进一步就混杂因素进行分层分析,发现携带G等位基因(GT/GG)保护作用在绝经后妇女、初潮≥13岁、初孕≥25岁、无肿瘤家族史者、无乳腺良性病史及流产0~1次妇女中更加显著(P<0.05),在活产次数为2的妇女中保护作用较活产为0~1、≥3次强,但尚未达到显著水平(P=0.086),提示rs1056560 T>G多态性可能与环境存在相互作用。与Zhu等[12-13]报道的生物钟基因在绝经前妇女作用更加明显不同的是,本研究发现G等位基因保护作用在绝经后妇女的保护性更加显著,可能与研究人种不同及样本量差异有关。本研究同时发现,在有肿瘤家族史和良性病史中,与TT基因型比较,GT/GG组的OR值不显著,可能由于家族史和乳腺良性病史为乳腺癌较强危险因素,掩盖了G等位基因的保护作用,也可能与分层后家族史阳性和乳腺良性病史的个体较少相关。
本研究是基于医院的大样本病例-对照研究(病例1 523vs对照1 599),我们进一步对CRY1基因多态性与生理、生育和遗传因素等进行多因素非条件Logistic回归分析,发现CRY1杂合基因型(GT)可以显著降低乳腺癌发病风险,GG型可能由于例数少,其保护作用不显著。由于本研究缺少研究对象职业(涉及倒班)及睡眠习惯等信息,尚需在今后研究设计中进一步完善,同时有待于不同种族人群的关联研究及功能学研究的进一步证实。
[1]STEVENS R G.Light-at-night, circadian disruption and breast cancer: assessment of existing evidence [J].Int J Epidemiol, 2009, 38: 963-970.
[2]SCHERNHAMMER E S, LADEN F, SPEIZER F E, et al.Rotating night shifts and risk of breast cancer in women participating in the nurses’ health study [J].J Natl Cancer Inst, 2001, 93: 1563-1568.
[3]HANSEN J.Risk of breast cancer after night- and shift work:current evidence and ongoing studies in Denmark [J].Cancer Causes Control, 2006, 17: 531-537.
[4]MEGDAL S P, KROENKE C H, LADEN F, et al.Night work and breast cancer risk: a systematic review and meta-analysis[J].Eur J Cancer, 2005, 41: 2023-2032.
[5]O’LEARY E S, SCHOENFELD E R, STEVENS R G, et al.Shift work, light at night, and breast cancer on Long Island,New York [J].Am J Epidemiol, 2006, 164: 358-366.
[6]DUNLAP J C.Molecular bases for circadian clocks [J].Cell, 1999, 96: 271-290.
[7]MA H, BERNSTEIN L, PIKE M C, et al.Reproductive factors and breast cancer risk according to joint estrogen and progesterone receptor status: a meta-analysis of epidemiological studies [J].Breast Cancer Res, 2006, 8:43.
[8]FILIPSKI E, KING VM, LI X, et al.Disruption of circadian coordination accelerates malignant growth in mice [J].Pathol Biol (Paris), 2003, 51: 216-219.
[9]FILIPSKI E, LI XM, LEVI F.Disruption of circadian coordination and malignant growth [J].Cancer Causes Control, 2006, 17: 509-514.
[10]STEVENS RG.Circadian disruption and breast cancer: from melatonin to clock genes [J].Epidemiology, 2005, 16:254-258.
[11]ZHU Y, BROWN HN, ZHANG Y, et al.Period3 structural variation: a circadian biomarker associated with breast cancer in young women [J].Cancer Epidemiol Biomarkers Prev,2005, 14: 268-270.
[12]ZHU Y, STEVENS RG, LEADERER D, et al.Nonsynonymous polymorphisms in the circadian gene NPAS2 and breast cancer risk [J].Breast Cancer Res Treat, 2008, 107:421-425.
[13]ZHU Y, LEADERER D, GUSS C, et al.Ala394Thr polymorphism in the clock gene NPAS2: a circadian modifier for the risk of non-Hodgkin’s lymphoma [J].Int J Cancer,2007, 120: 432-435.
[14]CHU LW, ZHU Y, YU K, et al.Variants in circadian genes and prostate cancer risk: a population-based study in China[J].Prostate Cancer Prostatic Dis, 2008, 11: 342-348.

