siRNA抑制人胶质瘤细胞MDM2的表达及细胞增殖
张舵舵,赵燕颖,张 妍,刘 玲,高振平*
(1.吉林大学基础医学院,吉林长春130021;2.吉林大学中日联谊医院;3.吉林大学第四临床医院;4.延边大学医学部)
胶质瘤是颅内最常见的肿瘤,大多数胶质瘤恶性程度高,侵袭性强,手术不易完全切除,术后复发率高,病人预后不良。p53蛋白具调节细胞生长和诱导凋亡的作用,MDM2作为一个癌基因主要是抑制野生型p53的激活转录功能和抗肿瘤活性。研究发现MDM2蛋白的过度表达导致同时表达的p53蛋白量减少导致肿瘤的发生[1]。研究报道MDM2癌基因在肉瘤、膀胱癌、胶质瘤、肺癌等都有过度表达[2]。本研究体外合成特异性针对MDM2基因的siRNA,研究siRNA对MDM2基因的阻抑作用和对人胶质瘤细胞的生长增殖抑制作用,为胶质瘤的基因治疗提供新的思路。
1 材料与方法
1.1 材料
SilencerTM siRNA construction kit(Ambion公司);LipofectamineTM 2000转染试剂盒(Invitrogen);胎牛血清、IMDM 培养基(Gibco公司);MTT、RT-PCR kit(Promega)、引物由上海生工生物技术公司合成;U251细胞株(中国科学院上海细胞所)。
1.2 siRNA的设计和合成
根据已知Genebank中MDM2mRNA序列和siRNA的设计原则[4],利用Ambion公司的在线设计来寻找靶序列,并做同源序列搜索,排除那些和其他编码序列或EST同源的序列,用silencerTM siRNA construction kit体外合成si-MDM2-1,si-MDM2-2,阴性对照control siRNA购于Ambion,与任何编码序列无同源性。
1.3 细胞培养 人胶质瘤细胞株U251细胞IMDM培养液(10%胎牛血清,青霉素100 μ g/ml,链霉素100 μ g/ml)中,37℃、5%CO2孵箱内培养。常规更换培养液、消化传代,实验所用细胞均处于对数生长期。
1.4 细胞转染 对数生长期细胞在无抗生素的培养基中培养细胞融合率达80%-95%时开始转染。操作按LipofectamineTM 2000试剂说明书进行。分四组转染:空白对照组(只加转染试剂),转染阴性对照质粒和转染两个siMDM2质粒组,瞬时转染后提取细胞RNA以备后续实验用。
1.5 半定量RT-PCR 收集转染48 h后各组细胞,分别提取总RNA,紫外分光光度计定量。RNA样品经逆转录反应合成cDNA,然后进行PCR扩增。MDM2扩增产物为450 bp,上游引物为:5′-AATCATCGGACTCAGGTA-3′,下游 引物为:5′-CTTCACTAAGGCTATAATCTTC-3′;β-actin扩增产物为 520 bp,上游引物为 :5′-GGGACCTGACAGACTACCT-3′下游引 物为:5′-CGTACTCCTGCTTGCTGA-3′。扩增 条件:94℃变性45秒,56℃退火45秒,72℃延伸1分钟,30个循环,最后72℃延伸10分钟。PCR产物经1%琼脂糖凝胶系统电泳(含溴化乙啶),拍照鉴定。用Pharmacia ImageMaster凝胶成像仪观察,并用ImageMaster软件分析条带峰面积。
1.6 MTT检测细胞增殖抑制率 以5×103/孔将对数生长期细胞接种于96孔板,培养至细胞贴壁后转染(分组同上),转染质粒组使其终浓度达50 nmol/L,转染 24、48 、72 h 后,每孔加入 15 μ L MTT(5 mg/ml)培养 4 h,再加入150 μ L/孔的 DMSO,振荡 10分钟,用酶标仪570 nm处测定吸光度(A)值。根据公式:细胞增殖抑制率(%)=(1-处理组吸光度/未处理组吸光度)×100%,计算出抑制率。每组均设4个平行孔,重复3次。
1.7 流式细胞术检测凋亡 取对数生长期细胞按7.5×105/瓶接种到培养瓶,分组同上。培养72 h后消化收集细胞,用冰冷PBS洗2次,制备成单细胞悬液,用冰冷70%乙醇固定过夜,碘化丙啶染色,流式细胞仪检测凋亡率。
2 结果
2.1 重组质粒酶切和测序鉴定 构建的Si MDM2真核表达质粒经HindⅢ和BamH Ⅰ双酶切鉴定,电泳结果为大片段的载体片段和63 bp的目的片段,与预计片段长度相同(图1)。将重组质粒PGCsilencerTM-MDM2-siRNA送上海生工测序,序列完全与目的序列相同,表明siRNA MDM2构建成功。
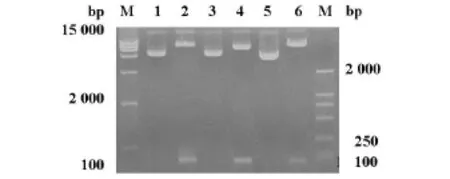
图1 重组质粒双酶切鉴定
2.2 半定量RT-PCR 以β-actin作为内参照,对靶基因mRNA进行定性定量分析,MDM2和β-actin引物的扩增基因片段经电泳后,结果显示扩增片段大小分别为450bp和520bp。转染siMDM2-1,2组MDM2 mRNA表达明显减少,而转染阴性质粒组MDM2 mRNA表达水平无明显改变。半定量扫描分析,转染si-MDM2-1 si-MDM2-2中MDM2-mRNA的表达量分别下降至对照组的31.61%,40.18%(P<0.05);阴性对照质粒组的MDM2-mRNA表达为对照组的97.9%,与空白对照组无明显差异(P>0.05)。(图2)

图2 比较转染PGCsilencerTM-MDM2-siRNA质粒和阴性对照质粒后中MDM2-mRNA的表达的变化
2.3 siMDM2转染后对细胞增殖的影响 MTT法结果表明转染siMDM2后细胞的增殖速度和分裂指数都明显降低;增殖抑制率随时间的增加而增高:siMDM2-1和siMDM2-1组的增殖抑制率和空白对照组比差异具有显著性,(P<0.05);而且,24、48、72 h各时间组间的抑制率差异也有显著性(P<0.05)。
2.4 siMDM2转染后对U251细胞凋亡的影响 转染siMDM2-1,2后72 h,检测细胞凋亡率分别为49.9%,40.0%,转染阴性对照质粒组未见明显凋亡。SiMDM2-1组和si MDM2-2组细胞处于S期的百分率分别为30.8%和 33.1%,明显低于对照组(56.1%);而SiMDM2-1组和SiMDM2-2组细胞处于G0/G1期的百分率高于对照组。
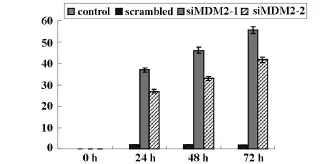
图3 siMDM2对细胞增殖的影响
3 讨论
脑胶质细胞瘤是临床上颅内肿瘤中最常见的一种。近年人们认识到胶质瘤的发生、发展是多个癌基因和抑癌基因异常改变的结果,与癌基因的激活、过表达或扩增,抑癌基因的缺失或突变失活密切相关。尤其是MDM2基因的扩增或过表达及p53基因突变在其中起着举足轻重的作用。
抑癌基因p53诱导细胞凋亡和DNA修复,而MDM2能抑制p53的功能,并启动p53泛素化和核输出而诱导p53的降解[5]。研究表明,P53抑癌基因的失活及原癌基因MDM2的激活促使细胞异常增殖,从而导致肿瘤的发生[6]。p53基因突变失活是胶质瘤常见的遗传学改变之一,MDM2在胶质瘤中的扩增与表达和肿瘤转移、复发有关,在胶质瘤细胞发生和发展过程中发挥重要作用。Ichimura和Park[7,8]等曾报道在胶质母细胞瘤及间变性星形细胞瘤有MDM2基因过度表达。并在高度恶性的肿瘤细胞中发现有高水平的MDM2癌基因产物的表达;故认为MDM2与胶质瘤等肿瘤的发展和转移有关。
SiRNA可以特异性地降解相应基因的mRNA,从而抑制该基因的表达。微量的siRNA即可使其编码致病基因产物的含量明显下降,达到剔除的效果;同时,siRNA的抑制作用具有严格的序列特异性,治疗的针对性强,副作用小。因此,siRNA技术为肿瘤基因治疗提供了一个新的可供选择的策略和技术平台。
本实验我们设计合成了2对针对MDM2基因的干扰位点序列的siMDM2[3]。将构建的siMDM2真核表达质粒转染至细胞后进行基因水平和凋亡的检测。MDM2的2个干扰位点都具有强效的干扰效果。RT-PCR结果显示siMDM2能有效地阻抑MDM2基因的表达,阻抑效应平均达到64.11%。MTT和流式细胞术检测结果显示:瞬时转染siMDM2-1和siMDM2-2能有效抑制细胞增殖,使U251细胞增殖速度减慢,增殖抑制率与对照组比有显著差异,并且随着时间增殖抑制率有所增加。同时,发现si MDM2能诱导肿瘤细胞发生凋亡,而且使S期细胞减少,G0/G1期的细胞百分比增多,其细胞阻滞作用可能是其可以诱导细胞凋亡的原因之一。
本实验继吕佳音[9]等人对关于siMDM2对骨肉瘤的增殖影响的研究后进一步证明了siMDM2对胶质瘤细胞也同样存在增殖抑制和诱导凋亡的作用。提示在胶质瘤治疗中,以MDM2基因为靶点,利用siRNA技术进行基因治疗有可能成为一种新的有效手段,本研究亦为后续的对其他肿瘤长效抑制的研究工作打下了坚实的基础。
[1]Phan J,Li Z,Kasprzak A,et al.Structure-based design of high-affinity peptides inhibiting the interaction of p53 with MDM2 and MDMX[J].J Biol Chem,2009,12(12):1.
[2]Pacinda SJ,L edet SC,Geondo MM,et al.p53 andMDM 2 immuno staining in pulmonary blastomas and bronchogenic carcinomas[J].Human Pathol,1996,27:542.
[3]Khatri RG,Navaratne K,Weil RJ.et al.The role of a single nucleotide polymorphism of MDM2 in glioblastoma multiforme[J].J Neurosurg,2008,109(5):842.
[4]Elbashir SM,Harborth J,WeberK,et al.Analysis of gene function in somatic mammalian cells using small interfering RNAs[J].Methods,2002,26(2):199.
[5]Yu S,Qin D,Shangary S,et al.Potent and Orally Active Small-Molecule Inhibitors of the MDM2-p53 Interaction[J].J Med Chem,2009,11(24):16.
[6]Lind H,Zienolddiny S,Ekstrom PO,Skaug Y,Haugen A.Association of a functional polymorphism in the promoter of the MDM2 gene with risk of nonsmall cell lung cancer[J].Int J Cancer,2006,2(22):24.
[7]Ichimura K,Bolin MB,Goike H M,et al.Deregulation of the p14ARF/MDM2/p53 pathway is a prerequisite for human astrocytic gliomas with G1-S transition control gene abnormalities[J].Cancer Res,2000,60(2):417.
[8]Park S,Hatanpaa KJ,Xie Y,et al.The receptor interacting protein 1 inhibits p53 induction through NF-kappaB activation and confers a worse prognosis in glioblastoma[J].Cancer Res,2009,1;69(7):2809.
[9]吕佳音,吴丹凯,赵燕颖,等.siRNA对骨肉瘤U2OS细胞株MDM2-mRNA表达的抑制作用[J].中国实验诊断学,2007,11(7):878.

