乌饭树叶总黄酮体外抗氧化活性
蔡凌云
(1.贵州省凯里市凯里学院环境与生命科学学院,贵州凯里 556011;2.四川省南充市西华师范大学生命科学学院;西华师范大学生命科学学院,西南野生动植物资源保护教育部重点实验室,四川南充 637002)
乌饭树Vaccinium bracteatumThunb为杜鹃花科Erioaoeae越桔属Vaccinium植物,据《中药大辞典》载,乌饭树叶具有益精气、强筋骨、明目、止泄的功用,内含有花青素、β-谷甾醇、熊果酸、蓝黑色素(主要成分是槲皮素)、异荭草素、对羟基桂皮酸、内消旋肌醇、α-亚麻酸、乌索酸、齐墩果酸、三十一烷及鞣质等成分。乌饭树叶具有促进视红素再合成,Vp样机能、改善血液微循环、抗溃疡、抗炎症、抗衰老等多种药理活性[1-5]。国外学者研究其浆果的抗氧化活性[6-7],但目前对乌饭树叶的抗氧化性研究在国外尚未见报道,近年来,我国学者对乌饭树叶的化学成分和分离出来的黄酮单体的抗氧化活性进行过研究[8-14],本实验提取乌饭树的总黄酮类物质并纯化,进行总黄酮抗氧化性的研究,用SPSS软件进行相关分析、差异性分析和回归分析,为开发乌饭树这一天然的食品抗氧化剂提供理论依据。
1 材料与方法
1.1 材料与试剂 乌饭树2010年5月采集于贵州省黔东南州台江县,经环境与生命科学学院周江菊教授鉴定为杜鹃花科越桔属植物乌饭树。标本保存于凯里学院环境与生命科学学院标本室。
DPPH:日本和光纯药,供应商:上海如吉生物技术有限公司。芦丁(中药固体制剂制造技术国家工程研究中心,纯度≥98%,编号:1097-060918)。
磷酸钠、钼酸铵、磷酸氢二钠、磷酸二氢钠、三氯化铁、铁氰化钾、三氯乙酸、乙醇等均为分析纯,水为蒸馏水。
1.2 仪器与设备 R-200旋转蒸发仪,瑞士BUCHI公司。eppendorf Research移液器,德国 Eppendorf AG公司。UV-2102C型紫外分光光度计,尤尼柯(上海)仪器有限公司。格兰仕微波炉G8023CSL-K3:格兰仕微波炉电器有限公司。低速离心机LD4-2:北京医用离心机厂。BT124S电子天平,北京赛多利斯天平有限公司。
1.3 方法
1.3.1 样品处理和提取液制备 自然干燥的乌饭树叶粉末分别过60目筛,置于干燥器中备用。精确称取上述粉末50.000 g,置锥形瓶中,加80%乙醇,料液比为1︰15,微波间歇提取2次,每次100 s,微波功率320 W,合并提取液,浓缩至无醇味,上HPD-600药用大孔吸附树脂柱,水洗除杂质,70% 乙醇洗脱。吸附体积流量为0.5 mL/min,洗脱体积流量为2 mL/min。洗脱液用于测定其中黄酮量和抗氧化活性实验。
1.3.2 提取物中黄酮的测定和芦丁标准曲线的制备 采用Al(NO3)3-NaNO2-NaOH比色法,在波长为510 nm测定吸光度。
精确称取120℃减压干燥至恒重的芦丁标准品用乙醇溶解后,定容,得对照品液(0.5 mg/mL)。精密量取芦丁对照品溶液 0.00、0.25、0.50、1.00、1.50、2.00 mL 分别放入 1~6号10 mL量瓶中,加5%NaNO2溶液0.3 mL,摇匀,放置6 min,加10%Al(NO3)3溶液 0.3 mL,摇匀,放置 6 min,加4%NaOH溶液3mL,再用乙醇稀释至刻度,摇匀,放置10 min,测定吸光度。取经稀释定容的上述乌饭树叶总黄酮洗脱液,如上方法测定吸光度。
1.3.3 DPPH·自由基的清除率测定 在试管里分别加入不同质量浓度的洗脱液 2 mL(20、25、30、35、40、45 mg/L,每个质量浓度做3个平行),然后依次加入2 mL 2 mmol/L DPPH·,摇匀,在25℃水浴加热反应30 min,取出,测定在517 nm处的吸光度,此时为Ai。另取试管,加入2 mL蒸馏水代替样品,测样品的A0,另取试管,用蒸馏水代替DPPH·测定样品本底吸光度,此时为Aj。根据下式计算对DPPH·的清除率,比较样品和Vc的抗氧化能力。

1.3.4 对羟基自由基的清除率的测定 在试管里分别加入不同质量浓度的洗脱液各 2 mL(20、25、30、35、40、45 mg/L,每个质量浓度做3个平行)然后依次加入2 mL 2 mmol/L硫酸亚铁,2 mL 6 mmol/L的水杨酸,2 mL 1 mmol/L的双氧水混匀启动反应,在37℃水浴加热30 min,510 nm处测定吸光度,此时为样品Ai。另取试管,加入2 mL蒸馏水代替样品,重复上述实验,在510 nm处测定吸光度,此时为样品A0。在试管里分别加入不同质量浓度的提取液各2 mL(20、25、30、35、40、45 mg/L,每个质量浓度做 3 个平行)然后依次加入2 mL 2 mmol/L硫酸亚铁,2 mL 6 mmol/L的水杨酸,2 mL蒸馏水代替双氧水混匀,在37℃水浴加热30 min,510 nm处测定吸光度,此时为样品Aj。
1.3.5 抑制浓度EC50的求算 用SPSS 11.5软件以样品质量浓度与抑制率作回归分析,根据拟合方程求出抑制率为50%时所需样品的质量浓度,即半抑制浓度EC50。
2 结果与分析
2.1 芦丁标准曲线 在510 nm下测定标准品溶液的吸光值,作线性回归,可得芦丁质量浓度C与吸光度A间的回归方程为A=12.702C- 0.020 9。
2.2 抑制浓度EC50以乌饭树叶总黄酮质量浓度(X)与抑制率(Y)作回归分析。
DPPH·清除率的回归方程为:Y=10.303+1.780X,相关系数R=0.966(P<0.001)。
OH·清除率的回归方程为:Y=41.336+0.228X,相关系数R=0.872(P<0.001)。
根据回归方程计算得乌饭树叶总黄酮对DPPH·和OH·的 EC50分别为22.30 mg/L 和38.00 mg/L,说明乌饭树叶总黄酮的抗氧化能力强,是良好的天然抗氧化剂。
2.3 乌饭树叶总黄酮对DPPH·自由基的清除率 如图1所示,质量浓度对乌饭树叶清除DPPH·影响极其显著,相关系数分别达0.987,并随总黄酮质量浓度增大而清除率增大。分析表明,在所选质量浓度范围内,乌饭树叶在黄酮质量浓度为45 mg/L时,对DPPH·的清除率最高,与其他质量浓度具有极显著差异(P<0.01)。乌饭树树叶总黄酮对DPPH·具有相当强的清除能,其EC50达22.30 mg/L。
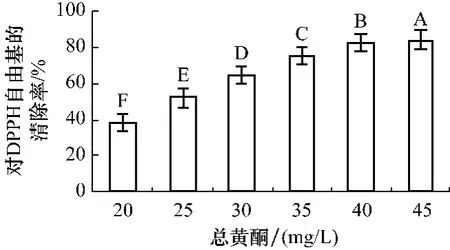
图1 对DPPH·的清除率
2.4 乌饭树叶总黄酮对羟基自由基的清除率 如图2所示,质量浓度对乌饭树叶清除OH·影响极其显著,相关系数分别达0.872,并随总黄酮质量浓度增大而清除率增大。分析表明,在所选质量浓度范围内,乌饭树叶在总黄酮质量浓度为45 mg/L对OH·的清除率最高,与其他质量浓度比具有极显著差异(P<0.01)。质量浓度为40 mg/L、35 mg/L、30 mg/L时,质量浓度变化对自由基清除率的影响没有显著性差异,质量浓度为30 mg/L、25 mg/L时,质量浓度变化对自由基的清除率的影响也没有显著性差异,质量浓度为25 mg/L与20 mg/L时,质量浓度变化对自由基的清除率的影响具有极显著差异(P<0.01)。乌饭树树叶总黄酮对OH·具有相当强的清除能,其EC50达38.00 mg/L。
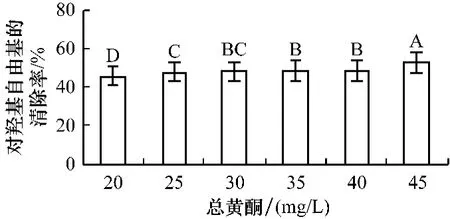
图2 对羟基自由基的清除率
3 结论和讨论
3.1 在生命活动的过程中,氧化代谢反应会产生各种自由基,适量自由基对细胞的分裂、生长、消炎、解毒等起积极作用。但是自由基过多或清除过慢会使生物大分子受到攻击,加速机体的衰老进程,并诱发炎症、恶性肿瘤、免疫失调等多种疾病[18]。为了抑制自由基损伤,人工合成的抗氧化剂被大量应用于食品、化妆品和医药等领域,化学合成制品大多有毒副作用,长期摄入合成抗氧化剂可导致肝损伤并诱发恶性肿瘤[15],因此从天然产物中寻找低毒或无毒的抗氧化有效成分具有十分重要的意义。天然黄酮、皂苷、多糖等化合物对物理、化学以及生物等因素产生的自由基具有清除作用,有望作为天然抗氧化剂使用。
3.2 我们通过选用清除自由基DPPH·和OH·法,对乌饭树叶总黄酮体外抗氧化活性进行了检测。2,2-二苯代苦味肼基(DPPH)自由基是一种合成的有机自由基。常用来研究酚类抗氧化剂的构效关系,此法是依据DPPH在517 nm处有一强吸收和其乙醇溶液呈紫色的特性,在有自由基清除剂时,由于与其单电子配对而使其吸收消失,其褪色程度与其接受的电子数成定量关系,因而可用分光法进行定量分析。María等[16]用DPPH法测石榴汁、维生素C、和葡萄酒的总的抗氧化能力,将清除DDPH 50%所用量定义为EC50,用来作为抗氧化能力的指标。郝晓丽等[17]用DDPH自由基清除法测定了多种植物(马齿苋,扁蓄,车前草等)的清除自由基的能力。在测定样品对DPPH自由基的清除能力时可通过计算EC50,TEC50(清除DDPH 50%所需用量时所用的时间)和AE(清除效率)等参数来反映抗氧化剂清除自由基反应的动力学行为[18]。对羟基自由基的清除作用采用水杨酸法。通过Fenton反应产生的·OH氧化水杨酸产生对510nm光有特征吸收的2,3-二羟基苯甲酸,通过测定水杨酸捕获·OH所得到的产物确定·OH的清除率。
3.3 我国民间有采食乌饭浆果的习惯,有些地方用于制造果酱和酿酒但是没有形成规模,国外对于乌饭树树果的研究报道也有,乌饭树提取物中以前花青素和槲皮素为代表的植物多酚类为主。近年来,通过广泛而深入的研究,植物多酚已被称为第7营养素,乌饭树叶提取物中含有大量的植物多酚这一特点,决定了其具有很高的营养保健价值。我们对乌饭树叶总黄酮体外抗氧化活性进行了检测,并考察了其EC50,结果证实了乌饭树叶黄酮是一种良好的天然抗氧化剂,为乌饭树在保健食品、药品领域中的开发利用提供理论依据。
[1]陈重明,张 宁,王 鸣.乌饭树的民族植物学[J].植物资源与环境,1998,7(1):45.
[2]南京新医学院.中药大辞典(下)[M]上海:上海人民出版社,1974:652.
[3]国家中医药管理局中华本草编委会.中华本草(精华本)[M].上海:上海科技出版社,1998:1472.
[4]屠鹏飞,胡迎庆,刘江云.越桔属植物的化学成分与开发应用价值[J].中草药,1996,27(9):565-568.
[5]Cheng Chong-Ming.Ethnobotany ofthe Blackrice Tree(Vaccinium bracteaiumThunb.)[C].The first international congress of ethnobiology,Proceedings ofethnobiology:Implications and applications[J].Belem Press,1998:178-181.
[6]Connor A M.Variability in antioxidant activity in blueberry,and correlations among different antioxidant activity assays[J].J Am Soc Hortic Sci,2002,127(2):238-244.
[7]Pinhero R G,Paliyath G.Antioxidant and calmodulin-inhibitory activities ofphenolic components in fruit wines and its biotechnological implications[J].FoodBiotechnol,2001,15(3):179-192.
[8]王 立,姚惠源.乌饭树树叶的黄酮类成分研究[J].天然产物研究与开发,2007,19(6):989-990.
[9]李增亮,张 琳,田景奎,等.乌饭树叶的化学成分研究[J].中国中药杂志,2008,33(18):2087-2089.
[10]王 立,姚惠源,陶冠军,等.乌饭树树叶中槲皮素的提取分离与鉴定[J].食品与生物技术学报,2005,24(4):89-91.
[11]王 立,姚惠源,陈正行.乌饭树树叶中黄酮类物质的分离、纯化及结构鉴定[J].林产化学与工业,2007,27(3):122,124.
[12]王 立,姚惠源,陶冠军,等.乌饭树树叶中黄酮类色素的抗氧化活性[J].食品与生物技术学报,2006,25(4):82-84,88.
[13]王 立,姚惠源,陶冠军,等.乌饭树树叶中黄酮类色素的抗氧化活性[J].食品与生物技术学报,2006,25(4):82-84,88.
[14]魏国华,刘钟栋,许新德,等.乌饭树叶提取物的抗氧化能力探讨[J].食品与发酵工业,2006,32(12):57-59.
[15]GRICE H C.Safety evaluation of butylated hydroxyanisole from the perspective of effects on forestomach and oesophageal squamous epithelium[J].Food and Chemical Toxicology,1988,26(8):717-723.
[16]María I.Gil,Francisco A.Tomá_Barberán,Betty Hess_Pierce,Deirdre M.Holcroft,and Adel A.Kader,Antioxidant activity of pomegranate juice and its relationship with phenolic composition and pressing[J].J Agric Food Chem,2000,48:4561-4569.
[17]郝晓丽,许申鸿,杭 瑚,等.用两种方法评价四种食品抗氧化剂的抗氧化活性[J].食品化学,2003,24(2)127-129.
[18]Bors S W,Van Beek T A.Screening of plant extract for antioxidant activity,a comparative study on three testing methods[J].Photochemi Anal,2002,13(1):8.

