当归四逆汤有效成分组合对大鼠缺血再灌注模型中iNOS eNOS表达相关性的实验研究
钱国强, 蔡 川, 梁雪冰, 赵国平
(暨南大学医学院,广东广州 510632)
当归四逆汤为《伤寒论》治疗血虚寒厥之方剂,现代药理研究表明该方有抗凝、抗血栓、扩血管、镇痛抗炎的作用[1],临床运用于冻伤、血栓闭塞性脉管炎、雷诺氏综合征、冠心病、下肢动脉闭塞以及静脉血栓形成[2],目前在该方中发现了 4 种有效成分[3],且芍药苷[4-7]、阿魏酸[8]、甘草酸[9]、肉桂酸[10]均对缺血再灌注损伤有干预作用。缺血预处理(ischemic preconditioning,IP)可明显减轻随后的缺血再灌注损伤,但其机制尚有待于研究。以至于缺血与处理有关的物质腺苷、乙酰胆碱、缓激肽等均可促进eNOS诱导的一氧化氮(nitric oxide,NO)合成,提示NO可能参与了缺血预处理。本研究采用当归四逆汤有效成分单体组合进行药物缺血预处理,研究当归四逆汤缺血预处理对大鼠心肌的保护作用及其机制,以期探寻其是否与NO途径有关。
1 材料
1.1 实验动物 雄性SD大鼠32只,体质量250~300 g(购自广东省实验动物中心,许可证号SCXK(粤)2008-0002)。
1.2 试剂及器材 芍药苷、阿魏酸、甘草酸、肉桂酸(购自南京泽朗医药科技有限公司),L-NAME(sigma公司),NO ELISA试剂盒(南京建成生物工程研究所)、肌酸激酶同工酶(CK-MB)测定试剂盒(北京华宇亿康生物科技有限公司)。全自动生化分析仪(日立7020),动物呼吸机(ALC-V,
上海奥尔科特生物科技有限公司),全波长荧光扫描酶标仪(Safire 2,北京东胜创新生物科技有限公司),心电图机(生物机能实验系统,成都遨升电子公司,型号:ASB240V),PCR仪(BIO-RAD,CFD-3120)。
2 方法
2.1 模型与分组
2.1.1 心肌缺血再灌注模型建立 SD大鼠腹腔注射2%戊巴比妥钠麻醉(40 mg/kg体质量),固定后行气管切开,气管插管,连接呼吸机并给予机械通气,通气量为5 mL/100 g体质量;呼吸频率为60~80次/min,呼吸比为2∶1,予呼气末持续正压呼吸,于胸骨左缘2~4肋间打开胸腔及心包膜,暴露心脏;在肺动脉圆锥右缘、平左心耳下缘1~2 mm处,经左冠状动脉下浅层心肌穿5/0号丝线,结扎,模型复制的可靠性用连续监视ECGⅡ导联的变化来判断,以ST段抬高为心肌缺血存在,以ST段回落1/2为再灌注成功。
2.1.2 实验分组 32只大鼠分为4组(正常组,IR组,IR+药组,IR+药+L-NAME组),每组8只。正常组未经缺血再灌注处理;IR组SD大鼠心肌缺血30 min再灌注120 min后取材;IR+药组于实验前30 min灌胃,灌胃剂量为甘草酸50 mg/kg,阿魏酸 400 mg/kg,芍药苷 100 mg/kg,肉桂酸 400 mg/kg[3],再灌注120 min 取材;IR+ 药 +L-NAME 组于实验前30 min灌胃,灌胃剂量为甘草酸50 mg/kg,阿魏酸400 mg/kg,芍药苷100 mg/kg,肉桂酸400 mg/kg,并于再灌注前15 min给予 L-NAME 30 mg/kg,再灌注120 min取材。
2.2 NO检测 取血后静置30 min,4℃离心15 min,取血清按照试剂盒说明检测。
2.3 CK-MB检测 按照(CK-MB)测定试剂盒在全自动生化仪上进行。
2.4 eNOS mRNA和iNOS mRNA的测量 采用实时荧光定量法测定eNOS mRNA和iNOS mRNA的测量,以DAPDH为内参,DAPDH 引物为:5′-ACC ACA GTC CAT GCC ATC AC-3′和 5′-TCC ACC ACC CTG TTG CTG TA-3′,eNOS 引物为5′-CGA GAT ATC TTC AGT CCC AAG C-3′和 5′-GTG GAT TTG CTG CTC TCT AGG-3′,iNOS 引物设计为 5′-TCT GTG CCT TTG CTG ATG AC-3′和 5′-CAT GGT GAA CAC GTT CTT GG-3′,RNA抽提按照试剂盒说明进行,测纯度 OD260/290在1.9~2.1之间良好,按照试剂盒说明书将反应设为50 μL体系,95℃变性2 min,40循环扩增(95 ℃10 s,60 ℃ 15 s,68℃ 30 s),完成实验后数据采用2-ΔΔct分析。
2.5 统计分析方法 所有数据以均数±标准差表述,组间差异比较用单因素方差分析,两两数据比较用SNK检验。
3 结果
3.1 NO、CK-MB 检测结果 见表1。
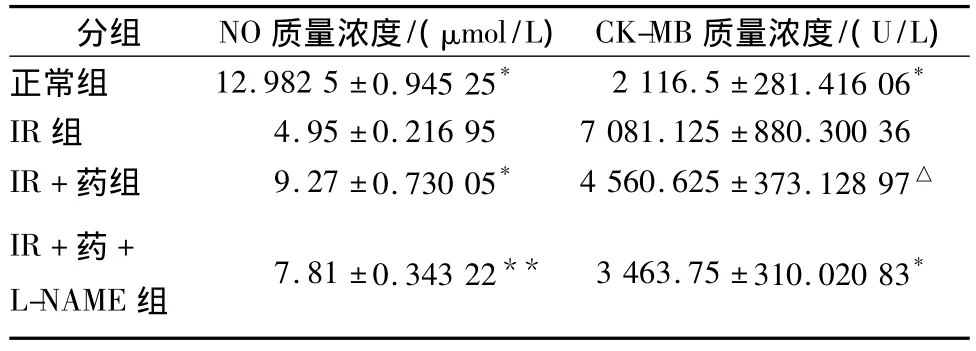
表1 测得NO、CK-MB质量浓度方差分析结果
3.2 eNOS mRNA、iNOS mRNA的测定结果 见表2。
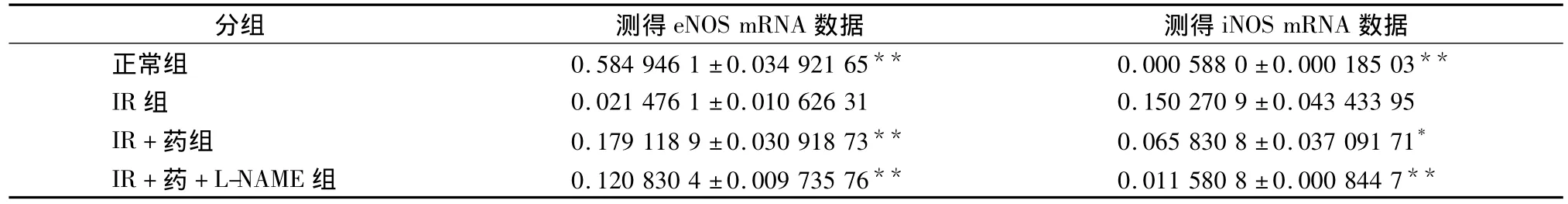
表 2 eNOS mRNA、iNOS mRNA 测得量(2 -ΔΔct)
4 讨论
1987年Palmer等[11]发现NO就是内皮源性舒张因子(endothelium-derived relaxing factor,EDRF),目前研究认为在基础状态下血管内皮细胞的NO释放对维持心血管系统处于恒定的舒张活性状态,调节血压,调节冠状动脉基础张力和心肌血流灌注有重要作用。NO使血小板中cGMP水平升高,导致胞浆游离钙进入亚细胞器而使其浓度降低,从而抑制其聚集黏附[12],在血管内皮细胞、平滑肌细胞及粒细胞中均有NO存在,在炎症时它过量产生可以使血管通透性增加,炎细胞、蛋白渗出加剧。有研究提示心肌缺血再灌注后NO生成受损,应用NO前体L-精氨酸增加NO产生,具有保护作用[11]。有研究证实 NO对缺血再灌注有保护作用[13],有研究表明一氧化氮合酶(nitric oxide synthase,NOS)抑制剂L-NAME等减少了NO的生成,并未加重损伤[14],也有研究表明减少NO生成以后,使损伤明显加重[15]。另有报道缺血-再灌注心肌NO产生大量增加,应用NOS抑制剂L-单甲基精氨(L-NMMA)和 L-硝基精氨酸甲酯(L-NAME)抑制NO的产生,能够减低心肌损伤[16],又有实验证实,缺血再灌注心肌过量NO的产生系心肌iNOS活性升高所致,过量NO参与心肌脂质过氧化,损伤心肌[17]。我们的实验研究表明,缺血再灌注的心肌iNOS表达升高,eNOS表达降低,再灌注期间NO生成减少,CK-MB生成增加。故可以认为,再灌注期间NO的产生,是基于心肌NOS同工酶的变化。本研究认为当归四逆汤有效成分组合对缺血再灌注心肌有保护作用,其保护作用通过调节iNOS mRNA和eNOS mRNA表达,调节NO生成,从而起到保护心脏的作用。
[1]苗明三,王升启.现代方剂学[M].11版.北京:清华大学出版社,2004:885.
[2]杨进平.近5年来当归四逆汤临床应用进展[J].中医药临床杂志,2008,20(5):538-540.
[3]赵 欣,谷 艳,宋欣鑫,等.HPLC法同时测定当归四逆汤中4种有效成分的含量[J].沈阳药科大学学报,2008,25(3):200-203.
[4]Tsai H Y,Lin Y T,Chen C F,et al.Effects of veratrine and paeoniflorin on the isolated rat aorta[J].J Ethnopharmacol,1999,66:249 –255.
[5]He Xihui,Xing Dongming,Ding Yi,et al.Effects of cerebral ischemia-reperfusion on pharmacokinetic fate of paeoniflorin after intravenous administration of Paeoniae Radix extract in rats[J].J Ethnopharmacol,2004,94:339 – 344.
[6]Chen Dongmei,Xiao Liang,Cai Xin,et al.Involvement of multitargets in paeoniflorin-induced preconditioning[J].J Pharmacol Expl Ther,2006,319:165-180.
[7]Kigore K S,Tanhehco E J,Park J L,et al.Reduction of myocardial infract size in vivo by carbohydrate-based glycomimetics[J].J Pharmacol Exp Ther,1998,284:427-435.
[8]Cheng Chinyi,Su Shanyu,Tang Nouying,et al.Ferulic acid provides neuroprotection against oxidative stress-related apoptosis after cerebral ischemia-reperfusion injury by inhibiting ICAM-1 mRNA expression in rats[J].Brain Res,2008,1209:136 –150.
[9]Subramanian S,Bowyer M W,Egan J C,et al.Attenuation of Renal Ischemia-Reperfusion Injury with Selectin Inhibition in a rabbit model[J].A J Surg,1999,6:573-575.
[10]陈 非,傅延龄,邹丽琰,等.肉桂酸对心缺血再灌注损伤的保护作用[J].中国医药学报,1999,14(1):68-69.
[11]Palmer R M,Ferrige AG,Moncada S ,et al.Nitric oxide release accounts for the biological activity of endothelium derived relaxing factor[J].Nature,1987 ,327:524 -526.
[12]Kayama N,Grisham M B,Kenvil C G,et al.Effect of reactive oxygen metabolites on endothelial permeability:role of Nitric oxide and iron[J].Microcirculation,1999,6(2):107,116.
[13]Vegh A,Szekeres L,Parrat J.Preconditioning of the ischemic myocardium;involvement of the L-arginine nitric oxide pathway[J].Br J Pharmacal,1992,107(3):648-652.
[14]Pabla R,Curtis M J.Effect of endogenous nitric oxide on cardiac systolic and diastolic function during ischemia and reperfusion in the rat isolated perfused heart[J].J Mol Cell Cardial,1996,28(10):2111-2121.
[15]Napoli P D,Taccardi A A,Grilli A,et al.Chronic treatment with rosuvastatin modulates nitric oxide synthase expression and reduces ischemia– reperfusion injury in rat hearts[J].Cardiovasc Res,2005,66(3):462 –471.
[16]Zhang Y,Bissing J W ,Xu L ,et al.Nitric oxide synthase inhibitors decrease coronary sinus free radical concentration and ameliorate myocardial stunning in an ischemia-reperfusion model[J].J Am Cell Cardiol,2001,38(2):5462554.
[17]Liu P,Hock C E,Nagele R,et al.Formation of nitric oxide,superoxide,and peroxynitrite in myocardial ischemia-reperfusion injury inrats[J].AmJPhysiol,1997, 272(41):H232722336.

