一大分子量香菇多糖的提取分离纯化
李石军, 张 玉, 王凯平, 郭 丹, 辜 明
(1.华中科技大学 同济医学院 药学院,湖北 武汉 430030;2.华中科技大学 同济医学院 协和医院 药剂科,湖北武汉 430030)
香菇Lentinus edodes为担子菌纲伞形科真菌,是世界上第二大食用菌。香菇多糖是香菇中最重要的一种生物活性物质,作为一种免疫促进剂,在20世纪60年代已引起人们广泛的兴趣。现代研究表明:香菇多糖具有抗病毒、抗肿瘤,调节免疫力、降血糖、抗氧化等功能。与传统中草药相比,香菇多糖通过增强机体免疫力间接杀死肿瘤细胞,因而毒副作用极小。在临床上香菇多糖主要用于抑制和防止胃癌、鼻咽癌、直肠癌、乳腺癌和慢性粒细胞病的术后微转移[1-4]。
目前,香菇多糖的提取大多采用水提-醇沉法[5],得到的粗多糖杂质较多,后期纯化较麻烦,且分子量较小,抗肿瘤活性较差。有文献报道[6],分子量在 4.0 ×105Da到 8.0 ×105Da的香菇多糖抗肿瘤活性较高。而碱提-醇沉法能得到分子量较大的香菇多糖,本实验以香菇子实体为原料,碱提-醇沉法提取粗多糖,正交试验[7-8]对香菇多糖的碱提工艺进行优化,粗多糖经脱色,去蛋白,超滤后得到分子量在4.0×105Da以上的均一香菇多糖组分,为以后的结构研究及药理药效研究打下了基础。
1 实验原料、试剂和仪器
香菇子实体(产自湖北房县),医用酒精,实验用水为蒸馏水,其它试剂均为分析纯,电磁炉,Agilent 1100高效液相色谱仪(美国Agilent公司),722s型可见光分光光度计(上海精密仪器有限公司),Fluka Dextran Standard系列葡聚糖标准品(瑞士Fluka公司)。
2 实验方法与结果
2.1 香菇粗多糖的提取 经水提过的香菇子实体再用氢氧化钠提取,碱提后用5 mol/L的醋酸调pH到7,离心弃去沉淀,上清液浓缩后醇沉得到粗多糖。
2.2 正交试验优化香菇多糖碱提工艺 选取提取温度、碱的浓度、提取时间3个因素,以多糖提取率(提取率/%=100×香菇粗多糖的质量/香菇子实体的质量)为考察指标进行3因素4水平的正交试验,对香菇粗多糖的碱提工艺进行优化。见表1。

表1 因素与水平
根据表1所列试验因素和水平,选用L16(45)正交试验表设计试验,确定碱提香菇粗多糖的最优工艺,采用苯酚-硫酸法测定糖量。实验结果见表2。
根据正交试验结果进行方差分析,见表3。
从极差R的结果来看,初步得出影响多糖提取率的主次顺序为B>C>A,因素B有显著性影响,因素A和C没有显著性影响。根据正交试验各因素的影响顺序如下:A1>A4>A3>A2,B1>B2>B3>B4,C4>C3>C2>C1。因此可初步确定香菇多糖碱提工艺的最佳条件为A1B1C4,即提取温度为35℃,碱的质量分数为5%,提取时间为24 h。
考虑到空白项的偏差平方和较大,为了提高检验的灵敏度和精确度,将检验水平取为a=0.1,对所得结果进行方差分析。从方差分析结果可知,碱的浓度是影响结果的主要因素,对多糖提取率有显著性影响;提取温度和提取时间对结果没有显著性影响。
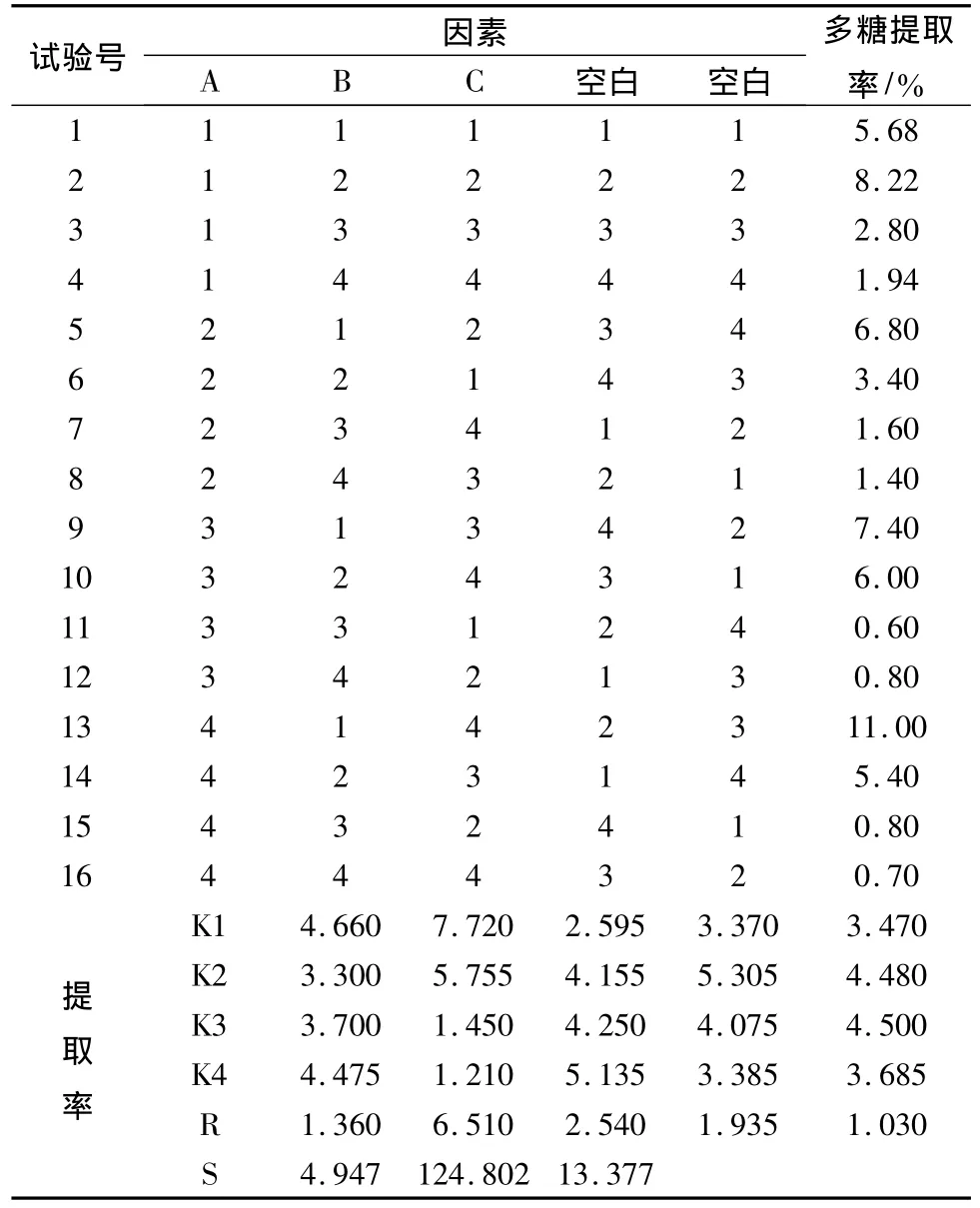
表2 碱提香菇多糖L16(45)正交试验及结果

表3 方差分析结果
考虑到温度对多糖得率影响不大,因此本实验选取在室温条件下提取粗多糖,因此确定香菇粗多糖的碱提条件为:提取温度为25℃,碱的质量分数为5%,提取时间为24 h。
2.3 香菇粗多糖的纯化 采用脱色和超滤的方法对粗多糖进行纯化,见表4。

表4 H2O2脱色实验结果
结果显示0.5%H2O2不能达到脱色和除蛋白效果,而1.8%和2.8%的H2O2能较好达到脱色和除蛋白的效果。考虑到较高浓度的H2O2会对多糖大分子产生破坏作用,因而本实验采用1.8%H2O2对粗多糖进行脱色。
超滤对脱色后粗多糖进一步纯化,超滤收集的样品经冻干后得到白色絮状精制香菇多糖。
2.4 糖的测定
2.4.1 标准曲线的绘制 采用苯酚-硫酸法[9]测定糖质量分数,以葡萄糖为对照品制备糖定量测定的标准曲线,得线性方程:A=12.542 9C-0.015 0,R2=0.999 0,C:mg/mL。
2.4.2 精制香菇多糖糖量的测定 采用苯酚-硫酸法测定超滤后样品的糖质量分数,实验数据及结果见表5。

表5 精制多糖质量分数测定实验数据
由表5可得超滤后所得产品的平均糖质量分数为95.00%,RSD 为 0.58%。
2.5 分子量测定(高效凝胶色谱法)
2.5.1 色谱条件 色谱柱:PL aquagel-OH MIXED(300 mm×7.5 mm,8 μm)。流动相:0.05 mol/LNa2SO4;体积流量:1 mL/min;标准品:葡聚糖-T系列;进样体积:30 μL;检测器:示差折光检测器;柱温:35℃。
2.5.2 分子量测定的标准曲线 以葡聚糖为标准品,0.05 mol/L Na2SO4为流动相,通过GPC软件,保留时间(min)为横坐标,分子量(Da)为纵坐标得出标准曲线,得线性方程:x为保留时间,单位min;y为分子量,单位Da。
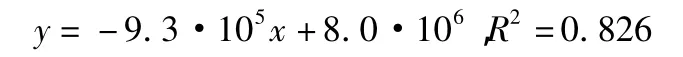
2.5.3 精制香菇多糖的分子量色谱图 采用GPC专用软件绘制各样品的示差色谱图,见图1。其中纵坐标表示信号强度(nR2u),横坐标表示保留时间(min)。根据保留时间和标准曲线,通过GPC软件即可计算出各洗脱峰对应的分子量。
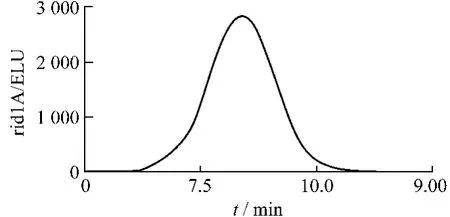
图1 超滤法所得产品色谱图
图1所示的保留时间为7.356 min,样品的重均分子量Mw:6.054×105Da。由上图可看出样品的分离纯化效果好,干扰组分少,纯度高,可认为是均一分子量的香菇多糖。
2.6 紫外扫描 以0.1 mol/L的氢氧化钠为溶剂,将多糖样品配制成1 mg/mL的溶液。将上述样品溶液在200~400 nm波长处进行紫外扫描。见图2。

图2 香菇多糖紫外扫描图
从紫外扫描图可以看出,210 nm波长处的吸收峰为多糖类物质的特征吸收峰;此外,在280 nm以及260 nm处没有吸收峰,表明样品中不含蛋白质和核酸[10]。
3 讨论
本实验采用碱提-醇沉法从小冬菇中提取香菇粗多糖,香菇子实体先经水提处理,弃去水提液,然后再用碱提,得到的粗多糖颜色较浅,色素等杂质较少,为后续的纯化工作减轻了负担。由于分子量大的香菇多糖水溶性差,不易由水提-醇沉法得到,因此采用碱提-醇沉法。并为得到抗肿瘤活性较好的香菇多糖提供了保证。
通过正交试验对碱提工艺进行优化,最佳提取条件为:提取温度为25℃,碱的质量分数为5%,提取时间为24 h。
香菇粗多糖的纯化采用H2O2脱色和超滤法分离,得到的香菇多糖经糖定量测定、分子量色谱图和紫外扫描分析,纯化后的香菇多糖为均一组分多糖,不含蛋白质和核酸。
因此本实验采用碱提-醇沉法提取分子量在4.0×105Da以上香菇多糖的工艺是可行的,且纯化工艺简单、有效,为以后对香菇多糖的结构分析和药理药效研究奠定了基础。
[1]曲章义,牛美娟,郭彩玲.香菇多糖抗肿瘤作用的机理[J].中国食用菌,1997,16(5):3-4.
[2]边洪荣,李小娜,张海岚.香菇有效成分提取分离及分析方法研究进展[J].中草药,2002,33(9):附1-附2.
[3]王卫国,赵永亮.香菇多糖分离最佳工艺及最佳原料探讨[J].中草药,2000,31(8):584-585.
[4]Borchers L,Keen CL,Gershwin ME,et al.Mushrooms,tumors,and immunity:an Update[J].Exp Bio Med,2004,229(5):393-406.
[5]Ng ML,Yap AT,Inhibition of human colon carcinoma development by lentinan from shiitake mushrooms(Lentinus edodes)[J].Altem Complement Med,2002,8(5):581-589.
[6]Takshi M.A development of antitumor polysaccharides from mushroom fungi[J].Food Ingredients.1996, 167;69.
[7]田光辉.香菇多糖提取工艺的优化[J].延安大学学报,2002,21(2)46-47.
[8]张红旭,郭 辉.特定分子量范围内香菇多糖的分离研究[J].中国药房,2006,17(8):575-576.
[9]陈占立,孙爱平,石润波.正交试验探讨广藿香挥发油的最佳提取条件[J].中国医院药学杂志,2009,29(6)467-469.
[10]张 玉,戴立泉,王凯平.正交试验优化当归多糖铁的合成条件研究[J].中成药,2007,29(4):581-583.
[11]王宏洁;李鹏跃,刘 婷.苯酚-硫酸法测定清开灵注射液中总多糖的含量[J].中国实验方剂学杂志,2009,15(11):3-5.
[12]蒋秀红,王 霆,崔永霆.制何首乌多糖的纯度鉴定和理化性质研究[J].中国现代药物应用,2009,3(24):6-8.

