水飞蓟宾乳脂体注射剂在大鼠体内的药代动力学
陈洪轩, 周晓丹, 陈志鹏
(1.黄河科技学院,河南郑州 450000;2.河南大学药物研究所,河南开封 475004;3.甘肃省人民医院,甘肃兰州 730000;4.南京中医药大学 药学院,江苏 南京 210046)
水飞蓟宾(silibinin or silybin,SIL)是菊科植物水飞蓟Silybam marianum(L.)Gaertn果实中提取的黄酮木脂类化合物的最主要成分[1],水飞蓟宾能够稳定肝细胞膜,保护肝细胞的酶系统,清除肝细胞内的活性氧自由基,从而提高肝脏的解毒能力,避免肝细胞在长期接触毒物、服用肝毒性药物、吸烟、饮酒等情况下受到的损伤,是疗效确切的肝损伤修复药。研究表明,水飞蓟宾还具有良好的治疗高脂血症、消除自由基、抗肝脂质过氧化、抗缺血再灌注损伤作用。临床上用于治疗急慢性肝炎、肝硬化及中毒性肝损伤[2-4]。由于水飞蓟宾难溶于水,口服吸收差,严重削弱了水飞蓟口服制剂的药效。将其制成水溶性的葡甲胺盐[5]、磷脂复合物[6]、固体分散体[7],可以提高生物利用度。也有科研工作者将其制成水飞蓟宾葡甲氨盐注射剂,但其水溶液不稳定,极易发生降解,制备成冻干粉针虽然可以解决其放置稳定性问题,但是水飞蓟宾葡甲氨盐水溶液的pH值在11左右,注射时局部刺激性较大[8]。乳脂体(emulsome)是1994年Pharmos公司发明的新技术,是新一代的载体系统,中心由甘油三酯组成脂肪核,外周具有一层或多层磷脂层。由于具有脂肪核,类似普通的o/w乳剂,外周又被磷脂层稳定,类似脂质体。它兼具有脂质体和乳剂的特点,可作为亲脂性药物和亲水性药物的载体。研究表明,乳脂体作为药物载体,具有提高生物利用度、缓控释作用[9]、靶向和降低毒性[10-11]、稳定性高、促进药物溶出等作用。本研究将水飞蓟宾制成乳脂体注射剂,以提高水飞蓟宾的生物利用度,并使水飞蓟宾具有一定的缓释作用。本实验考察了水飞蓟宾乳脂体注射剂在大鼠体内的药代动力学特征。
1 仪器与材料
1.1 仪器 高效液相色谱仪(SPD-6A紫外检测器、LC-5A型高压泵、7125进样阀20 μL样品管,Japan);RE-52AA型旋转蒸发器(上海亚荣生化仪器厂);SHB-III型循环水式多用真空泵(郑州长城科工贸有限公司);JY92-IIN型超声波细胞粉碎机(宁波新芝生物科技股份有限公司);Zetasizer 3000HS激光粒度分析仪(Malvern公司);LG16-W高速离心机(北京医用离心机厂)。
1.2 药品及试剂 SIL原料药(盘锦格林恩生物资源开发有限公司,含量98%);SIL对照品(中国药品生物制品检定所);Sephadex G-50(台州市路桥四甲生化塑料厂);注射用大豆磷脂(上海太伟药业有限公司,纯度>92%);三月桂酸甘油酯(东京化成工业株式会社);胆固醇(中国医药集团);甲醇(山东禹王实业有限公司化工分公司,色谱纯);乙腈(上海陆都化学试剂厂,色谱纯);肝素钠(天津市生物化学制药厂)。
1.3 动物 Wistar大鼠,雄性,体质量280~300 g,由河南省动物实验中心提供,为清洁级。
2 实验方法
2.1 水飞蓟宾乳脂体注射剂的制备[12]定量称取大豆磷脂、三月桂酸甘油酯、胆固醇和SIL溶于适量三氯甲烷中,旋转蒸发除去有机溶剂至形成干膜。加入适量PBS振摇水合至形成均一的分散液。超声使粒径达到要求。
2.2 水飞蓟宾乳脂体粒径和Zeta电位的测定 取水飞蓟宾乳脂体混悬液适量,用激光粒度分析仪测量样品的平均粒径和Zeta电位。
2.3 水飞蓟宾乳脂体包封率的测定 采用葡聚糖凝胶(Sephadex G-50)柱层析法分离未包封药物。精密吸取水飞蓟宾乳脂体混悬液0.5 mL上柱分离,
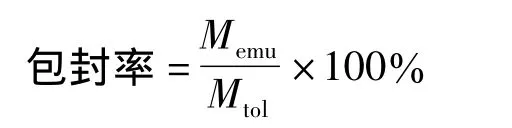
Memu为乳脂体中所包封水飞蓟宾的量,Mtol为乳脂体混悬液中所含的水飞蓟宾的量。
2.4 药动学研究
法治是人类治国理政智慧的结晶,也是我国历史经验教训的科学总结。“枫桥经验”发展,从社会改造和帮教到社会治安综合治理,再到社会管理创新,走上法治化征途,既是必然的选择,也是实践的努力。法院作为“枫桥经验”的践行者和法治建设的生力军,在其中发挥了应有作用。
2.4.1 色谱条件[13]色谱柱:Kromasil C18(250 mm ×4.6 mm,5 μm,大连依利特);预柱:C18(20 mm×4.6 mm,5 μm)(天津特纳科学仪器公司);流动相:甲醇-水-冰醋酸溶液(50∶50∶1),用前分别经0.2 μm 滤膜过滤,超声混匀备用;体积流量:1.0 mL/min;检测波长:288 nm;进样量:20 μL。
2.4.2 血浆样品的处理 精密移取血浆样品100 μL,置于1.5 mL的塑料离心管中,加入乙腈100 μL,涡旋30 s,15 000 r/min 离心5 min,取上清液进样20 μL,记录色谱峰面积。
2.4.3 标准曲线的制备 精密称取6.25 mg的SIL,置于25 mL量瓶中,用甲醇溶解并定容,配制成质量浓度为250 μg/mL的贮备液,分别移取此溶液适量置10 mL量瓶中,用甲醇稀释至刻度,配成水飞蓟宾质量浓度分别为 2、5、10、20、50、125、250 μg/mL的标准品溶液。分别精密移取以上各标准品溶液2 μL至98 μL的空白血浆中,再加入乙腈100 μL,按血浆样品的处理方法操作,得到质量浓度分别为 0.02、0.05、0.1、0.2、0.5、1.25、2.5 μg/mL 的标准品溶液,按血浆样品的处理方法操作,以峰面积(A)对质量浓度(C)作图,得到线性回归方程。
2.4.4 回收率和精密度实验 在空白大鼠血浆中加入SIL标准品溶液,使其质量浓度分别为0.05、0.20、1.25 μg/mL,按“血浆样品的处理”操作,计算测得量,与实际加入量比较,计算回收率。分别在日内进样5次;同时连续5日,计算日内和日间精密度。
2.4.5 SIL乳脂体大鼠药动学研究 12只大鼠随机分成两组,每组6只,均按照3.8 mg/kg的剂量给药,第1组尾静脉注射SIL乳脂体,第2组尾静脉注射SIL自配的溶液剂(精密称取水飞蓟宾标准品5 mg,置10 mL量瓶中,再加入4 mL PEG400,水补至10 mL,0.22 μm 滤膜过滤即得制备成 0.5 mg/mL以PBS为洗脱液洗脱,分管接收洗脱液,含乳脂体的接收液合并后以甲醇破乳,稀释至一定浓度后,测得乳脂体中所包封的水飞蓟宾的量Memu,另吸取水飞蓟宾乳脂体混悬液,测得水飞蓟宾乳脂体混悬液中所含的水飞蓟宾的量Mtol,按以下公式计算包封率:水飞蓟宾溶液剂),给药后分别于 2、5、10、15、30、45、60、90、120、240 min 时间取点,按“血浆样品处理”操作后进样测定,代入标准曲线计算SIL的血药浓度,血药浓度-时间数据经3p97药动学计算程序处理。
3 结果
3.1 水飞蓟宾乳脂体粒径、Zeta电位和包封率
测得水飞蓟宾乳脂体平均粒径为364.1 nm,且粒径分布均匀。Zeta电位为-34.1 mV。测得水飞蓟宾乳脂体的包封率为82.5%。
3.2 体内方法学验证
3.2.1 方法专属性考察 由图1可见,在此液相条件下,水飞蓟宾分离得到水飞蓟宾A(1)和水飞蓟宾B(2)两个峰。水飞蓟宾两个峰均能达到基线分离且峰形稳定,保留时间约为 15.2 min、17.5 min。血浆中杂质不干扰样品的测定。

图1 大鼠血浆HPLC图
3.2.3 回收率和精密度实验 由表1可知,大鼠血浆3种质量浓度各质量浓度点测得的平均值偏离实际加入量均小于15%,定量限附近 RSD%小于20%,可满足生物样品测定要求。

表1 水飞蓟宾在大鼠血浆中的回收率 (n=3)
由表2可知,大鼠血浆3种质量浓度日内、日间精密度RSD%均小于15%,定量限附近RSD%小于20%,满足生物样品分析方法要求。
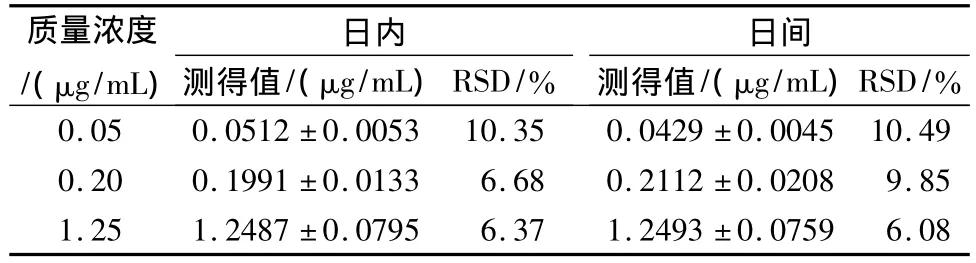
表2 精密度实验 (n=5)
3.3 药动学结果分析
3.3.1 血药浓度-时间曲线 大鼠分别尾静脉注射SIL溶液剂和SIL乳脂体后的血药浓度-时间曲线见图2。

图2 SIL溶液和乳脂体大鼠静脉给药后的血药浓度-时间曲线图 (n=6)
3.3.2 药代动力学研究 分别将水飞蓟宾乳脂体和水飞蓟宾溶液剂的血浆药物浓度-时间数据代入中国药理学会推荐的3p97程序,以AIC和拟合优度(r2)为判别指标,确定血药浓度隔室模型。以1为权重对数据进行模型嵌合,结果,二种制剂均符合二室模型,其相关药代动力学参数见表3。
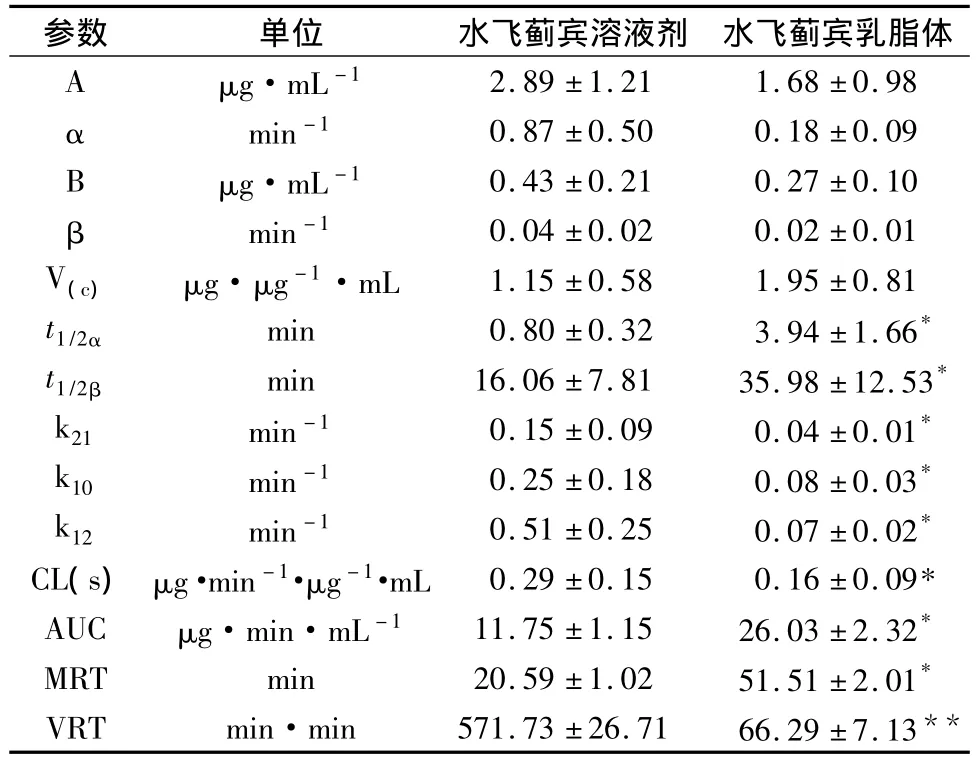
表3 SIL溶液剂和乳脂体大鼠体内的药动学参数 (n=6)
从二者的药代动力学参数可知,将SIL包封于乳脂体中能明显改善其体内药动学,与自制的SIL溶液剂相比,t1/2β、CL、AUC、和 MRT 均有显著性差异。
4 讨论
4.1 本实验成功地采用薄膜分散法制备了SIL乳脂体,结果表明,采用薄膜分散法制得的乳脂体为淡蓝色略透明的混悬液。平均粒径为364.1 nm,且粒径分布均匀。Zeta电位为-34.1 mV。包封率为82.5%。
4.2 天然或合成的水飞蓟宾并非单一化合物,而是一对非对映异构体(水飞蓟宾A和水飞蓟宾B)的混合物,且它们都具有药理活性,为了便于计算,将水飞蓟宾A和水飞蓟宾B两个峰的峰面积之和作为定量用。
4.3 本研究制备了注射用水飞蓟宾乳脂体,大大提高了水飞蓟宾的生物利用度。
4.4 本研究建立了HPLC测定大鼠血浆中SIL的含量,应用本方法,研究了大鼠尾静脉分别注射SIL乳脂体和SIL溶液剂后,其血浆中的药物浓度,由大鼠体内药代动力学测定结果表明,二种制剂均符合二室模型。以乳脂体作为SIL的载体制备静脉注射制剂,与自制的 SIL溶液剂相比,t1/2β、CL、AUC 和MRT均有显著性差异。t1/2β由16.06 min延长到35.98 min,CL 由 0.29 mL/min 减小到 0.16 mL/min、AUC 增大2.22 倍,MRT 增大 2.51 倍,提示水飞蓟宾乳脂体改变了水飞蓟宾的体内消除,显著延长水飞蓟宾的体内循环时间。是因为本实验制得的乳脂体,中心具有固体或者半固体的疏水核,外周又被磷脂层稳定,水飞蓟宾等亲脂性药物能被高浓度地包裹入疏水核中,使药物的释放需克服疏水核和磷脂层的双重屏障,具有缓控释作用。
4.5 试验分别采用甲醇沉淀法和乙腈沉淀法,结果表明,乙腈对蛋白的沉淀作用优于甲醇,药物回收率高。
4.6 本研究用一种简单的方法制备了具有多重优点的SIL乳脂体注射剂,为SIL临床用药提供一种高疗效的制剂品种。
[1]Jose F,Alvarez B.Extraction of nutraceuticals from milk thistle[J].Appl Biochem Biotechnol,2003,108(10):105-108.
[2]于乐成,顾长海.水飞蓟素药理学效应研究进展[J].中国医院药学杂志,2001,21(8):493-494.
[3]Wu J,Zern M A.Hepatic stellate cells:a target for the treatment of liver fibrosis[J].J Gastroenterol,2000,35(9):665-672.
[4]Giacomelli S,Gallo D,Apollonio P.Silybin and Its Bioavailable Phospholipid Complex(IdB 1016)Potentiatein vitroandin vivothe Activity of Cisplatin[J].Life Sci,2002,70(12):1447.
[5]林建广,周 忠,王 超.水飞蓟宾葡甲胺的结构与溶解性[J].天然产物研究与开发,2009,21(2):214-216.
[6]肖衍宇,宋赞梅,陈志鹏.水飞蓟宾磷脂复合物的制备与大鼠生物利用度的研究[J].药学学报,2005,40(7):61l-617.
[7]邓 莉,邹 豪,蒋雪涛.水飞蓟宾固体分散体的制备及体外溶出研究[J].第二军医大学学报,2000,21(10):961-965.
[8]宋赞梅,平其能,吴正红.水飞蓟宾纳米乳的制备及家兔体内药动学[J].中国药科大学学报,2005,427(5):431.
[9]Gupta S,Vyas S P.Development and characterization of amphotericin B bearing emulsomes for passive and active macrophage targeting[J].J Drug Target,2007,15(3):206-217.
[10]Vyas S P,Subhedar R,Jain S.Development and characterization of emulsomes for sustained and targeted delivery of an antiviral agent to liver[J].J Pharm Pharmacol,2006,58(3):321-326.
[11]Gupta S,Dube A,Vyas S P.Antileishmanial efficacy of amphotericin B bearing emulsomes against experimental visceral leishmaniasis[J].J Drug Target,2007,15(6):437-444.
[12]平其能.现代药剂学[M].北京:中国医药科技出版社,1998:598.
[13]李凤前,胡晋红,朱金刚.水飞蓟宾固体分散体中总黄酮的测定[J].中草药,2002,33(1):31-33.

