夹带剂对穿心莲内酯超临界萃取的影响
尹文红, 陈克勋
(1.山东理工大学机械工程学院材料成型及控制工程系,山东淄博 255049;2.山东理工大学化学工程学院,山东淄博 255049)
穿心莲为爵床科植物穿心莲Andrographis paniculata(Barm.f.)Nees的干燥地上部分。具有清热解毒、凉血消肿的功效。穿心莲有效成分为二萜内酯和黄酮化合物,其中穿心莲内酯(Andrographolide)类化合物临床上用于治疗急性肠胃炎、扁桃体炎、肝炎和抗癌[1-2]等。穿心莲内酯的高效分离纯化是提高穿心莲药草附加值的重要渠道。
近年来,消费者更加关心有机溶剂的使用情况,更倾向于使用无添加剂的自然产品。近十年来,超临界流体萃取(SFE),尤其超临界CO2(SC-CO2)萃取这种绿色技术在天然产物提取方面收到了越来越多的关注[3]。
超临界流体(SCFs)具有很多特性,如高扩散能力、低黏度和高可压缩性等,从而使其成为工业过程备受欢迎的溶剂。SC-CO2由于其无毒、不可燃、价廉易得、临界温度接近室温等优点而成为最有吸引力的超临界流体。然而,CO2也有缺点,比如它溶解强极性物质的能力低,溶质选择性差等,从而使得其应用受到限制。很多研究表明,极性夹带剂的加入能够在很大程度上提高强极性有机化合物在非极性超临界流体中的溶解度[4-10]。一些夹带剂使用比较广泛,如甲醇和乙醇,这是拓宽超临界流体应用范围的有效方法,因而很多这方面文献也不足为奇,而选择夹带剂就成为关键问题。由于性质相对安全和清洁,水和乙醇比其他有机溶剂作为夹带剂更有吸引力。
本实验旨在研究超临界CO2萃取过程中夹带剂对穿心莲内酯原材料(含穿心莲内酯30%)纯度的影响。
1 原料和方法
1.1 样品和试剂 穿心莲内酯原材料(含穿心莲内酯30%)由安徽拓峰公司提供,穿心莲内酯标准品(纯度≥99%)由中国药品生物制品检定所提供,CO2(纯度≥99.5%)由淄博特种气体公司提供,乙醇(纯度≥99%)、乙酸(纯度≥99%)和色谱级溶剂均购于上海分析试剂厂。
1.2 设备 压缩机由北京第一机械工具厂生产,不锈钢结晶器的长和内径分别为30 cm和10 cm,结晶器的容积为2.36 L。两个分离器容积均为2 L,气体缓冲器1.5 L,使用转子流量计。
1.3 实验过程 图1为超临界萃取的工艺流程。萃取器中填充经过称重后的穿心莲内酯原材料,关闭出口阀,通入CO2直至达到所要求压力和温度。几分钟后,为达到萃取其中的平衡,打开出口阀,压力自动调节到规定值。分离器温度为50℃,压力5.0 MPa,从而使得晶体具有良好的流动性。CO2循环使用,在萃取过程的终端和卸压过程中,有少量CO2损失。每批实验重复4次。
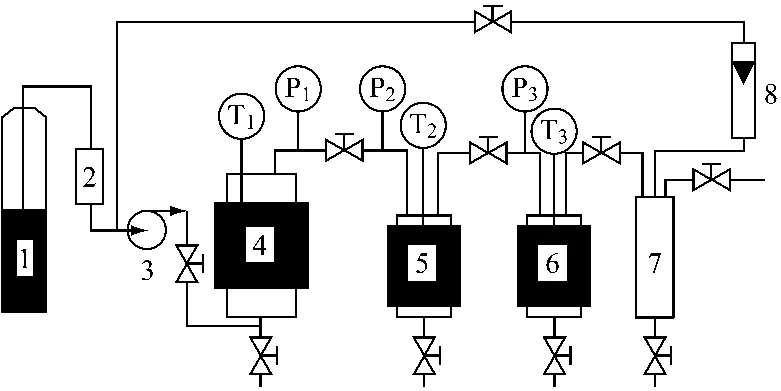
图1 实验流程图1.CO2钢瓶 2.过滤器 3.压缩机 4.萃取器 5和6.分离器7.气体缓冲器 8.转子流量计 P1,P2,P3—压力计 T1,T2,T3—温度传感器Fig.1 Extraction set-up.1.CO2cylinder 2.filter 3.compressor 4.extractor 5,6.separators 7.gas buffer 8.rotor flowmeter P1,P2,P3—manometer T1,T2,T3—temperature transducer
1.4 穿心莲内酯纯度的测试
1.4.1 色谱条件 HPLC系统(美国 Agilent,HP1100型),包括515型输液泵、2487紫外双光束检测器、Rheodyne7725i型手动进样器和 Millennium32化学工作站;色谱条件:Waters Symmetryshield 5 μm C18柱(3.9 mm × 150 mm)色谱柱,甲醇-水(65% ~35%)为流动相,体积流量:1.00 mL/min,检测波长205 nm。
1.4.2 穿心莲内酯标准曲线 精密称取穿心莲内酯标准品,用甲醇溶解并定容摇匀,配置质量浓度为1 mg/mL的标准品溶液。将该溶液进行稀释,得到质量浓度分别为 0.10、0.15、0.20、0.25、0.30 mg/mL的稀释液。取样 10 μL,采用 1.4.1 项的色谱条件进行测试。以色谱峰的面积为纵坐标,实际进样量(μg)为横坐标进行线性回归。穿心莲内酯在0.10~1.31 μg范围内与峰面积呈线性关系,回归方程为:Y=20 852X+324.6,r=0.999 5。
1.5 晶体表征 采用扫描电子显微镜(SEM)和X-射线粉末衍射(XRD)技术对所萃取样品进行表征。1.6 实验设计 为研究夹带剂对萃取过程的影响,首先考察夹带剂含量为5%时,压力(8、16、24 MPa)和温度(40、55、70℃)的影响,再改变夹带剂的用量如下:乙醇(5%、10%、15%);水(5%、10%、15%);乙酸(5%、10%、15%)。
2 结果与讨论
2.1 温度和压力对穿心莲内酯晶体纯度的影响
首先在加入夹带剂和不加夹带剂两种情况下,考察不同温度(40、55、70 ℃)和不同压力(8、16、24 MPa)时的萃取情况,以找出晶体最高纯度的条件。不同条件下经过超临界CO2萃取所得穿心莲内酯晶体的纯度如表1所示。晶体纯度随着温度和压力的升高而增大,但温度的影响更为明显。不加夹带剂时,在所研究的温度和压力范围内,穿心莲内酯晶体的纯度从45.8%变化到59.9%,在最高温度(70℃)和最高压力(24 MPa)时所得晶体的纯度最高。随着压力增加,从穿心莲内酯原材料中溶解穿心莲内酯晶体的能力增大,从而所得晶体的纯度提高。晶体纯度随着温度的升高而增大的原因是由于温度的增加导致溶质蒸汽压增大。虽然随着温度的升高,超临界CO2密度减小,但溶质蒸汽压增大的趋势大于密度的减小,而且这个结果也使得晶体纯度提高。或者说,温度升高使颗粒单元结构遭到破坏[11],使得SC-CO2更容易渗透到颗粒单元而从原材料中溶解析出。

表1 不同温度(40~70℃),不同压力(8~24 MPa),加入和不加夹带剂对晶体纯度的影响Tab.1 The purity of andrographolide crystal by SC-CO2extraction with and without the addition of three kinds of entrainers(5%)at different temperatures(ranging from 40-70℃)at different pressure(ranging from 8-24 MPa)
2.2 夹带剂的影响 夹带剂的影响与所萃取溶质的性质有关[12],因而选择夹带剂的首要因素是考虑目标物质在改性后的CO2流体中的溶解度[13]。选择夹带剂的另一方面因素是考虑夹带剂对原材料的溶胀作用,所选夹带剂应使得CO2易于渗透到原材料里面,从而达到萃取目标物质的目的[14]。考虑到无毒这一特性,本实验选择的夹带剂为乙醇、水和乙酸,研究在不同温度和不同压力条件下的影响。夹带剂的加入使得晶体的纯度提高,和纯CO2相同,无论加入哪种夹带剂,都是在最高温度(70℃)和最高压力(24 MPa)时得到的晶体纯度最高。单一夹带剂5%对晶体纯度的影响与原材料和溶质的性质有关,其对晶体纯度的提高能力遵循以下规律:乙酸>乙醇>水,乙酸具有最大影响。少量夹带剂的加入能够提高SC-CO2的溶解能力,这与夹带剂在超临界相中的含量有关。
在所研究的3种夹带剂中,水的极性最大,乙醇的极性最小。穿心莲内酯是一种低极性有机化合物,乙酸的极性处于所研究的三种夹带剂中间,因而当使用乙酸作为夹带剂时效果最好。
2.2.1 乙醇作为夹带剂的影响 当乙醇用量从5%增加到15%时,晶体纯度分别增加到66.5% ~75.9%(温度40 ℃)以及70.4% ~85.2%(温度70℃)(表2所示)。乙醇用量从10%增加到15%时使得晶体纯度增加的程度高于用量从5%增加到10%时使得晶体纯度增加的程度,温度为40℃时,前者增加6.0%而后者增加3.4%。

表2 乙醇、水和乙酸作为夹带剂,不同用量时对穿心莲内酯晶体纯度的影响(压力为24 MPa)Tab.2 Effects of different concentrations of ethanol,water,and acetic acid as entrainers on the purity of andrographolide(Pressure is 24 MPa.)
必须注意,大量夹带剂的加入将会改变混合物的临界参数[13]。高密度夹带剂的加入和SC-CO2分子在夹带剂周围的聚集,使得SC-CO2的堆密度增大[15]。夹带剂可能稀释了萃取物质,降低其黏度,因而提高了萃取物流经萃取器的速率。
2.2.2 水作为夹带剂的影响 在压力为24 MPa,温度分别为40℃和70℃时,研究了水作为夹带剂(质量分数分别为5%、10%和15%)的影响。随着水量的增加,晶体纯度明显增大(表2所示)。当水量从5%增加到15%、温度为40℃时,所得晶体的纯度从63.2%增加到72.1%,温度为70℃时,晶体纯度从68.9%增加到82.7%。与乙醇作为夹带剂相似,温度为70℃时夹带剂的影响比温度为40℃时的影响更明显。然而,过度增加水量将导致机械阻力,如阀门阻塞[14],这是由于含水量高将导致材料传质困难。
水在 SC-CO2中只能溶解 0.3%[16],然而在超临界SC-CO2的应用中经常用到水作为夹带剂。由于水能溶胀原材料使其开孔,因而水的存在可以增加萃取质-夹带剂-原材料之间的作用力,使得流体更易于与萃取质接触,从而将萃取质从原材料中带出。Hubert和Vitzthum[17]报道,从烟草中萃取尼古丁时必须有水存在。
2.2.3 乙酸作为夹带剂的影响 当乙酸由5%增加到10%,温度为40℃时,所得晶体的纯度从68.6%增加到73.8%,温度为70℃时,晶体纯度从80.8%增加到87.1%。而当乙酸由10%增加到15%,温度为40℃时,所得晶体的纯度从73.8%下降到69.4%,温度为70℃时,晶体纯度从87.1%下降到81.0%。乙酸是穿心莲内酯的良溶剂,当乙酸作为夹带剂时,它可以增加萃取物质在超临界流体中的溶解能力,因而选择乙酸作夹带剂比乙醇和水作夹带剂的影响更显著。乙酸为15%时使得晶体纯度有所下降的原因可能是由于乙酸在SC-CO2中的溶解能力有限,因而过量乙酸将堵塞原材料的空隙。
2.3 晶体表征
2.3.1 晶体形貌 图2a-c所示分别为选择乙醇、水和乙酸为夹带剂所得穿心莲内酯晶体的SEM图片,可以看出,所得晶体均是柱状,当选择乙酸作夹带剂时,所得晶体尺寸最小(图2c所示)。

图2 不同夹带剂时所得穿心莲内酯晶体的SEM图片a.乙醇作夹带剂 b.水作夹带剂 c.乙酸作夹带剂其他实验条件为:温度70℃,压力24 MPa,夹带剂为15%Fig.2 SEM photomicrographs of andrographolide crystals extracted with different entrainersa.ethanol as entrainer b.water as entrainer c.acetic acid as entrainer.Other experimental conditions:temperature 70℃,pressure 24 MPa,the amount of entrainer 15%
2.3.2 晶体的X-射线衍射 见图3。穿心莲内酯晶体的内部结构用X-射线粉末衍射技术进行表征,XRD图谱可以反映结晶度和结晶取向,XRD图谱的形状反映晶体内部分子的规则排列。本实验中XRD图谱主要用于研究夹带剂的影响。夹带剂的变化将直接影响晶体结晶过程中的成核和长大速率,从而可能导致晶体分子产生不同的排列方式。图3中曲线a-c分别为使用夹带剂为乙醇、水和乙酸时所得晶体的XRD图谱,可见不同夹带剂所得晶体的图谱不同。XRD图谱中,可以用衍射峰的强度来衡量结晶度的大小[18]。a、b、c 3条衍射曲线衍射峰的强度分别为17 617、25 180和39 193。曲线c,当乙酸作为夹带剂时,具有最大衍射峰强度,也就是说,当选择乙酸作为夹带剂时,所得晶体具有最大结晶度,这与SEM的结果一致。
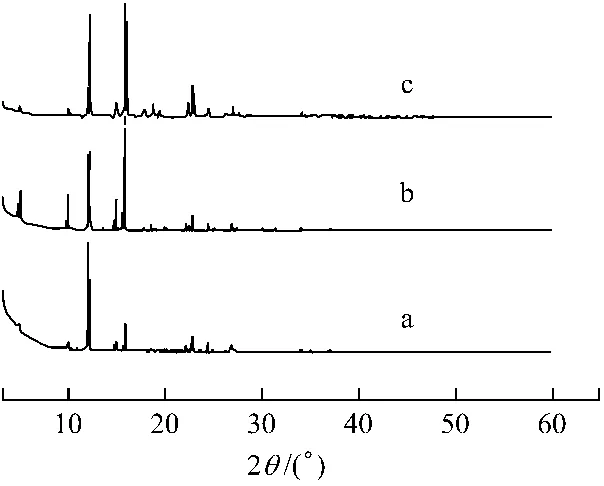
图3 不同夹带剂时所得穿心莲内酯晶体的XRD图谱a.乙醇作夹带剂 b.水作夹带剂 c.乙酸作夹带剂其他实验条件为:温度70℃,压力24 MPa,夹带剂为15%Fig.3 XRD patterns of andrographolide crystals extracted with different entrainersa.ethanol as entrainer b.water as entrainer c.acetic acid as entrainer.Other experimental conditions:temperature 70℃,pressure 24 MPa,the amount of entrainer 15%
3 结论
使用乙醇、水和乙酸作为夹带剂提高了穿心莲内酯晶体的纯度,夹带剂的加入量与温度(40到70℃)和压力(8到24 MPa)有关,在温度为70℃,压力为24 MPa时效果最好。相同条件下,夹带剂的影响效果遵循以下规律:乙酸>乙醇>水。当夹带剂为15%,在温度为40℃和70℃时均具有最好效果,但乙酸作为夹带剂,在温度为70℃时晶体纯度稍有下降。当乙酸作为夹带剂时,SEM图显示晶体具有最小尺寸,而XRD图谱显示晶体具有最大结晶度。
[1]Kapil A,Koul I B,Banerjee S K,et al.Antihepatotoxic effects of major diterpenoid constituents of Andrographis paniculata[J].Biochem Pharm,1993,46(1):182-185.
[2]胥佩菱.抗癌药物合成设计[M].北京:北京医科大学和中国协和医科大学出版社,1991:7.
[3]O’Day D M,Rosenau J R.Solvent extraction of carotenoids from alfalfa[J].Trans ASAE,1982,25:515-519.
[4]Koga Y,Iwai Y,Hata Y,et al.Influence of cosolvent on solubilities of fatty acids and higher alcohols in supercritical carbon dioxide[J].Fluid Phase Equilibr,1996,125:115-128.
[5]Johannsen M,Brunner G.Measurements of solubilities of xanthines in supercritical carbon dioxide+methanol[J].J Chem Eng Data,1995,40:431-434.
[6]Gurdial G S,Macnaughton S J,Tomasko D L.Influence of chemical modifiers on the solubility of o- and m-hydroxybenzoic acid in supercritical carbon dioxide[J].Ind Eng Chem Res,1993,32:1488-1497.
[7]Lemert R M,Johnston K P.Chemical complexing agents for enhanced solubilities in supercritical fluid carbon dioxide[J].Ind Eng Chem Res,1991,30:1222-1231.
[8]Walsh J M,Ikonomou G D,Donohue M D.Supercritical phase behavior:the entrainer effect[J].Fluid Phase Equilibr,1987,33:295-314.
[9]Foster N R,Singh H,Yun S L J,et al.Solubility of cholesterol in supercritical ethane and binary gas mixtures containing ethane[J].Ind Eng Chem Res,1993,32:2849-2853.
[10]Ke J,Mao C,Zhong M H,et al.Solubilities of salicylic acid in supercritical carbon dioxide with ethanol cosolvent[J].J Supercrit Fluids,1996,9:82-87.
[11]Machmudah S,Shotipruk A,Goto M,et al.Extraction of astaxanthin from Haematococcus pluvialis using supercritical CO2and ethanol as entrainer[J].Ind Eng Chem Res,2006,45:3652-3657.
[12]Walsh J M,Ikonomou G D,Donohue M D.Supercritical phase behaviour:the entrainer effect[J].Fluid Phase Equilibr,1987,33:295-314.
[13]Pourmortazavi S M,Hajimirsadeghi S S.Supercritical fluid extraction in plant essential and volatile oil analysis[J].J Chromatogr A,2007,1163:2-24.
[14]Casas L,Mantell C,Rodríguez M,et al.Martínez de la Ossa E.,Effect of the addition of cosolvent on the supercritical fluid extraction of bioactive compounds from Helianthus annuus L.[J].J Supercrit Fluids,2007,41:43-49.
[16]Lehotay S J.Supercritical fluid extraction of pesticides in foods[J].J Chromatogr A,1997,785:289-312.
[17]Hubert P,Vitzthum O G.Fluid extraction of hops,spices and tobacco with supercritical gases[J].Angew Chem Int Ed,1978,17:710-715.
[18]Kishishita A,Kishimoto S,Nagashima N.Characterization of organic crystal products[J].J Cryst Growth,1996,167:729-733.

