白头翁汤治疗炎症性肠病的分子机制研究*
陆树文,刘红菊,赵 伟,李 莉,顿桓桓,梁 超△
(1.成都中医药大学,四川 成都 610075;2.中国航天员科研训练中心,北京 100094)
炎症性肠病(inflammatory bowel disease,IBD)是一种慢性非特异性胃肠道炎症性疾病,主要包括溃疡性结肠炎(ulcerative colitis,UC)与克罗恩病(crohn's disease,CD),是胃肠道中除恶性病变最严重的疾病之一。这种疾病通常反复发作,迁延不愈,可有腹痛、腹泻、体重减轻、粘液血便等表现。IBD西医的传统治疗着眼于控制活动性炎症和调节免疫紊乱,但长期药物维持使用,其价格昂贵,一般人难以承受。本病属中医“痢疾”、“肠癖”、“肠风”、“泄泻”、“脏毒”等范畴,中医使用白头翁汤治疗具有临床疗效好、复发率低、不良反应小的优点。目前对于其发病机制研究也取得了初步进展,实验性 IBD小鼠模型中证实,转化生长因子β1(transforming growth factor,TGF-β1)在炎症性肠病中的表达增加[1],但由于过度表达的Smad7阻滞了TGF-β1信号途径后促进IBD中致炎因子的持续升高,从而抑制了TGF-β1的抗炎能力。本实验旨在通过观察白头翁汤对造模大鼠的TGF-β1及下游信号转导因子Smads的表达变化的影响,探讨白头翁汤治疗炎症性肠病的分子机制。
1 材料与方法
1.1 动物及分组
Wistar雄性大鼠40只(北京维通利华实验动物技术有限公司),普通级,体重(140±10)g,随机分为5组(n=8):正常对照组、模型组、模型+阳性对照组、模型+中药中剂量组、模型+中药高剂量组。
1.2 实验药物及制备
白头翁汤由白头翁10g,黄连15 g,黄柏15 g,秦皮15 g(北京同仁堂提供),药物制备:A、中剂量组中药制备:上述药物置于搪瓷药罐中,加适量蒸馏水浸泡2 h,加热煮沸30min,滤出头煎,药渣加蒸馏水适量,再煮沸 30min,滤出二煎,合并2次滤液,加热浓缩至浓度为396 g/L[2](生药),原液装瓶,高压消毒后密封保存。B、高剂量组中药制备:将A组中药继续加热浓缩至浓度为792 g/L[2](生药),原液装瓶,高压消毒后密封保存。C、阳性对照药美沙拉嗪肠溶片(安徽东盛制药有限公司),美沙拉嗪肠溶片碾磨成粉,配成浓度为 30g/L[2]的混悬液。D、2,4,6-三硝基苯磺酸(2,4,6-Trinitrobenzenesulfonic acid solution,TNBS,Sigma公司)制备:将浓度为5%(即 50g/L)的TNBS,使用前配制成3.0%TNBS-乙醇溶液(即5%TNBS 6 ml+无水乙醇4 ml)。
1.3 主要试剂
Smad7(Santa Cruz),p-Smad3(Santa Cruz),GAPDH(Santa Cruz),辣根过氧化物酶标记羊抗兔IgG(北京中山生物公司),FITC-标记羊抗兔IgG二抗(北京中山生物公司),封闭用正常羊血清(北京中山生物公司)。
1.4 动物造模及取材
制备大鼠炎症性肠病模型[3]:禁食不禁水24h后,腹腔注射2%戊巴比妥钠(60mg/kg)麻醉,将直径2 mm的乳胶管经肛门轻轻插入大鼠体内大约8 cm处的肠腔内,给予2.5%的TNBS-乙醇溶液按75 mg/kg灌肠,然后注入约0.3 ml空气,以排空管中的药液,捏紧肛门,提起大鼠尾部,保持倒立30s,造模后大鼠平躺,自然清醒,常规饲养。正常对照组给予同体积的生理盐水灌肠,常规饲养。造模成功3天后,中药治疗组中、高剂量组每日分别给予相应浓度的白头翁汤2 ml灌胃治疗,阳性对照组每日分别给予美沙拉嗪肠溶片混悬液2 ml灌胃治疗,每日1次,共14天。正常对照组和模型组给予同等体积生理盐水灌胃。第18天处死各组大鼠,剖腹,摘取肛门以上7 cm~8 cm结肠,沿肠系膜纵轴剪开,取病变最明显处液氮冻存,用于后续蛋白提取,部分组织置于4%多聚甲醛固定、冰冻包埋、切片。
1.5 免疫组化
(1)组织固定,常规脱水,冰冻切片,丙酮固定;(2)将切片放置在PBST中,洗3次每次5 min;(3)0.3%Triton X-100室温作用30min,5%的羊血清室温封闭1 h;(4)加入兔抗Smad7或p-Smad3一抗(1∶200稀释),4℃过夜;(5)PBST洗 3次,每次10min,加入FITC-标记羊抗兔IgG二抗(1∶200稀释),室温30min;(6)PBST 洗 3 次,每次 10min,DAPI封片,激光共聚焦显微镜下观察拍照。应用Image-Pro Plus 6.0软件对图像进行分析。
1.6 Western blot
(1)取50~100mg组织加入到1 ml组织裂解液中(已加入蛋白酶抑制剂),用匀浆器在冰上充分匀浆,冰上裂解30min;(2)4℃,12000×g离心20min,取上清,将0.2 mg/ml的BSA稀释成一系列标准溶液(0、25、50、100、200μg/ml),取标准溶液和适当稀释的待测样品各20μl,加入5倍稀释的蛋白浓度分析试剂中,振荡混匀后,595 nm波长下测光密度值。以标准蛋白浓度的光密度值作标准曲线,计算待测样品蛋白浓度;(3)分别配制12%的分离胶和5%的积层胶,灌制分离胶和积层胶,在样品加入凝胶加样缓冲液,沸水变性3~ 5 min 后 80μg/well上样;(4)电泳:恒压电泳,电泳至凝胶底部;取下凝胶,放入预冷的电转缓冲液中平衡10min;(5)NC膜在预冷的电转缓冲液中平衡10min,在湿转式电转仪上以恒流进行电转;(6)电转结束后,将膜置于TBS中漂洗3次,每次10min。封闭,室温轻摇2 h。按照0.1 ml/cm2的比例加入用封闭液稀释的抗Smad7或p-Smad3一抗,4℃轻摇过夜;(7)TBS-T洗3次,每次10min。按照0.1 ml/cm2的比例加入封闭液稀释的辣根过氧化物酶标记羊抗兔二抗,在室温振荡2 h。(8)TBS-T洗3次,每次10min,ECL显色。
1.7 统计学分析
采用SPSS 11.0进行数据处理,数据以均数±标准差()表示,两组间比较行t检验。
2 结果
2.1 免疫组化法检测Smad7和p-Smad3在大鼠结肠组织中的表达
免疫荧光的结果显示,同对照组相比,模型组Smad7表达显著增加(P<0.01),而p-Smad3表达显著降低(P<0.01);应用阳性药物美沙拉嗪和白头翁汤治疗后,同模型组相比,均能明显降低Smad7而增加p-Smad3的表达(P<0.01),尤其是高剂量白头翁汤对Smad7和p-Smad3的表达调控作用同美沙拉嗪相当(图1,图2见下页)。
2.2 Western blot检测Smad7和p-Smad3在大鼠结肠组织中的表达
Western blot的结果显示,同对照组相比,模型组Smad7表达显著增加(P<0.01),而p-Smad3表达显著降低(P<0.01);同模型组相比,阳性药物美沙拉嗪和高剂量白头翁汤治疗均能明显降低Smad7而增加p-Smad3的表达(P<0.01,图3),同免疫荧光结果一致。
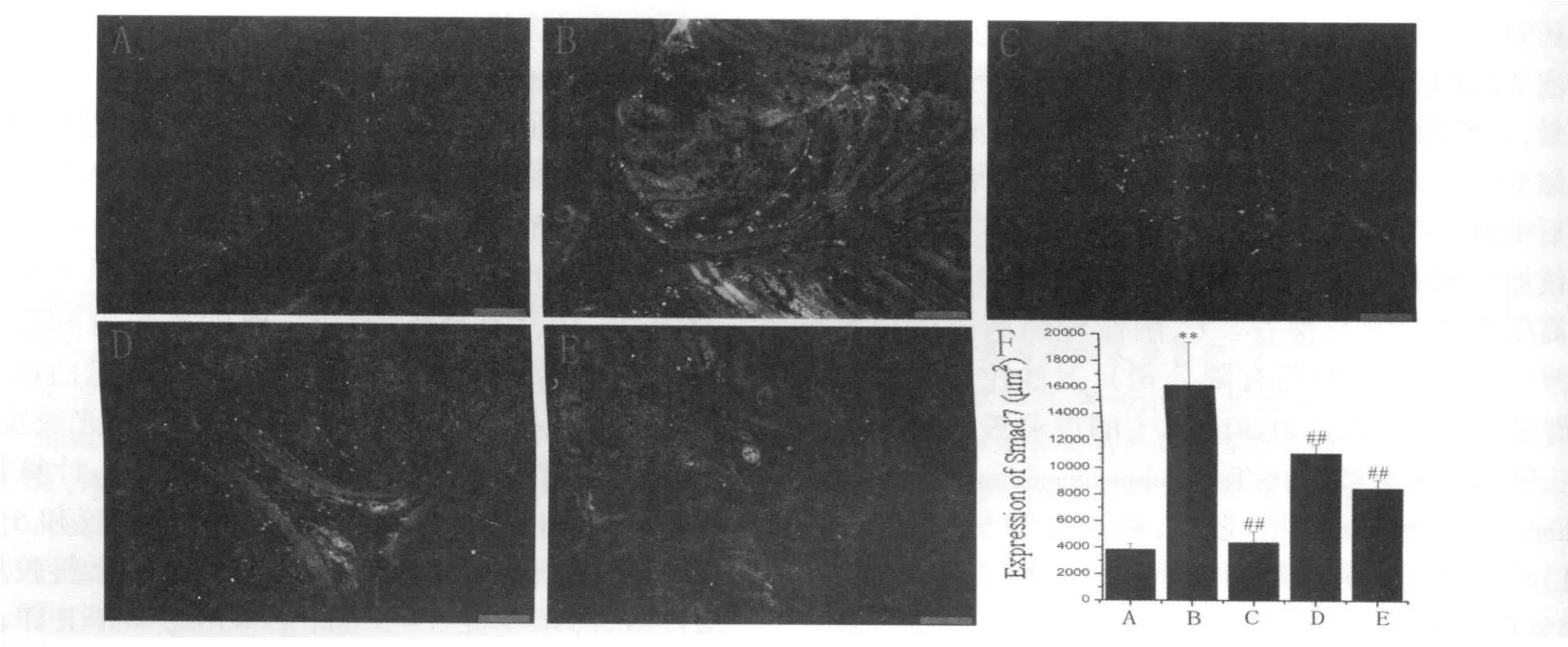
Fig.1 Expression of Smad7 in colons from different groups by immunofluorescent(,n=3,Scale bars=50μm)
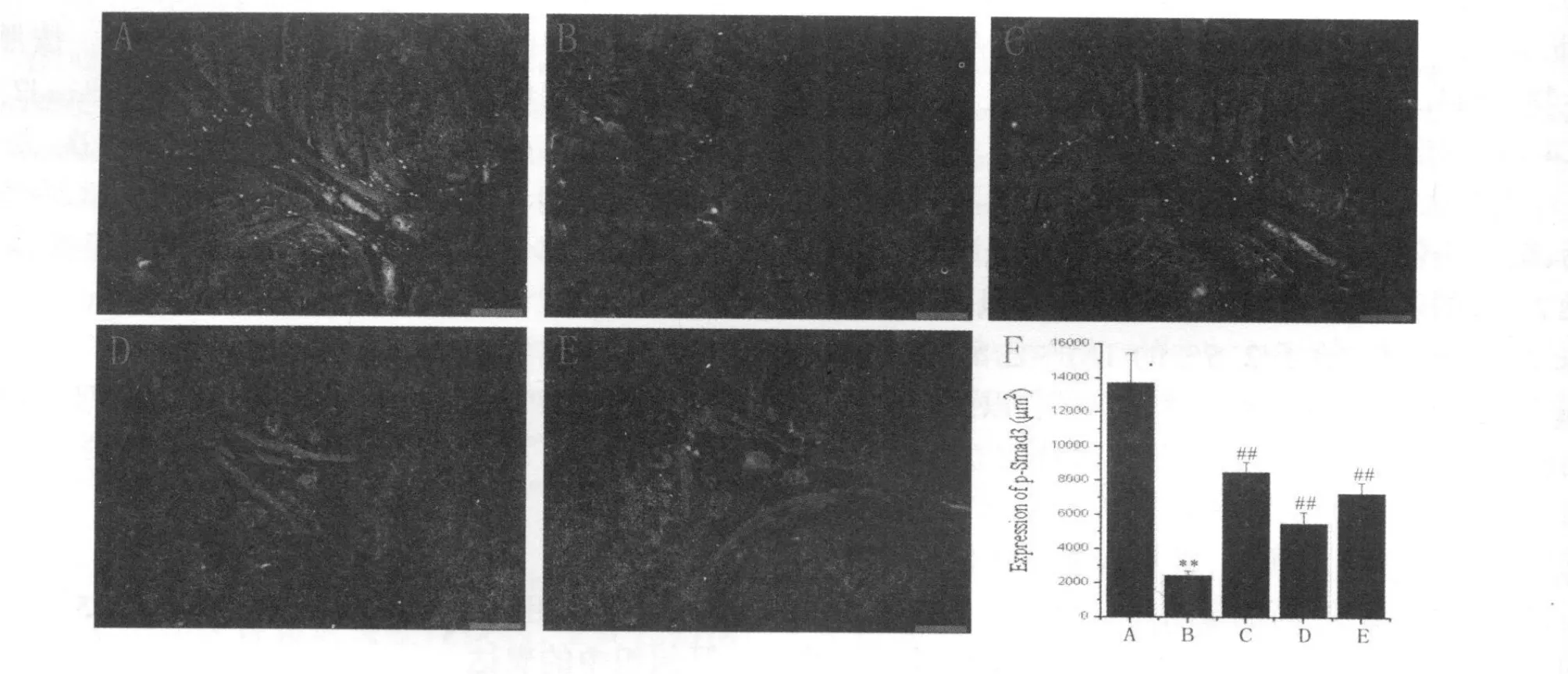
Fig.2 Expression of p-Smad3 in colons from different groups by immunofluorescent(,n=3,Scale bars=50μm)

Fig.3 Relative expression of Smad7 and p-Smad3 in colons from different groups by Western blot(,n=3)
3 讨论
到目前为止炎症性肠病的病因和确切的发病机理仍不清楚。但已有证据显示免疫异常,特别是肠粘膜局部的免疫紊乱在IBD的发病中占有十分重要的地位,致炎因子/抗炎因子的失衡可能是疾病发生的原因之一。促炎症细胞因子 (IL-1,IL-6,IL-8,TNF-α和IFN-γ)增多,抗炎细胞因子(IL-1受体拮抗剂,IL-10和TGF-β)减少,是引起肠粘膜免疫反应异常和慢性炎症的主要原因。TGF-β1在伤口愈合和组织修复中具有重要作用,是炎症性肠病中控制胶原合成和介导肠纤维化的复杂调节机制中的重要生长因子[4,5]。TGF-β1可激活下游的Smad3,使其磷酸化后入核,调控相应靶基因的转录,从而发挥其生物学效应;而Smad7则起到抑制TGF-β1/Smad3信号通路的作用。在实验性IBD小鼠模型中已证实,TGF-β1的表达增加[1,6],但 Smad7的过度表达阻滞了TGF-β1信号途径,促进了IBD中致炎因子的持续升高,而抑制 Smad7的表达则可恢复TGF-β1的抗炎能力[7]。
同IBD小鼠模型相同,本实验应用TNBS造模大鼠后发现,Smad7蛋白水平在IBD发生时的高表达,而磷酸化的Smad3表达水平则受到抑制,一定程度阻断了TGF-β1的作用,这与先前文章报道相一致[8]。另有文章也表明,Smad3靶向敲除的小鼠会发生剧烈的炎性反应,这进一步证实了TGF-β1/Smad3信号通路在对抗粘膜炎性反应中的重要作用[8,9]。在本研究中,我们应用阳性药物及高剂量白头翁汤后均可有效对抗TGF-β1/Smad3信号通路中的抑制因子Smad7的高表达,而增加了活性因子Smad3磷酸化水平的表达,所以 TGF-β1/Smad3信号通路的激活使得TGF-β1能够有效的发挥抗炎及修复损伤的能力。
综上所述,本实验表明,白头翁汤可通过抑制Smad7、促进磷酸化Smad3表达水平,从而激活TGF-β1/Smad3信号通路,对IBD急性期大鼠发挥了显著的抗炎作用及修复炎症损伤的作用。
[1]Babyatsky M W,Rossiter G,Podolsky D K.Expression of transforming growth factors alpha and beta in colonic mucosa in inflammatory bowel disease[J].Gastroenterol,1996,110(4):975-984.
[2]徐叔云,卞如濂,陈 修.药理实验方法学[M].北京:人民卫生出版社.2002:202-204.
[3]Morris G P,Beck P L,Herridge M S,et al.Hapten-induced model of chronic inflammation and ulceration in the rat colon[J].Gastroenterol,1989,96(3):795-803.
[4]Sandberg-Gertzen H,Eid R,Jarnerot G.Hermansky-Pudlak syndrome with colitis and pulmonary fibrosis[J].Scand J Gastroenterol,1999,34(10):1055-1056.
[5]Allgayer H,Bohne P,Kruis W.Drug-induced fibrosing colonopathy in inflammatory bowel disease after 5-ASA[J]?DigDis Sci,1999,44(8):1600.
[6]HahmK B,Im Y H,Parks T W,et al.Loss of transforming growth factor β signalling in the intestine contributes to tissue injury in inflammatory bowel disease[J].Gut,2001,49(2):190-198.
[7]Monteleone G,Kumberova A,Croft N M,et al.Blocking Smad7 restores TGF-β1 signaling in chronic inflammatory bowel disease[J].J Clin Invest,2001,108(4):601-609.
[8]Yang X,Letterio J J,Lechleider R J,et al.Targeted disruption of SMAD3 results in impaired mucosal immunity and diminished T cell responsiveness to TGF-beta[J].EMBOJ,1999,18(5):1280-1291.
[9]Monteleone G,Boirivant M,Pallone F,et al.TGF-beta1 and Smad7 in the regulation of IBD[J].Mucosal Immunol,2008,Suppl 1:S50-53.

