体内外诱导人脐血间充质干细胞向心肌细胞的定向分化
龚 敏,辛渭川,李 涛
(西安市中心医院心内科,陕西西安710003)
体内外诱导人脐血间充质干细胞向心肌细胞的定向分化
龚 敏,辛渭川,李 涛
(西安市中心医院心内科,陕西西安710003)
目的观察在体外5-氮胞苷诱导和体内心肌缺血微环境诱导下,人脐血间充质干细胞(mesenchymal stem cells,MSCs)向心肌细胞的定向分化。方法收集健康产妇脐血细胞,采用密度梯度离心结合差速贴壁的方法分离MSCs,传代培养至第三代,应用流式细胞术分析MSCs表面分子CD34、CD45、CD44和CD90的表达。体外应用5-氮胞苷(5-aza)诱导MSCs四周后,免疫荧光染色和RT-PCR分别检测MSCs心肌标志物cTnT(肌钙蛋白)和Connexin43(缝隙连接蛋白)的表达;体内将GFP标记的MSCs移植入心肌梗死大鼠模型心肌梗死周边区,移植后1周,取大鼠心脏行冰冻切片,免疫荧光染色检测MSCs心肌特异性蛋白cTnT和Connexin43的表达。结果分离的MSCs表达表面分子CD44和CD90,不表达CD34和CD45;MSCs体外经5-氮胞苷诱导后在mRNA和蛋白水平均表达心肌标志物cTnT和Connexin43;MSCs体内移植后1周,免疫荧光染色检测发现移植的MSCs表达心肌特异性蛋白cTnT和Connexin43。结论人脐血间充质干细胞可在体外诱导和体内心肌缺血微环境下向心肌细胞分化。
间充质干细胞;心肌细胞;分化;诱导
急性心肌梗死是严重危害人类健康的重大心血管疾病。近年来,通过干细胞移植修复受损心肌成为新的研究热点,大量临床试验及动物实验研究表明干细胞移植可改善心肌梗死后的心脏功能[1-5]。骨髓组织是成体干细胞的主要来源,但骨髓MSCs的数量和分化潜能随着供体的年龄增加而下降,且从机体获取骨髓是一个有创性操作。脐血具有干细胞丰富、淋系祖细胞含量少、体外增殖力强等生物学特性,且临床来源丰富,易于收集、存储和运输,成为干细胞移植中重要的理想种子细胞来源。已有研究表明脐血间充质干细胞可分化为软骨细胞、脂肪细胞和神经细胞等而参与组织的再生与修复。本研究从体外诱导和体内心肌缺血微环境诱导两个方面探讨人脐血间充质干细胞向心肌细胞的定向分化,从而为人脐血MSCs修复损伤心肌、治疗缺血性心脏病奠定理论基础。
1 材料与方法
1.1 材料
低糖DMEM(Dulbecco'smodified Eagle'smedium)和胎牛血清购自Gibco公司,Percoll's细胞分离液(1.131g/m L)购自Pharmacia公司,胰蛋白酶购自Amresco公司,5-氮胞苷购自Sigma公司。兔抗人cTnT(心肌型)和兔抗人Connexin43抗体购自Santa Cruz公司,山羊抗兔IgG-CY3和BSA(牛血清白蛋白)购自北京中杉金桥生物技术公司。RNAfast200Kit购自上海飞捷生物公司,SYBR?RT-PCR Kit购自日本Takara公司,2×Taq PCR MasterMix购自天根生物公司。CK-40型倒置生物显微镜和BX51型正置生物显微镜为Olympus公司生产,流式细胞仪为美国BD公司生产。
1.2 方法
1.2.1 脐血MSCs的分离和培养 收集知情同意的健康产妇的脐血细胞,从中分离获得单个核细胞,以1.077 g/cm3的淋巴细胞分离液密度梯度离心分离细胞,将细胞以3×104的密度接种于组织培养瓶中,置于37℃含5%CO2的培养箱中培养,24 h后换液,之后每3 d换一次培养液(DMEM培养基和10%胎牛血清)。待细胞生长至80%融合时,用0. 25%的胰蛋白酶(含0.02%EDTA)消化细胞,进行传代培养。
1.2.2 脐血MSCs表面标志检测 将3代脐血MSCs消化后,PBS洗涤一遍,以荧光素标记抗人CD34、抗人CD44、抗人CD45、抗人CD90抗体标记MSCs,流式细胞仪检测分析各抗原的表达。
1.2.3 5-氮胞苷诱导大鼠骨髓MSCs 当MSCs生长约60%融合时,弃去旧培养液,PBS冲洗2遍,加入配制好的终浓度为10μmol/L的5-氮胞苷诱导液。作用24 h后更换为含10%血清的DMEM培养基继续培养。以后每天观察细胞形态改变。
1.2.4 免疫荧光染色 将生长在盖玻片上的细胞以PBS洗涤后,用4%多聚甲醛固定15 min,洗净,再以PBS洗涤10 min。用0.1%Triton X100处理细胞15 min,PBS洗涤一遍,再用Tween20/2%牛血清白蛋白室温下封闭1 h,然后将细胞与Tween 20/牛血清白蛋白稀的一抗和二抗分别孵育mi一抗分别采用1:200稀释的抗人cTnT和Connexin43抗体。二抗采用CY3标记的抗兔IgG抗体。染色标记后采用正置荧光显微镜进行观察。
1.2.5 RNA提取和RT-PCR 采用RNAfast200 Kit提取总RNA,测定OD值,计算总RNA的纯度。按照SYBR?RTPCR Kit推荐的反应体系和反应条件制备cDNA。
PCR反应按照2×Taq PCR MasterMix推荐的反应体系进行。反应条件为:预变性94℃3 min,变性94℃30 s,退火63.4℃30 s,延伸72℃1min,30个循环,最后延伸72℃5 min。以GAPDH为内参照,各基因扩增引物如下:NKX2.5:sense:ACCCTCGGG CGG ATA AGA A,antisense:GAC AGG TACCGC TGT TGC TTG A(产物:170bp),cTnT:sense:CATGGA GAA GGA CCT GAA CGA,antisense:TCA TTG CGA ATA CGC TGC TGT(产物:178 bp),Connexin43:sense:AGG TCT GAG AGC CTG AAC TCT CATT,antisense:GGC ACT CCA GTC ACC CATGT(产物:186 bp),GAPDH:sense:AGA ACA TCA TCC CTG CAT CCA,antisense:GCC TGC TTC ACC ACC TTC TTG(产物:184 bp)。取6μL PCR产物于2%琼脂糖凝胶中电泳,EB染色,凝胶成像系统扫描产物电泳条带。
1.2.6 心肌梗死模型的建立 选取健康成年SD大鼠,以100 g/L水合氯醛3 mL/kg剂量腹腔注射麻醉,钝性分离肋间肌而开胸,于左心耳与肺动脉圆锥交界处平左心耳下缘2 mm处,以7-0无损伤缝合线结扎左前降支近端,建立心肌梗死模型。模型成功标准:造模后2周,打开胸腔观察,可见冠状动脉左前降支供血区心肌颜色发白,形成界限分明的梗死区。同时通过组织病理学的苏木精-伊红染色证实心肌梗死模型建立。
1.2.7 脐血MSCs移植模型的建立 以100 g/L水合氯醛3 mL/kg腹腔注射麻醉,钝性分离胸大肌和前锯肌,助手于胸骨左缘第4肋间用血管弯钳稍用力穿透肋间肌进入胸腔,并迅速沿肋间隙方向撑开血管钳钝性分离肋间肌,用另一血管弯钳垂直于肋间隙方向撑开肋骨,暴露心脏,适当用力将心脏快速挤出,即刻,于心肌梗死周边区分5点迅速注射移植(4.5~7.5)×106个(0.15 mL细胞悬液)MSCs,注射后,立即将心脏放回心腔并置入接注射器的塑料细管,迅速对合捏紧皮肤抽出胸腔残气,立即拔管并行胸外按压及两侧胸部间断挤压,心电图观察心律正常且呼吸平稳后,缝合皮肤。伤口消毒,肌肉注射青霉素钠每天10×104U,连续3 d。
3 结果
3.1 脐血MSCs的形态学特征及表面标志鉴定
第3代脐血MSCs呈典型的成纤维细胞样形态,均匀分布,增殖能力很强(图1)。经表面抗原表达分析,其表达CD44和CD90(图2),不表达CD34和CD45。在整个传代培养过程中,脐血MSCs始终保持其成纤维细胞样的形态和较强的增殖能力。
3.2 5-氮胞苷诱导后脐血MSCs的形态变化
5-氮胞苷诱导前,脐血MSCs形态均一,呈典型的成纤维细胞样,胞浆突起较少,均匀分布。5-氮胞苷诱导后,细胞形态发生改变,细胞体积增大或变粗,折光性增强,部分细胞和相邻细胞之间形成连接。诱导4周时,细胞呈短柱状,有分支,但相互融合,且排列方向渐趋一致,与周围细胞形成连接并形成肌管样结构。

图1 脐血MSCs的形态特征
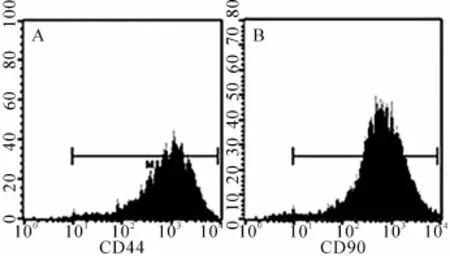
图2 脐血MSCs表面分子的表达
第3代脐血MSCs呈典型的成纤维细胞样形态(×200)
3.3 5-氮胞苷诱导后脐血MSCs表达心肌特异性标志物
脐血MSCs经5-氮杂胞苷诱导后4周,免疫荧光染色检测发现诱导后的脐血MSCs表达心肌特异性标志物心肌肌钙蛋白cTnT和缝隙连接蛋白Connexin43(图3);RT-PCR检测发现诱导后的脐血MSCs在mRNA水平上同样表达心肌特异性基因cTnT和Connexin43(图4)。

图3 体外诱导脐血MSCs表达心肌特异性蛋白

图4 体外诱导脐血MSCs表达心肌特异性基因
在mRNA水平上,体外诱导脐血MSCs表达cTnT和Connexin43,但不表达NKX2.5
3.4 心肌缺血微环境诱导脐血MSCs表达心肌特异性蛋白
于心肌梗死大鼠模型梗死周边区移植脐血MSCs后1周,组织免疫荧光染色可见大量GFP标记的脐血MSCs存活,呈带状分布,排列方向与心肌纤维一致,且表达心肌肌钙蛋白cTnT(图5A)。同时,心肌缝隙连接蛋白Connexin43在MSCs连接处也有表达(图5B)。
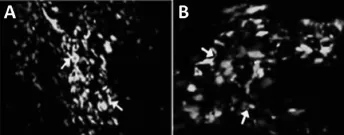
图5 移植后1周脐血MSCs表达心肌特异性蛋白
4 讨论
干细胞移植为心血管疾病的治疗开辟了一条崭新的途径。目前多应用骨髓、脐血及外周血作为干细胞来源。脐血间充质干细胞作为种子细胞具有许多优点,结合脐血的资源优势及临床适应证的广泛性,其替代骨髓及外周血进行干细胞移植已成为近十年来细胞移植领域的研究热点,并被认为是最理想的干细胞来源。本研究探讨脐血间充质干细胞在体外诱导和体内心肌梗死微环境下向心肌细胞的定向分化,为脐血MSCs成为种子细胞而治疗缺血性心脏病奠定理论基础。
本研究结果表明,在形态学上这些从脐血中分离的细胞与从骨髓中分离的MSCs相似,呈典型的成纤维细胞样形态,分布均匀,增殖能力较强,且具有明确的自我更新能力和多分化能力。荧光素标记抗体标记MSCs后,采用流式细胞仪检测MSCs表面分子表达的结果表明,这些细胞中作为造血干细胞标志的CD34、CD45表达均为阴性,但作为MSCs特异性的CD44、CD 90的表达则呈阳性[6],这与文献报道的骨髓来源的MSCs表型一致,即这些脐血源性细胞具有MSCs的特性。
脐血MSCs在经5-aza诱导后,部分细胞体积增大,折光性增强,部分细胞和相邻细胞之间形成连接。诱导4周时,细胞呈短柱状,有分支,但相互融合,且排列方向渐趋一致,与周围细胞形成连接并形成肌管样结构。表明脐血MSCs经诱导后具有心肌样细胞形态学结构。其机制可能在于与控制向心肌分化的特异启动因子上阻遏蛋白结合使其去甲基化,发生构型改变,启动干细胞向心肌样细胞分化[7]。肌管样结构的形成为心肌样细胞进行收缩舒张活动及细胞之间的信息交流奠定了形态学基础。
在本研究中,脐血MSCs体外经5-aza诱导后形态发生明显类似心肌样改变,且表达心肌特异性标志物cTnT和Connexin43,而不表达心脏早期转录因子NKX2.5,说明脐血MSCs经诱导后不但已经向心肌方向分化,而且分化程度已不处于心肌早期阶段。但本研究同时未观察到诱导后的脐血MSCs发生自发收缩活动,因此,分化的脐血MSCs也不处于终末分化的成熟心肌细胞阶段。其可能是处于心肌祖细胞与终末分化心肌细胞之间某一阶段的细胞,其形态结构与终末分化心肌细胞可能存在差异[8]。脐血MSCs诱导后的分化阶段具体评判可能还需从电生理、功能学等多角度、多方面综合进行评价。
本研究结果表明,人脐血MSCs易于分离和体外扩增,经体外5-aza诱导和体内心肌梗死微环境诱导均可分化为心肌样细胞,其将可能成为干细胞移植中的理想种子细胞而用于替代修复受损心肌,为治缺血性心脏病的治疗开辟新的途径。
[1]JIN JY,JEONG SI,SHIN YM,et al.Transplantation ofmesenchymal stem cells within a poly(lactide-co-epsilon-caprolactone)scaffold improves cardiac function in a ratmyocardial infarctionmodel[J].Eur JHeart Fail,2009,11(2):147-153.
[2]QUEVEDO HC,HATZISTERGOS KE,OSKOUEIBN,et al.Allogeneic mesenchymal stem cells restore cardiac function in chronic ischemic cardiomyopathy via trilineage differentiating capacity[J]. Proc Natl Acad Sci USA,2009,106(33):14022-14027.
[3]CHEN SL,FANGW,YE F,etal.Effecton left ventricular function of intracoronary transplantation of autologous bonemarrow mesenchymal stem cell in patients with acutemyocardial infarction[J].Am J Cardiol,2004,94(1):92-95.
[4]KATRITSIS DG,SOTIROPOULOU PA,KARVOUNI E,et al. Transcoronary transplantation of autologousmesenchymal stem cells and endothelial progenitors into infarcted human myocardium[J]. Catheter Cardio Inte,2005,65(3):321-329.
参考文献:
[1]汤钊猷.现代肿瘤学[M].第2版.上海:上海医科大学出版社,2000:465.
[2]吴娜、梁晓丽健择[1].中国新药杂志2000,9(3);204.
[3]东文霞.恶性肿瘤患者放疗的副作用及其护理对策[J].护士进修杂志,2004,19(12):1140.
[4]张惠兰,陈荣秀.肿瘤护理学[M].天津:科学出版社,1999:42-47.
[5]於爱宝.肿瘤患者的心理护理及其对策[J].解放军护理杂志,2004,21,(7).
[6]孙风雨.癌症病人心理调查及护理对策.现代医药卫生,2007,23(9):19.
P34
A
1672-2639(2011)01-0007-03
2010-08-17;责任编辑 王景鸿]

