2种左甲状腺素钠片的人体生物等效性研究
王蒙,周文佳,黄明,张全英(苏州大学附属第二医院药剂科,苏州市 215004)
左甲状腺素钠(Levothyroxine sodium,L-T4)是一种合成的甲状腺素钠,与甲状腺素(T4)作用相同。L-T4可作为替代或补充治疗不同的病因引起的先天性或获得性甲状腺功能减退症,其可用于亚临床甲状腺功能减退和初期(甲状腺)、二期(垂体)和三期(下丘脑)甲状腺功能减退患者的治疗。L-T450%~80%是通过胃肠道吸收,空腹口服后,达峰时间为6 h,之后血浆L-T4浓度不断下降。由于L-T4较之三碘甲腺原氨酸(T3),与蛋白结合率更高,结合更牢固,故一般3~5 d才起作用。大多L-T4代谢发生在周围器官,经过在肝、肾及其他组织中部分脱碘转化为T3和反三碘甲状腺原氨酸(rT3)。T4和T3的血浆半衰期分别为6~7 d和1~2 d。L-T4是一个治疗指数窄的药物,同时血液中自然存在少量的L-T4。在本试验的设计及生物等效性评价中,参照了美国食品与药物管理局(FDA)发布的关于以左甲状腺素钠为例的体内药动学、生物利用度研究和体外溶出试验指导原则[1],以便保证这类窄治疗窗药物的生物等效的确与治疗学上的等效是一致的。德国柏林化学股份有限公司生产的L-T4(商品名:雷替斯®)已在中国上市,由于某些患者不耐受乳糖或对着色剂过敏,该公司研制出Berlthyrox®,该片剂不含乳糖和着色剂,已在德国上市,为申请在中国进口注册,现以雷替斯®为参比制剂,对Berlthyrox®进行人体相对生物利用度研究,以评价2种制剂是否具有生物等效性,为新药申报和临床合理应用提供试验依据。
1 材料
1.1 仪器
SN-695B型智能放射免疫γ测量仪(上海核所日环光电仪器有限公司);DK-600A型电热恒温水箱(上海一恒科技有限公司);KDC-2044低速冷冻离心机(科大创新股份有限公司中佳分公司);Vortex genie 2涡旋振荡器(美国Scientific industries公司);MODELYB DH-1低恒压吸引器(上海医疗器械工业(集团)公司医用吸引器厂);411分液器(瑞士Socorex公司);DAS 2.0数据处理软件(皖南医学院)。
1.2 试药
受试制剂:(Berlthyrox®,德国柏林化学股份有限公司,规格:每片含L-T4100 μg,不含乳糖,批号:84105);参比制剂:(雷替斯®,德国柏林化学股份有限公司,规格:每片含L-T4100 μg,含乳糖,批号:84034);T4放射免疫分析药盒(北京北方生物技术研究所,批准文号:国药准字S10930048,批号:20090920、20091020、20091120);T3放射免疫分析药盒(北京北方生物技术研究所,批准文号:国药准字S10930047,批号:20090920、20091020、20091120);T4、T3质控血清(中国药品生物制品检定所,批号:1601-0812);水为注射用水(安徽双鹤药业有限责任公司)。
2 方法与结果
2.1 受试者选择
26名健康志愿者,男女各半,平均年龄(23±2)岁,平均身高(165.2±8.6)cm,平均体重(57.8±7.4)kg。试验前,试验方案和知情同意书经苏州大学附属第二医院伦理委员会审批同意后,受试者签署知情同意书,经病史询问,并均进行常规体检和十二导联心电图、实验室检查(血常规、凝血功能、尿常规、血生化、病毒学)、甲状腺功能全套(T3、fT3、T4、fT4、TSH)检查,合格者入选为受试者。
2.2 试验方案[1]
26名受试者随机分成2组,每组12人,按2×2交叉试验方案设计,分别口服参比制剂或受试制剂6片(各含L-T4600 μg),药物经清除35 d后交换给药。受试者禁食过夜10 h,用240 mL温开水送服。所有受试者在给药后1 h内禁水,4 h内禁食。分别于给药前0.5、0.25、0 h及给药后0.5、1、1.5、2、2.5、3、4、6、8、10、12、18、24、48 h时由前臂静脉采血4 mL,置分离胶离心试管中,静置30~60 min,离心(4 ℃,3500 r·min-1)5 min,分离血清于-70℃冷冻保存。
2.3 血清样品处理
按药盒说明书操作。T4:取样品或标准品50 μL加入试管中,再依次加入125I-T4200 μL和羊抗-T4抗体100 μL,混匀后37℃水浴孵育45 min,加入T3、T4驴抗羊免疫分离剂500 μL,混匀后室温放置15 min,于4 ℃以3500 r·min-1离心15 min,吸弃上清液,沉淀物用SN-695B型智能放射免疫γ测量仪测定。T3:取样品或标准品50 μL加入试管中,再依次加入125I-T3200 μL和羊抗-T3抗体100 μL,混匀后37℃水浴孵育1 h,加入T3、T4驴抗羊免疫分离剂500 μL,同上离心、测定。制备标准曲线和分析样品时均采用双复管。
2.4 标准曲线的制备
精密移取水500 μL分别溶解T4标准品灭菌粉末,静置15 min后,涡旋混匀,得到标准血清样品的浓度分别为20.00、40.00、80.00、160.00、320.00 ng·mL-1,用放射免疫分析法测定各管的放射性每分钟记数(counts per minute,cpm),通过logit-log方法进行数据处理,得直线回归方程为:y=5.3810-1.2099x(r=-0.99856),线性范围20.00~320.00 ng·mL-1。另同法溶解T3标准品灭菌粉末,得到标准血清样品的浓度分别为0.50、1.00、2.00、4.00、8.00 ng·mL-1,并同法测定,得直线回归方程为:y=0.8530-1.0846x(r=-0.99859),线性范围0.50~8.00 ng·mL-1。
2.5 方法灵敏度
以20管不含T4、T3的血清的cpm数的均值-2×标准差计算方法灵敏度,得T4、T3药盒灵敏度分别为3.19 ng·mL-1和0.02 ng·mL-1。
2.6 精密度及回收率试验
分别配制T4低、中、高(30.80、77.40、124.00 ng·mL-1)及T3低、中、高(0.81、1.92、3.03 ng·mL-1)3种浓度的质控血清样品,于不同天内各测定3批,计算方法回收率和日内、日间精密度,结果见表1。
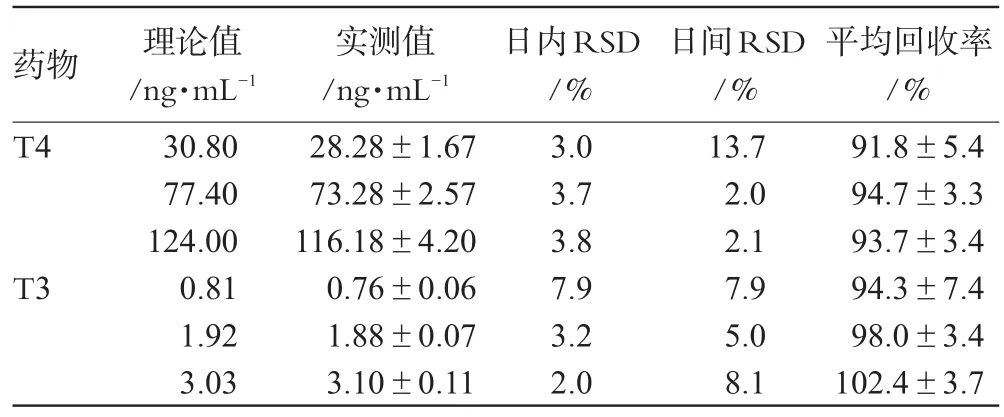
表1 精密度及回收率试验结果Tab 1 Results of precision and recovery tests
2.7 稳定性试验
分别配制T4低、中、高(30.80、77.40、124.00 ng·mL-1)3种浓度的质控血清样品,分别在室温放置6 h、反复冻融(1、2、3次)和-70℃保存58 d条件下测定;另分别配制T3低、中、高(0.81、1.92、3.03 ng·mL-1)3种浓度的质控血清样品,同法测定。结果RSD均<15%。
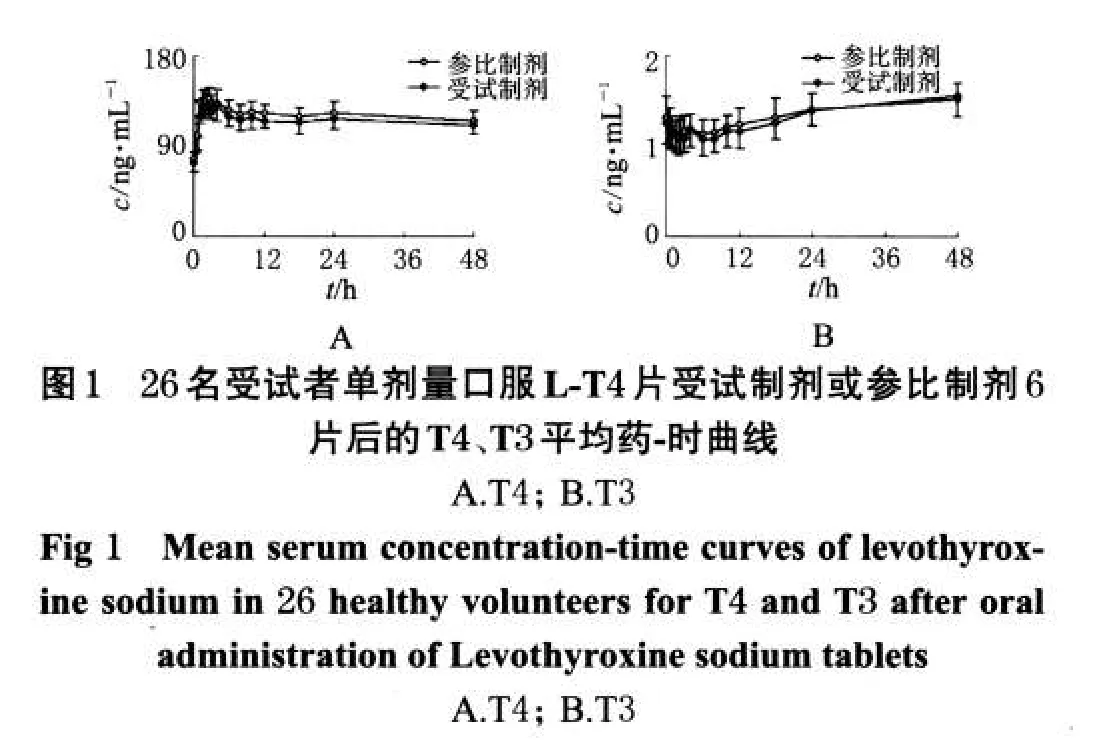
2.8 药-时曲线
26名受试者单剂量口服L-T4片受试制剂或参比制剂后T4、T3的平均药-时曲线见图1。
2.9 药动学参数和生物等效性
26名受试者单剂量口服L-T4受试制剂或参比制剂6片后,T4、T3主要药动学参数见表2。
受试者交叉口服2种制剂后,cmax经对数转换后进行方差分析结果表明,T3制剂、周期、个体间无显著性差异,T4制剂、周期、个体间均有显著性差异。AUC0~48h经对数转换后进行方差分析结果表明,除T3制剂周期间无显著性差异外,其余均有显著性差异。按生物等效性判定标准,AUC0~48h和cmax90%置信区间均在80%~125%内,认为2种制剂生物等效。与参比制剂相比,受试制剂T4的相对生物利用度为(95.9±11.6)%,T3的相对生物利用度为(99.2±12.6)%,表明2种制剂生物等效。tmax经Wilcoxon检验差异无统计学意义(P>0.05)。T4和T3生物等效性分析结果见表3。
3 讨论
文献[2]的等效性判定标准:经对数转换的受试制剂的AUC0~48h在参比制剂的80%~125%范围内,受试制剂的cmax在参比制剂的70%~143%范围内[2]。由于L-T4是一个治疗窗窄的药物,为了严格增加治疗学上等效性和可替代性,笔者采用了美国FDA等效性判定标准,即受试制剂的AUC0~48h、cmax与参比制剂AUC0~48h、cmax的比值的90%置信区间在80%~125%范围内[1]。
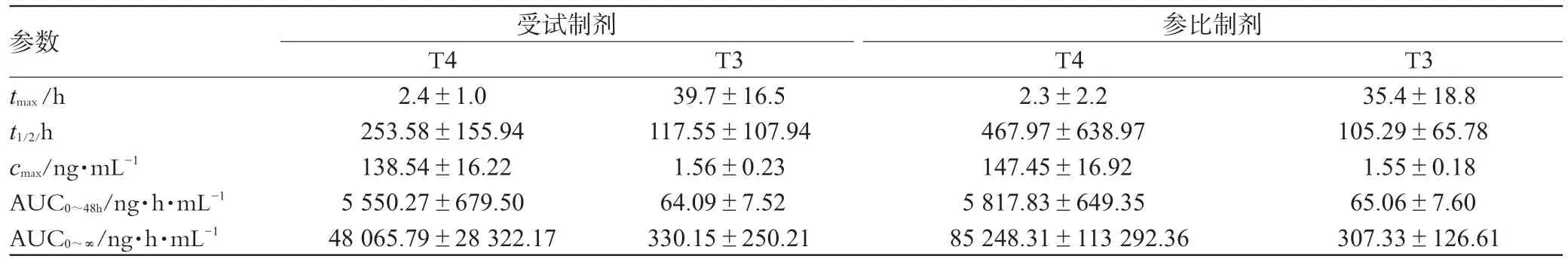
表2 26名受试者单剂量口服L-T4片受试制剂或参比制剂6片后的T4和T3药动学参数Tab 2 Pharmacokinetic parameters of levothyroxine sodium in 26 healthy volunteers for T4 and T3 after oral administration of Levothyroxine sodium tablets

表3 T4和T3生物等效性分析结果Tab 3 Results of bioequivalence analysis for T4 and T3
26位受试者(男、女各半)单剂量、随机、开放、双周期交叉口服L-T4片受试制剂和参比制剂后,血清中T4呈明显时量变化,受试制剂和参比制剂的主要药动学参数均与国内、外文献报道[3~5]基本一致。血清中T3无明显时量变化。血清中T4、T3的AUC0~48h、cmax90%置信区间均在80%~125%范围内。表明2种制剂生物等效。
受试者lncmax方差分析结果表明T3制剂、周期、个体间无显著性差异,T4制剂、周期、个体间均有显著性差异。lnAUC0~48h方差分析结果表明,除T3制剂周期间无显著性差异外,其余均有显著性差异。推测原因可能如下:每位受试者体内不同时间的甲状腺激素基线值水平是不同的,由此可能产生给药后个体间的显著性差异。甲状腺激素基线值水平受机体各器官、系统之间相互协调、相互制约,由此可能产生给药后周期间和制剂间的差异,提示临床要注意个体化给药。
[1]US Dept of Health and Human Services,Food and Drug Administration,Center for Drug Evaluation and Reserch.Guidance for Industry:Levothyroxine sodium tablets in vivo pharmacokinetic and bioavailability studies and in vitro dissolution testing[EB/OL].http://www.Fda.gov/cder/guidance/3645fnl.htm.2004-10-07.
[2]国家食品药品监督管理局.化学药物制剂人体生物利用度和生物等效性研究技术指导原则[EB/OL].http://www.doc88.com/p-30190808136.html.2005-03.
[3]朱 立,赵志英,王正华.国产左甲状腺素钠片剂生物利用度研究[J].中国临床药理学杂志,2001,17(6):440.
[4]荣征星,赵咏桔,陈广洁,等.左甲状腺素2种配方片剂人体生物利用度比较[J].中国新药与临床杂志,2005,24(1):7.
[5]Di Girolamo G,Keller GA,de Los Santos AR,et al.Bioequivalence of two levothyroxine tablet formulations without and with mathematical adjustment for basal thyroxine levels in healthy Argentinian volunteers:a single-dose,randomized,open-label,crossover study[J].Clin Ther,2008,30(11):2015.

