世界卫生组织基本药物遴选原则的进展研究Δ
杨 悦,李 姗,武志昂(沈阳药科大学工商管理学院,沈阳市 110016)
1975年,第28次世界卫生大会(WHA)上,世界卫生组织(WHO)总干事Halfdan Mahler的报告中提出“急需确保绝大多数基本药物以合理的价格可获得”,并号召贫穷国家的药物政策应与本国的卫生需求和经济工作的重点相适应,强调基本药物制度是提升国民健康状况的有效途径[1]。1977年,WHO制定了第1版基本药物示范目录。经过30余年的发展,WHO已逐步建立了较为完善的基本药物制度体系,涵盖基本药物示范目录的遴选评价、调整和基本药物推广程序等一系列内容。慎重的遴选有限种类的基本药物,可以提高卫生保健的质量,提高药品的管理水平,更加合理的使用卫生资源[2]。本研究从WHO基本药物的目录遴选和调整政策演变入手,针对WHO的系列技术报告进行研究,分析基本药物目录遴选和调整原则的变化,以期为我国基本药物的遴选和调整提供参考。
1 基本药物概念的演变
1975年,WHA28.66决议中要求,WHO总干事“采取措施尽力协助各成员国根据本国自身的健康需求以合理的价格遴选和推广基本药物方面提供建议”。1977年,WHO第1次专家委员会会议召开,WHO将基本药物定义为“满足人类健康的最重要的、最基本的、必不可少的、必须的药品”。1978年,WHA31.32决议又强调,以合理的价格提供优质、数量充足的药品来满足各国的健康需求,并提倡要达到“确保全人类以各国可负担的价格获得基本药物”。1982年,在WHO第3次专家委员会会议上,WHO将该定义修改为“满足大部分人群健康要求的药品,这些药品在任何时候都应该有充足的数量和合适的剂型”。
1999年,在WHO第11次专家委员会会议上[3],WHO决定在该定义中加入1978年WHA提出的可负担性的概念,即“满足大部分人群健康需求的药品,这些药品在任何时候都应该有充足的数量和合适的剂型,并具有个人和社会均可负担的价格”。该定义于2001年5月提交WHO执行委员会审核,当时大部分执行委员会成员赞成,但个别成员对“可负担性”和“大部分人群”的表述持保留意见。此外,一些成员还认为基本药物需要持续的资金投入及基本药物质量的必要性并未在该表述中充分体现。同时,执行委员会还提出了在基本药物的现有表述中并未反应各国的需要,也未对各国制定自身的基本药物补充目录提出指示。
2002年1月,WHO执行委员会第109届会议召开,在该次会议的报告中[4],WHO认为对基本药物的描述应该包含3个部分:定义、遴选原则的描述及制定基本药物目录的目的。定义:基本药物是满足人类优先健康需求的药品。遴选原则:基本药物的遴选应该以疾病发病率、有效性和安全性证据、成本效益数据比较为基础。制定基本药物目录的目的:在现有的卫生体系内,基本药物应确保在任何时候都有充足的数量、合适的剂型、确定的质量及个人和社会可以负担的价格。但在会议的讨论阶段,有成员认为,现有的遴选标准中是以“疾病发生率”为基础,并未体现疾病预防的理念。WHO最终决定接受该建议,将基本药物的表述修改为:基本药物是满足人类优先健康需求的药品。其遴选应该考虑与人类健康相关的疾病,有效性和安全性证据及成本效益比较数据。在现有的卫生体系内,应确保在任何时候都有充足的数量、合适的剂型、确定的质量和充足的信息及个人和社会可以负担的价格。但对基本药物概念的实施具有一定的灵活性,适用于各种不同的情形,具体确定哪些药物是基本药物仍然是各国自身的责任。该概念被沿用至今。基本药物的概念演变过程见表1。
从WHO对基本药物概念表述的变化中可以看出,WHO对基本药物的认识是一个逐步深入的过程,从最初只考虑价格因素,到加入可及性和质量因素;从满足大部分人群到满足全人类的需求;从疾病治疗到预防;从单纯的定义到从定义、遴选原则和目的三方面进行描述,以及对各国国情的考虑等,都体现了WHO对基本药物认识的逐步完善,使基本药物制度的实施更加符合WHO的初衷,从而使基本药物更好的满足人类健康的需求。

表1 基本药物概念演变过程Tab 1 Time tablet of conception evolution of essential medicine
2 基本药物遴选原则的变化
2.1 1977年提出的基本药物最初遴选原则
1977年,WHO制定了第1版的基本药物示范目录,规定了基本药物的遴选原则,该遴选原则一直沿用至2000年,当时确定的遴选原则有如下几条[5~11]:
1)基本药物的遴选要考虑很多因素,如疾病的类型、治疗设备、工作人员的培训及经验状况、资金状况、遗传学因素、人口统计学因素和环境因素。
2)基本药物的遴选应基于临床研究提供的足够的、正确的药品临床疗效和安全性的证据,且这些证据能代表各种临床条件下药品常规使用的结果。
3)参与遴选的药物必须要确保质量,包括生物利用度,并要确保在预定的贮藏和使用条件下的稳定性。
4)当2个药物在以上方面极其相似时,应该评估其相对的有效性、安全性、质量、价格和可获得性。在成本的比较中,要注意成本指的是治疗过程的总成本,并不是单一药物的成本。成本效益比在遴选中是一个关键的考虑因素。在一些情况下,还需要考虑药动学特征或者当地的一些情况,如生产或贮藏设备的可获得性等。
5)多数情况下基本药物应为单一化合物,只有当复方制剂中的各成分满足特定人群的需要,并且在治疗效果、安全性和依从性方面比分开服用单一化合物更具有优势时选择复方制剂。
但是在这些遴选原则中,WHO并不要求对申请者提交的所有可获得证据进行审查,总是基于对WHO章程或程序的信任,接受专家委员会提出的相关建议,认为已经获得了合理的充足的证据。
2.2 1999年增加循证遴选原则
在1999年WHO第11次专家委员会会议上,WHO正式提出需要对申请者提交的所有相关证据进行系统的审查;当不能获得这些证据时,该申请将被推迟或拒绝。从此,WHO正式启动了药品的循证遴选,要求提供所有证据的综合意见,药品的调入和调出都要基于当前最佳的证据。
遴选原则的变化会导致目录中药品的变化。如:该次会议之后出版的第11版基本药物示范目录中,在抗肿瘤药、免疫抑制剂和姑息治疗用药中增加注射用柔红霉素(50mg盐酸盐粉末)和苯丁酸氮芥(2mg,片剂)用于癌症的治疗。因为国际肿瘤研究中心审查了癌症治疗和抗肿瘤药物所提交的证据,认为其存在有效性和安全性方面的治疗优势;天门冬酰胺酶、氮芥、达卡巴嗪和左旋咪唑仍然保留在目录中,因为支持其调出的证据并不充分;同时,将血液制品和血浆代用品下面的白蛋白调出,原因在于系统审查的结果显示该药存在之前无预测到的风险,并且与其他的可选择药物相比,缺乏充足的有效性证据。专家委员会认为应继续加强这种基于实证的系统审查方法[12]。
2.3 2002年补充复方制剂遴选原则
2002年,WHO第12次专家委员会会议召开,在会议的讨论阶段,有成员认为复方制剂具有一定的优势,能提高患者对治疗方案的依从性,并降低抗菌药物的耐药性,可以解决很多国家都存在的不合理联合用药的问题。复方制剂要加入基本药物目录需要有充足的药学配伍合理性和生物利用度证据。依据这些建议,WHO将复方制剂的遴选标准进行了调整:多数基本药物应为单一化合物,只有当复方制剂在治疗效果、安全性、依从性或降低药物耐药性的发生方面具有优势时才选择复方制剂。
基于复方制剂遴选原则的改变,WHO在该次会议之后出版的第12版基本药物示范目录中增加了蒿甲醚与本芴醇复方制剂作为抗疟药物。该复方制剂首次申请调入目录是在1999年,但当时WHO认为该药无实际联合应用的证据支持,在治疗效果、有效性和安全性方面不具有优势。2002年遴选原则改变之后,专家委员会考虑了该复方制剂在降低药物耐药性方面的优势,发现治疗严重疟疾的药物的耐药性普遍存在,且耐药性已经达到了一定的程度。在一些国家,除了青蒿素及其衍生物外,其他所有可获得的抗疟药都已有一定程度的耐药性。严重疟疾患者对氯喹、甲氟喹、奎宁以及磺胺多辛联合乙胺嘧啶均已产生耐药性,故应用青蒿素及其衍生物是必然之选。尽管缺乏关于对体重在10kg以下儿童应用蒿甲醚以及本芴醇的详细的临床数据,对孕妇应用的信息也有限,但专家委员会仍推荐蒿甲醚以及本芴醇复方制剂调入核心目录,并加以下标注:推荐给那些对药物有极大的耐药性的地区使用,不能应用于孕妇以及体重在10kg以下的儿童[4]。
2.4 目前使用的遴选原则
2002年以后,WHO最终形成的遴选原则主要有3条,并一直沿用至今[4,13~17]:
1)基本药物的选择需要考虑很多因素,包括疾病负担、范围以及有效性、安全性、成本效益比较的充足数据。如果可能的话,还需要考虑药物在各种环境下的稳定性、诊断或治疗设备及药动学特性。并且药物的遴选一定要基于实证,如果该药对于目前某一重要疾病的治疗缺乏充足的科学证据,专家委员会可以选择将该药的申请推迟,直到获得足够的证据,或者依据专家的建议做一些修订。
2)多数基本药物应为单一化合物,只有当复方制剂在治疗效果、安全性、依从性或降低药物耐药性的发生方面具有优势时才选择复方制剂。目前,只有抗结核药物、抗疟疾药物和抗艾滋病药物采用复方制剂形式。
3)在对多种药物成本进行比较时,不仅是比较单一药物的成本,而是整个治疗过程的总成本。并且成本效益比较是在同一治疗组内进行比较的,并不跨组比较。但治疗费用并不构成将符合遴选标准的药物排除在基本药物目录之外的原因,同时在遴选时也不考虑专利状态。
为使WHO的基本药物目录符合各国的要求,各国还应考虑以下因素:当地的人口统计学因素、疾病的类型、医疗设备、工作人员的培训和经验状况、药物的可获得性、资金的来源及环境因素。
2.5 儿童用药遴选原则
2006年8月,WHO和联合国儿童基金会(UNICEF)的联合专家会议召开,审查了儿童用药存在的问题,如缺乏应用于儿童的合适的剂型和规格、直接将药物碾碎或溶于水给儿童服用等一系列不合理的现象。WHO于2007年3月第15次专家委员会上提出,在WHO基本药物目录中,根据儿童用药的临床需要和疾病负担制定儿童基本药物目录。考虑到儿童用药的复杂性,WHO专家委员会认为应挑选合适的专家成立小组委员会专门负责该项工作,任务完成之后该小组委员会即可解散[15]。该小组委员会于2007年7月召开了第1次会议,提出了儿童基本药物的遴选原则[16]。
小组委员会认为儿童基本药物的遴选可以参照已有的基本药物遴选原则(即上述最终形成的3条原则),但也有一些特殊的规定:1)遴选原则中要求申请中要有充足的有效性和安全性数据,但由于儿童用药数据的缺乏,小组委员会认为如果某一药物被公认的监管当局批准用于特定的年龄阶段的治疗,那么该批准信息即可作为该药物申请中的有效性及安全性数据;2)对于儿童复方制剂的遴选,小组委员会认为复方制剂中各成分的规格要确保适合更多儿童年龄阶段的人群使用。尤其是在治疗慢性疾病时,要尽可能简化处方,以提高患者的依从性。并且要有充足的证据证明复方制剂中的各成分在低剂量时不会有治疗失败和抗药性发展的风险,在高剂量时不会出现毒性。
该次会议之后出版了第1版儿童基本药物目录,该目录共分为25个治疗类别,共收录药品287种,在基本药物目录原有的治疗类别的基础上删除了抗帕金森综合征药物和催产药物。此后,小组委员会对该项工作继续深入,又于2008年10月召开了第2次会议,出版了第2版儿童基本药物目录,共收录药品310种。
3 剂型遴选指南的变化
WHO早在1977年制定第1版基本药物示范目录时就提出,在遴选基本药物时应考虑剂型和规格,并在每次专家委员会会议的报告中都提出了相应的指导性建议(遴选指南),以此对剂型和规格进行规范。该遴选指南的发展可以分为以下几个阶段。
3.1 1977-1995年剂型规格遴选指南[5~8]
在基本药物目录中遴选剂型和规格的目的是为标准化和减少本国目录中的制剂品种数量提供指导。作为一个总的原则,药品的剂型选择是基于其效用以及其广泛的可获得性。在许多情况下,会提供一种剂型的选择,特别是对固体制剂。片剂通常情况下要比胶囊便宜,但是,在考虑成本因素的同时,应该基于药动学、生物利用度、受环境气温因素影响下的稳定性、药用辅料的可获得性以及当地已有的偏好。
当片剂规格无统一的规定时,例如乙酰水杨酸以及对乙酰氨基酚,其适合的片剂规格应当以当地的可获得性以及需求为依据。当规定准确的用药剂量时,推荐带刻痕片作为一种简单的方法来使得剂量更为灵活,必要时可以给儿童提供一种方便的剂量。只有当特定的情况时,应该在目录中列出儿童规格和处方。大部分情况下,规格具体指一种盐或酯的含量,而在其他情况下,例如氯喹,按照惯例,规格指的是其活性基团的含量。
3.2 1996-2005年剂型规格遴选指南[4,9~14]
增加关于缓释剂型遴选的补充说明。对于代谢迅速、半衰期短的药物,例如卡马西平、钙通道阻滞药以及茶碱,传统的常释剂型需每天服用3~4次来保持药物浓度。缓释剂可以减少服药频率,进而提高依从性,并且缓释剂较常释剂可以保持平稳的血药浓度从而提高治疗效果。由于缓释剂的制备较为困难且需要特殊的技术,如缓释剂对药物的释药原理、制备工艺及辅料的选择等都有严格要求,WHO认为在基本药物目录中增加这种剂型的药物需要有充足的证据。
3.3 2006-2009年剂型规格遴选原则的规范
2006年,利物浦大学对WHO基本药物图书馆进行了一次彻底的审查。在审查中发现,WHO第14版的基本药物示范目录上有很多药物所列的剂型和规格在一些市场上并没有,并且还发现了药物规格方面的严重错误。于是,WHO在2007年的专家委员会会议上提出需要对剂型和规格进行规范。当时提出了以下3条原则:1)药物是酸或碱、或者和其他物质成盐,其规格应标示药物游离状态的含量;2)溶剂化物(Solvate)的规格应标示其无水物的含量;3)酯类药物的规格应标示该酯的含量。在此基础上对第14版的基本药物目录进行了修订,出版了第15版的基本药物目录[15]。
由于上次会议制定的原则并不全面,不能推广到所有的药物,WHO在2009年3月召开的第17次专家委员会会议上,进一步对剂型和规格遴选原则进行了规范。WHO提出了2条原则[17]:
1)对于多种剂型的药物,应选择常见的剂型。国际药典中常见的剂型有:胶囊、片剂、眼用制剂、注射剂和外用半固体制剂。儿童常用的剂型有:口服液体制剂(包括可以制成口服液体制剂的粉末)、直肠制剂(包括直肠用胶囊)、鼻用制剂、灌肠剂、局部液体制剂、粉末和颗粒剂、喷雾剂。并在基本药物目录上增加药物剂型和规格相关术语的解释和说明。对于有临床治疗优势的药物可以选择特殊的剂型。
2)药物目录左侧是药物活性基团,使用国际非专利名称;目录右侧是药物的剂型和规格。对于规格的表示,WHO根据药物活性成分(Active pharmaceutical ingredient,API,通常是盐类、酯类和化合物)和活性基团(Active moiety)的不同(API可能本身就是活性基团或者由活性基团和其他的化学基团构成),分为2种情况:
第1种情况:如果基本药物目录的右侧栏中的规格标示的是药物活性基团的含量,则其API的类型(盐类、酯类和化合物)列在后面用括号括起来。如:
目录左侧:氨苄西林;目录右侧:注射用粉末500mg和1 g(钠盐)。
意义为:氨苄西林的含量为500mg和1 g。
第2种情况:如果基本药物目录右侧栏中的规格代表的是API的含量,则应列出API(盐类、酯类和化合物)全称。如:
目录左侧:可待因;目录右侧:片剂,30mg可待因磷酸盐。意义为:可待因磷酸盐的含量为30mg。
3.4 儿童用药剂型规格遴选原则
在儿童基本药物剂型方面,WHO从儿童用药安全出发,纳入了刻痕片,利于儿童用药拆分剂量;从方便儿童使用出发,纳入咀嚼片、含化片、粉剂、喷雾剂、粉雾剂、透皮贴剂,提高用药依从性[18]。
出于对儿童药物剂型和规格的重视,小组委员会又于2008年12月召开了儿童基本药物剂型大会,探讨儿童药物的合适剂型[17]。在该次会议上,小组委员会对儿童药物剂型提出了一些建议:1)对发展中国家来说,最合适的剂型就是具有灵活性固体制剂,如片剂可以制成可分散片或者该片剂可用于制备液体制剂(如混悬液和溶液);2)注射剂和直肠制剂可用于治疗病情严重及不能吞咽的儿童;3)允许任何溶液、悬浮液或者其他形式的液体作为口服液、颗粒剂或者粉末作为口服液体的补充可代替口服液。4)对于需要维持持久血浆浓度的药品,可以制成贴剂和透皮给药制剂。
4 目录修订程序中系统审查流程的变化
新目录修订程序未批准以前,WHO对基本药物的遴选主要基于经验而非证据。专家委员会主要根据提供的材料和其个人的经验选择基本药物,对提交的申请无严格要求的标准格式,对提交给专家委员会的证据亦未进行系统审查。对专家委员会的建议不进行公开审议,并且专家委员会提出的遴选理由也不在网站上进行公布,公众只能从专家委员会的报告中看到[19]。
为完善WHO基本药物目录修订程序,新程序于2001年获得批准,新修订程序明确:WHO示范目录的调入、变更或调出申请需通过WHO的相关部门提交到专家委员会秘书处,申请需要提供详尽的证据资料,提交的截止时间为专家委员会召开正式会议前4个月。WHO专家委员会对提交的证据进行系统的审查,最终作出决定。但随着基于实证的循证方法的应用,WHO在2007年专家委员会会议上,对该程序进行了一些修订,这些修订主要体现在修订程序中的系统审查流程中。修订前、后的系统审查流程见表2[4,15]。
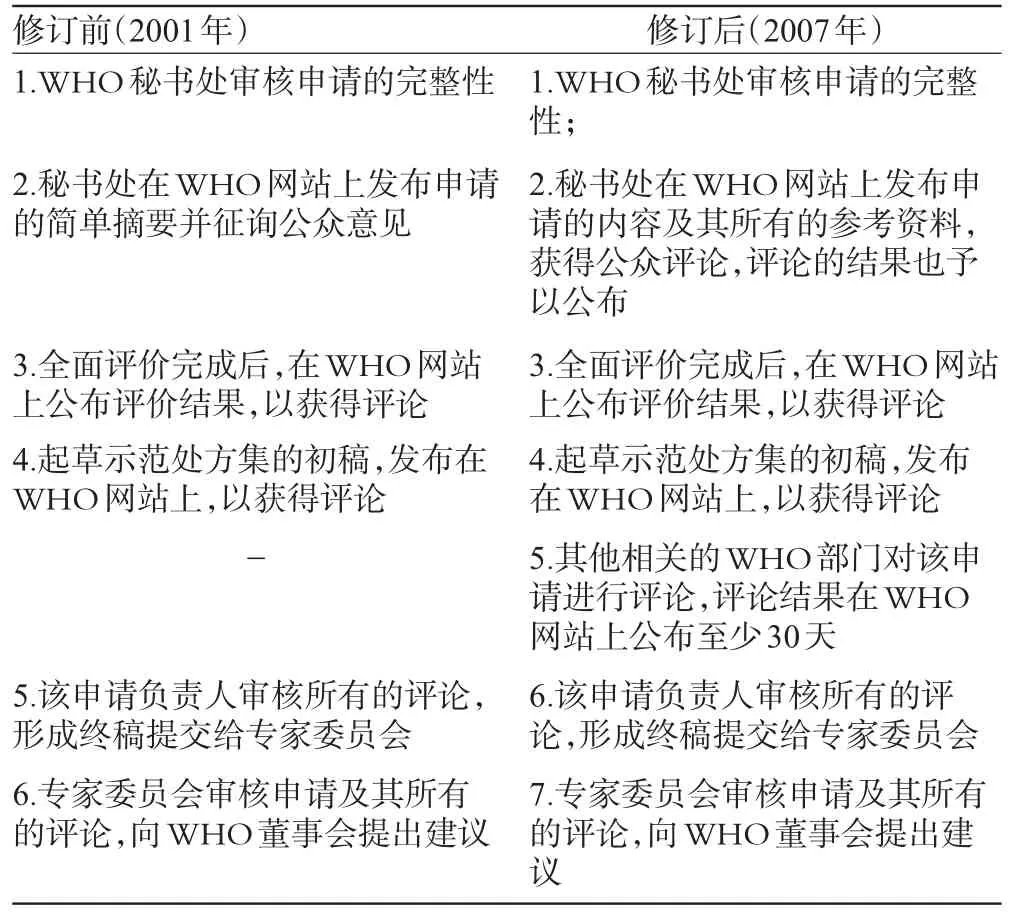
表2 WHO目录修订前后的系统审查流程Tab 2 Checking procedure of WHO list before and after revision system
与2001年审查流程相比,新流程具有明显的优越性:(1)增加工作程序的透明度。2001年的审查流程只要求发布申请的摘要信息,而修订后的流程中要求发布申请及其所有参考资料的信息,并征求公众评论,评论的结果也需要在WHO网站上发布,体现了WHO对公众意见的重视,为各利益相关者提供了一个参与的平台,提高了审查流程的透明度。同时,WHO要求公布申报资料的所有信息,体现了WHO对申请内容的重视,要求申请中要有充足的证据。(2)充分整合、利用WHO内部资源,加强多部门合作。新修订的流程中要求WHO其他相关部门对申请进行评论,评论的结果需要在WHO网站上公布至少30天,而旧流程中并无此要求。申报资料的审评主要由WHO的多个技术部门完成,在加强多部门合作的同时,提高WHO决策的科学性和合理性。
5 结论
从遴选原则的变化上看,WHO的遴选原则是经历了基于经验向基于实证的转变过程。遴选原则中补充专门针对复方制剂的遴选条件,使复方制剂的遴选有规可循。
从剂型遴选指南的变化中可以看出,WHO对剂型和规格的规定是一个逐步标准化的过程。1977-2005年制定的剂型遴选指南总的来说很不全面,也不具体,操作性较低,涉及的剂型就包括片剂、胶囊、缓释剂、常释剂和刻痕片,并且对规格标示方法的规定也不明确,导致2006出现了剂型和规格方面的系列问题。虽然2007年WHO制定了3条规格的标示方法,但并不能推广到所有的药物,具有一定的局限性。到2009年,WHO通过区分药物活性成分和药物的活性基团,再次对剂型和规格进行了规定,与2007年制定的修订原则相比,这2种不同的规格表示方法更具有全面性和推广性,适用于所有的药物,使WHO基本药物的剂型和规格更加规范。
从儿童基本药物遴选原则的变化上可以看出WHO对儿童用药的重视。一方面成立专门的小组委员会负责儿童基本药物的遴选,并且遴选原则充分考虑到了儿童相关数据的缺乏及用药特点;另一方面对儿童基本药物剂型的遴选提出了指导性建议,以遴选出适合儿童使用的药物新剂型。
WHO基本药物体系在近年来已有长足的发展,基本药物的概念也已在全球范围内被广泛接受。我国的基本药物工作起步较晚,目前正面临着严峻的考验:遴选标准缺乏科学性和规范性、剂型和规格规定不明确,导致药品混乱等。我国应借鉴WHO的经验,明确我国基本药物的概念内涵,制定科学合理、可操作性较高的遴选原则,规范入选基本药物目录药品的剂型和规格,从而保障我国基本药物政策的顺利实施。
[1]Jeremy A Greene.When did medicines become essential[J].Bull World Health Organ,2010,88:483.
[2]WHO.Revised procedure for updating WHO’s Model List of Essential Drugs[R].EB 109/8 report,2001:1.
[3]WHO.WHO medicines strategy:Revised procedure for updating WHO’s Model List of Essential Drugs[R].EB 109/8 report,2001:3-4.
[4]WHO.The selection and use of essential drugs:report of the WHO expert committee(WHO Technical Report Series 914)[R].Geneva:World Health Organization,2002:6,8,14-16,25,40.
[5]WHO.The use of essential drugs:second report of the WHO expert committee(WHO Technical Report Series 722)[R].Geneva:World Health Organization,1985:9-11.
[6]WHO.The use of essential drugs:third report of the WHO expert committee(WHO Technical Report Series 770)[R].Geneva:World Health Organization,1988:11-12.
[7]WHO.The use of essential drugs:fourth report of the WHO expert committee(WHO Technical Report Series 796)[R].Geneva:World Health Organization,1990:11-13.
[8]WHO.The use of essential drugs:fifth report of the WHO expert committee(WHO Technical Report Series 825)[R].Geneva:World Health Organization,1992:4-5.
[9]WHO.The use of essential drugs:sixth report of the WHO expert committee(WHO Technical Report Series 850)[R].Geneva:World Health Organization,1995:4-6.
[10]WHO.The use of essential drugs:seventh report of the WHO expert committee(WHO Technical Report Series 867)[R].Geneva:World Health Organization,1997:5-7.
[11]WHO.The use of essential drugs:eighth report of the WHO expert committee(WHO Technical Report Series 882)[M].Geneva:World Health Organization,1998:4-6.
[12]WHO.The use of essential drugs:ninth report of the WHO expert committee(WHO Technical Report Series 895)[R].Geneva:World Health Organization,2000:4-6,47.
[13]WHO.The use of essential drugs:report of the WHO expert committee(WHO Technical Report Series 920)[R].Geneva:World Health Organization,2004:57-58.
[14]WHO.The use of essential drugs:report of the WHO expert committee(WHO Technical Report Series 933)[R].Geneva:World Health Organization,2005:57-58.
[15]WHO.The use of essential drugs:report of the WHO expert committee(WHO Technical Report Series 946)[R].Geneva:World Health Organization,2007:6-7,10-12,146-150.
[16]WHO.The use of essential drugs:report of the WHO expert committee(WHO Technical Report Series 950)[R].Geneva:World Health Organization,2007:41-45.
[17]WHO.The use of essential drugs:report of the WHO expert committee(WHO Technical Report Series 958)[R].Geneva:World Health Organization,2009:5-6,64-66.
[18]张伶俐,张 川,梁 毅,等.我国2009版基本药物目录(基层)与2010版WHO儿童基本药物示范目录比较分析[J].中国循证医学杂志,2010,10(9):1031.
[19]鄢 琳,周杰明,井春梅,等.世界卫生组织基本药物示范目录:挑战与发展[J].中国药物警戒,2006,3(5):263.

