参附注射液对局灶性脑缺血再灌注损伤大鼠中枢神经系统病理学的影响
谢健,闵苏(1.重庆市急救医疗中心麻醉科,重庆市 400030;2.重庆医科大学附属第一医院麻醉科,重庆市 400016)
参附注射液(Shenfu injection,SFI)主要含人参皂苷和乌头碱。近年来,大量临床研究将SFI用于器官、组织缺血再灌注时保护性治疗,以达到减轻缺血再灌注损伤的目的,并取得了良好效果[1~4]。本研究拟探讨SFI对局灶性脑缺血再灌注损伤大鼠血脑屏障和皮质神经元病理学有无影响。
1 仪器与材料
1.1 仪器
721型分光光度仪(上海济成分析仪器厂);水浴箱(上海人和科学仪器有限公司);TGL-16A型离心机(上海精密仪器仪表公司);EM FC7型超薄切片机(德国 Leica公司);Hitachi-7500型透射电子显微镜(日本日立公司)。
1.2 试药
SFI(雅安三九药业有限公司,批号:071108);水合氯醛(青岛汇和化工有限公司,批号:070621);伊文思蓝(EB,美国进口分装,上海如吉生物科技发展有限公司)。
1.3 动物
清洁级健康SD大鼠80只,♂,体重200~270 g,由重庆医科大学实验动物中心提供(动物生产许可证号:SCXK(渝)200220001)。
2 方法
2.1 复制模型、分组和给药
实验分为4组,即空白对照、假手术、模型和SFI组。麻醉前禁食6 h,采用Zea Longa线栓法[5]制备大鼠右侧大脑中动脉(middle cerebral artery,MCA)缺血2 h再灌注24h模型。iv给药。
2.2 指标的测定
2.2.1 血脑屏障病理改变的观察 于缺血2 h再灌注24h即刻麻醉后开胸,主动脉插管,生理盐水冲洗血液,待右心房切口流出液无色透明时用2.5%戊二醛固定液进行灌注固定。灌注结束后开颅取脑,取右侧顶叶皮质,用双面刀片修块成1mm3大小,浸入上述固定液中继续固定2 h以上。之后用1%锇酸固定,梯度酒精脱水,Epon812环氧树脂包埋,切片机制成超薄切片,铀铅染色,透射电镜观察血脑屏障的病理改变(脑毛细血管周围水肿情况和毛细血管管腔受压迫情况)和大脑皮质神经元的病理改变。
2.2.2 脑组织EB含量的测定 大鼠缺血2 h再灌注24h即刻进行麻醉,iv 2%EB生理盐水溶液2mL·kg-1,1 h后加深麻醉,开胸,经左心室向主动脉插管并以生理盐水灌注冲洗血管内的EB直至右心切口流出液变得澄清透明。断头取脑,将左右大脑半球分开,去除皮质表面的蛛网膜、血凝块及脑室脉络丛,放入5倍于其体积的甲酰胺中,37℃水浴48 h,离心,取上清液在620 nm波长处测吸光度(OD)值,甲酰胺作空白对照。根据标准曲线计算出EB含量(μg·mL-1),脑组织EB含量为上述值的5倍。
2.2.3 神经功能缺损评分 于缺血2 h和再灌注24h分别进行Longa[5]神经功能缺损评分。0分:无神经功能缺损症状;1分:轻度神经功能缺损,提尾悬空时不能伸展左前爪;2分:中度神经功能缺损,行走时向左侧转圈;3分:中度神经功能缺损,行走困难,并向左侧倾倒;4分:重度神经功能缺损,不能自发行走。
2.3 统计学方法
3 结果
3.1 大鼠血脑屏障的病理改变
空白对照、假手术组大鼠大脑皮质毛细血管周围及管腔未见明显变化;模型组大鼠大脑皮质毛细血管周围水肿和毛细血管管腔受压的改变严重;SFI组相应区域毛细血管周围水肿和毛细血管管腔受压程度显著轻于模型组。各组血脑屏障病理改变见图1。
3.2 大鼠大脑皮质神经元的病理改变
空白对照、假手术组大鼠大脑皮质神经元未见明显变化;模型组大鼠大脑皮质神经元肿大,细胞膜连续性中断,胞浆肿胀、空泡化,细胞核肿胀、破裂,核基质密度增加,异染色质增加;SFI组大鼠大脑皮质神经元肿胀,细胞膜边界欠清楚,胞浆肿胀,细胞核肿胀,核膜完整,核基质密度轻度增加,异染色质轻度增加。各组大脑皮质神经元病理改变见图2。
3.3 大鼠脑组织内EB含量
空白对照、假手术组大鼠脑组织内EB含量显著低于模型组(P<0.01),SFI组EB含量显著低于模型组(P<0.05)。各组脑组织EB含量见表1。

图1 各组血脑屏障病理改变(EM,×15000)A.空白对照组;B.假手术组;C.模型组;D.SFI组Fig 1 Changes of the ultrastructure of blood-brain barrier(EM,×15000)A.blank control group;B.sham operation group;C.model group;D.SFI group
3.4 神经功能缺损评分
缺血2 h时,空白对照、假手术组神经功能缺损评分低于模型、SFI组(P<0.01)。再灌注24h后,空白对照、假手术组评分低于模型、SFI组(P<0.01),且SFI组显著低于模型组(P<0.01)。模型组再灌注24h评分高于其缺血2 h评分(P<0.01),SFI组再灌注24h评分与其缺血2 h评分无显著差异。各组神经功能缺损评分见表2。
4 讨论
Zea Longa线栓法[5,6]复制动物MCA缺血模型效果肯定、重复性好、操作简单、不需特殊器械、无须开颅,可准确控制缺血再灌注时间,MCA缺血及再灌注效果都很好。因此,笔者采用此方法造模。参考之前有关报道,本研究对每只大鼠实行缺血2 h、再灌注24h处理[7~9]。
局灶性脑缺血再灌注损伤是临床上常见的病理过程,它引起中枢神经系统发生病理学上的改变,是神经功能障碍的基础,与神经功能的恢复和预后密切相关。因此,本研究重点观察SFI对局灶性脑缺血再灌注损伤大鼠的血脑屏障和皮质神经元的病理学变化有无影响。

图2 各组大脑皮质神经元病理改变(EM,×3000)A.空白对照组;B.假手术组;C.模型组;D.SFI组Fig 2 Changes of the ultrastructure of cortical neuron(EM,×3000)A.blank control group;B.sham operation group;C.model group;D.SFI group
表1 各组脑组织EB含量(,n=10)Tab 1 EB content in the cerebral tissue(,n=10)
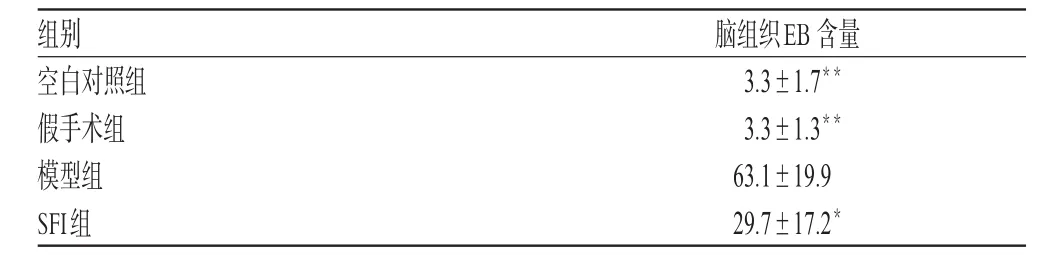
表1 各组脑组织EB含量(,n=10)Tab 1 EB content in the cerebral tissue(,n=10)
与模型组比较:*P<0.05,**P<0.01vs.model group:*P<0.05,**P<0.01
?
表2 各组神经功能缺损评分(,n=15)Tab 2 Neurologic impairment score of each group(,n=15)
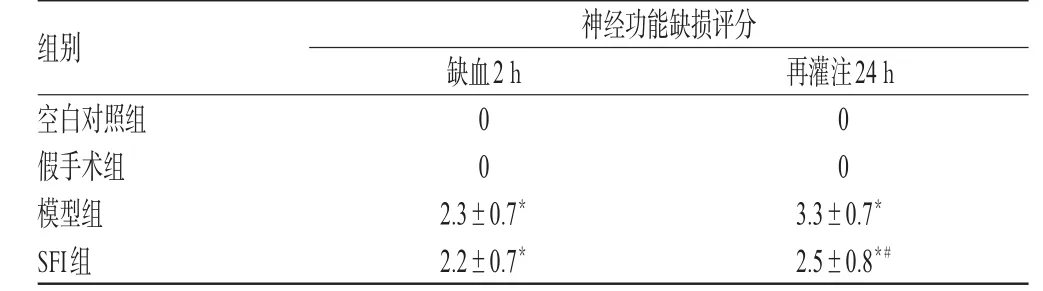
表2 各组神经功能缺损评分(,n=15)Tab 2 Neurologic impairment score of each group(,n=15)
与空白对照、假手术组比较:*P<0.01;与模型组比较:#P<0.01vs.blank control,sham operation group:*P<0.01;vs.model group:#P<0.01
?
本研究结果表明,SFI可减轻局灶性脑缺血再灌注损伤大鼠的血脑屏障和皮质神经元的病理改变,从而减轻相应的功能受损伤程度。虽然缺血再灌注损伤的机制尚未阐明,但目前的研究认为,脑缺血再灌注损伤后,血脑屏障结构破坏与以下因素有关:氧自由基、炎性介质、黏附分子、血小板活化因子、水通道蛋白、基质金属蛋白酶等;神经细胞损伤与以下因素有关:氧自由基、钙超载、凋亡相关基因、兴奋性氨基酸、线粒体损伤和细胞能量代谢障碍等。而SFI具有以下药理作用:清除氧自由基,减轻钙超载,减轻炎症反应,保护线粒体,降低细胞能量代谢障碍,降低促凋亡基因表达,抑制细胞凋亡。这可能是本研究中SFI减轻局灶性脑缺血再灌注损伤大鼠血脑屏障和脑皮质神经元病理学改变的原因[10~14]。
[1]闵 苏,林菁艳,张祖列.参附注射液抗糖尿病兔心肌缺血再灌注损伤的作用[J].中华麻醉学杂志,2006,26(6):493.
[2]曹 俊,闵 苏.含不同浓度参附注射液的停跳液对兔离体心脏缺血再灌注损伤的保护作用[J].中华麻醉学杂志,2006,26(1):61.
[3]顾 玺,戴朝六.参附注射液对大鼠肝缺血再灌注损伤时ATP酶的影响[J].中国药房,2007,18(6):416.
[4]Zhang XJ,Song L.Effect of shenfu injection on gastrointestinal microcirculation in rabbits after myocardial ischemia-reperfusion injury[J].World J Gastroenterol,2006,12(27):4389.
[5]Zea Longa EL,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84.
[6]Koizumi J,Yoshida Y,Nakazawa T.Experimental studies of ischemic brain edema:a new experimental model of cerebral embolism in rats in which recirculation can be induced in the ischemic area[J].Stroke,1986,17(8):1.
[7]张 忱,李 刚,徐亚萍,等.大鼠局灶性脑缺血再灌注模型的再灌注时间窗[J].中日友好医院学报,2000,14(5):255.
[8]Young AR,Touzani O,Derlon JM,et al.Early reperfusion in the anesthetized baboon reduces brain damage following middle cerebral artery occlusion:a quantitative analysis of infarction volume[J].Stroke,1997,28(3):632.
[9]郑 玉,熊利泽,朱正华,等.参附注射液对大鼠短暂性局灶性脑缺血损伤的治疗时间窗[J].第四军医大学学报,2002,23(15):1353.
[10]万敬枝,程梦林,吴基良.参附注射液对局灶性缺血再灌注大鼠脑组织NO、MDA含量和SOD活性的影响[J].中国中医急症,2004,13(6):381.
[11]Zhang YF,Fan XJ.Ginsenoside Rg1protects neurons from hypoxic-ischemic injury possibly by inhibiting Ca2+influx through NMDA receptors and L-type voltage-dependent Ca2+channels[J].Eur J Pharmacol,2008,586(1-3):90.
[12]Park EK,Choo MK,Oh JK,et al.Ginsenoside Rh2reduces ischemic brain injury in rats[J].Biol Pharm Bull,2004,27(3):433.
[13]Kim CS,Park JB,Kim KJ,et al.Effect of Korea red ginseng on cerebral blood flow and superoxide production[J].Acta Pharmacol Sin,2002,22(12):1152.
[14]李 扬,熊利泽,秦绪军,等.参附注射液对幕上肿瘤手术患者血清SOD活性和MDA含量的影响[J].第四军医大学学报,2003,24(16):1507.

