左旋盐酸去甲基苯环壬酯对大鼠和小鼠震颤与行为的影响
闫加庆,李 昕,王丽韫,闫海涛,何新华,仲伯华,郑建全
(军事医学科学院毒物药物研究所生化药理研究室,北京 100850)
帕金森病(Parkinson's disease,PD)又称震颤麻痹,是一种以中脑黑质致密部多巴胺能神经元退行性变性为病理学标志的中枢神经系统退行性疾病,主要发生于中老年以上人群[1]。在中国,55岁以上发病率约为1.7%,随年龄增长发病率也不断提高[2]。PD在临床上主要表现为运动障碍,包括静止性震颤、肌肉僵直、步态失衡以及运动迟缓等。PD发病由于黑质致密部神经元退行性变性病变导致纹状体内多巴胺能系统功能和胆碱能系统功能之间失衡,胆碱能功能相对亢进而出现肌肉震颤等临床症状。但是造成多巴胺能神经元变性的原因目前尚未完全阐明,年龄、遗传、环境、氧化应激和线粒体功能异常等因素在PD发病机制中起着重要作用[3-7]。
目前PD临床以药物治疗为主,药物包括拟多巴胺类和抗胆碱类两种,通过增强多巴胺能系统功能和拮抗胆碱能系统功能重新恢复二者平衡而改善患者症状[8]。左旋多巴一直是临床最主要的和治疗效果最好的药物,明显改善患者运动症状。但用药3~5年,约有80%患者出现突然、不预期的静止和运动波动症状(开关反应)、服药后作用持续时间缩短(剂末效应)和不自主运动增多等严重毒性作用,限制其应用[9-10]。抗胆碱药通过拮抗由于多巴胺能功能抑制引起的胆碱能功能相对优势,恢复多巴胺能-胆碱能平衡,对早期PD患者的震颤症状有明显改善作用,而且该类药物是治疗服用抗精神病药物导致锥体外系反应的唯一有效药物。临床使用的抗胆碱药主要为苯海索,在发病早期可单独应用或与左旋多巴合用推迟后者的用药时间或降低用药剂量减少毒性作用,但该类药物由于选择性低、副作用较大[11],因此寻找疗效好、安全性高的药物成为目前治疗PD药物研发的主要方向。
盐酸苯环壬酯(phencynonate hydrochloride)是北京毒物药物研究所合成并已成功上市的Ⅰ类新药,临床用于治疗晕动病。盐酸苯环壬酯具有旋光异构体,其左旋体活性高于右旋,后进一步研究发现,左旋盐酸苯环壬酯在体内的活性代谢产物为左旋去甲基盐酸苯环壬酯(l-demethyl phencynonate hydrochloride,R-DM8021),为此北京毒物药物研究所合成了R-DM8021。前期研究发现,R-DM8021对毒蕈碱型M4受体亲和力高于其右旋和消旋体,显示出较强的抗胆碱作用[12-13]。M4受体主要分布于中枢纹状体内,与 PD密切相关[14],有望成为新的治疗PD药物。本研究通过建立6-羟基多巴胺(6-hydroxydopamine,6-OHDA)损毁大鼠中脑黑质-多巴胺神经元的方法研究一次性给药及长期给药的作用效果;采用槟榔碱制备致小鼠肌肉震颤模型,研究R-DM8021抑制震颤的作用;采用C57BL/6小鼠制备 1-甲基-4 苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridin,MPTP)PD 模型,观察对小鼠自发活动的影响。
1 材料与方法
1.1 试剂和仪器
R-DM8021由北京毒物药物研究所药物化学研究室提供,批号:090521,纯度:99.78%;苯海索购自武汉银河化工有限公司,批号:0090201;6-OHDA、地昔帕明和阿扑吗啡(apomorphine,APO)均购自Sigma公司;氢溴酸槟榔碱购自上海西域机电系统有限公司;单臂脑立体定位仪购自深圳瑞沃德生命科技有限公司;吉量动物视频分析系统购自北京吉安得尔生命科技有限公司。
1.2 动物
Wistar大鼠,雄性,体质量200~220 g,合格证号:SCXK-(军)2007-004;昆明小鼠,雌雄各半,体质量18~22 g,合格证号:SCXK-(军)2007-004;均由军事医学科学院实验动物中心提供。C57BL/6雄性小鼠,体质量 18~22 g,合格证号:SCXK(京)2007-0001,由北京维通利华实验动物技术有限公司提供。
1.3 6-OHDA损毁大鼠中脑黑质-多巴胺神经元建立大鼠旋转模型[15]
行为学检查无自发旋转的大鼠ip给予地昔帕明30 mg·kg-1防止6-OHDA被去甲肾上腺素能神经末梢摄取。ip给予水合氯醛400 mg·kg-1麻醉大鼠并固定于脑立体定位仪上。切开头皮约1 cm,用5%过氧化氢溶液腐蚀筋膜。参照包新民等[16]著《大鼠立体定向图谱》确定注射靶点的坐标为黑质致密部:前囟后4.8 mm,矢状缝右侧1.7 mm,硬脑膜下7.5 mm;纹状体:前囟后1.0 mm,矢状缝右侧4.0 mm,硬脑膜下5.0 mm。按照确定坐标小心钻透颅骨,将微量进样器以1 mm·min-1速度进至预定深度。向目标部位注射6-OHDA 8 μg(溶于4 μl含质量分数0.002抗坏血酸的人工脑脊液中),注射速度为1 μl·min-1。注射完毕后留针 15 min,以1 mm·min-1速度缓慢退针,正常对照组以等量人工脑脊液代替。缝合伤口,连续7 d im给予青霉素100 000 U·kg-1防止感染。术后7 d,ip给予 APO 0.5 mg·kg-1,计数大鼠开始旋转后 30 min 内向健侧旋转次数,超过210次则视为建模成功。
1.3.1 单次给药实验
取第一次 ip 给予 APO 0.5 mg·kg-1后 30 min向健侧旋转次数>210次的大鼠,每组6只,24 h后再次注射APO诱导旋转,在第2次注射APO诱导旋转前30 min按照分组分别ig给予生理盐水(模型对照组),R-DM8021 0.2,0.5,1.0,2.0 mg·kg-1和苯海索 3.0,5.0 和 10.0 mg·kg-1,记录各组大鼠 30 min内向健侧旋转次数。结果采用变化率表示,变化率(%)=(给药后旋转次数-给药前旋转次数)/给药前旋转次数×100%。
1.3.2 给药21d治疗实验
取第一次 ip 给予 APO 0.5 mg·kg-1后 30 min向健侧旋转次数>210次的大鼠,每组6只,在第2次注射APO诱导旋转前30 min按照分组分别ig给予生理盐水(模型对照组),R-DM8021 0.2,0.5,1.0,2.0 mg·kg-1和苯海索 2.0 mg·kg-1,连续给药21 d,每天2次。分别于第7,14和21天药后30 min再次注射APO诱导旋转。治疗结果采用变化率表示。
1.3.3 观察给药7 d模型大鼠的自发活动[17]
记录大鼠 ip 给予 APO 0.5 mg·kg-1后 30 min向健侧旋转次数,超过210次者按照分组ig给予生理盐水(正常对照组和模型对照组),R-DM8021 0.2,0.5,2.0 和苯海索 2.0 mg·kg-1,每组6 只,每天2次,连续给药7 d后记录各组大鼠在10 min内自发活动路程。
1.4 槟榔碱致小鼠肌肉震颤模型的建立及分组[18]
将昆明小鼠随机分为模型组、R-DM8021 0.25,0.5,0.75,1,2.5,5,7.5,10,15,20,30 和 40 mg·kg-1以及苯海索 5,10,15,20,30,40,50,60,80和 100 mg·kg-1组,ig给予相应剂量药物,30 min后 ip注射氢溴酸槟榔碱 35 mg·kg-1,记录小鼠自注射槟榔碱后震颤反应持续时间以对震颤持续时间的抑制率为指标评价两药作用,震颤持续时间抑制率(%)=(持续时间模型组-持续时间药物组/持续时间模型组×100%。
1.5 MPTP小鼠PD模型的建立及分组[19]
将雄性C57BL/6小鼠随机分为正常对照组、模型组、R-DM8021 5.0,10.0 和 20.0 mg·kg-1和苯海索 20.0 mg·kg-1组,模型组和 R-DM8021 组连续 ip注射MPTP 30 mg·kg-17 d建立小鼠PD模型,正常对照组以等量生理盐水代替。模型建成后ig给予相应剂量药物,正常对照和模型组以等量生理盐水代替。每天2次,连续给药3 d,记录动物在3 min内自发活动路程。
1.6 统计学处理
2 结果
2.1 R-DM8021对6-OHDA模型大鼠APO诱导旋转行为的影响
多数成功模型大鼠于术后3~4周出现稳定的APO诱导的旋转行为,模型成功率为55%。表1结果显示,与模型对照组相比,单次ig给予R-DM8021 0.2 ~2.0 mg·kg-1分别使 APO 诱导的旋转次数增加(17.3 ± 4.5)% ~ (31.7 ±5.5)%;苯海索 3.0,5.0和10.0 mg·kg-1组 分 别增 加(18.8 ± 4.8)%,(22.2 ±17.3)%和(36.9 ±10.0)%,差异有统计学意义(P<0.05)。表2结果显示,连续给药21 d,大鼠APO诱导的旋转次数显著增加(P<0.01),并维持在稳定的水平,与等剂量的苯海索相比,R-DM8021对APO诱导旋转的作用更强,但无统计学差异。
2.2 R-DM8021对大鼠自发活动路程的影响
与正常对照组比较,建模成功后,模型组大鼠10 min内自发活动路程显著降低(P<0.01),连续给予R-DM8021和苯海索7 d可明显提高大鼠自发活动路程(P<0.05)(表3),R-DM8021对大鼠自发活动的改善效果显著优于等剂量的苯海索(P <0.01)。

表1 单次给予左旋去甲基盐酸苯环壬酯(R-DM8021)对阿扑吗啡(APO)诱导大鼠旋转行为的影响Tab.1 Effect of single administration of l-demethyl phencynonate hypdrochloride(R-DM8021)on rotation test evoked by apomorphine(APO)in rats
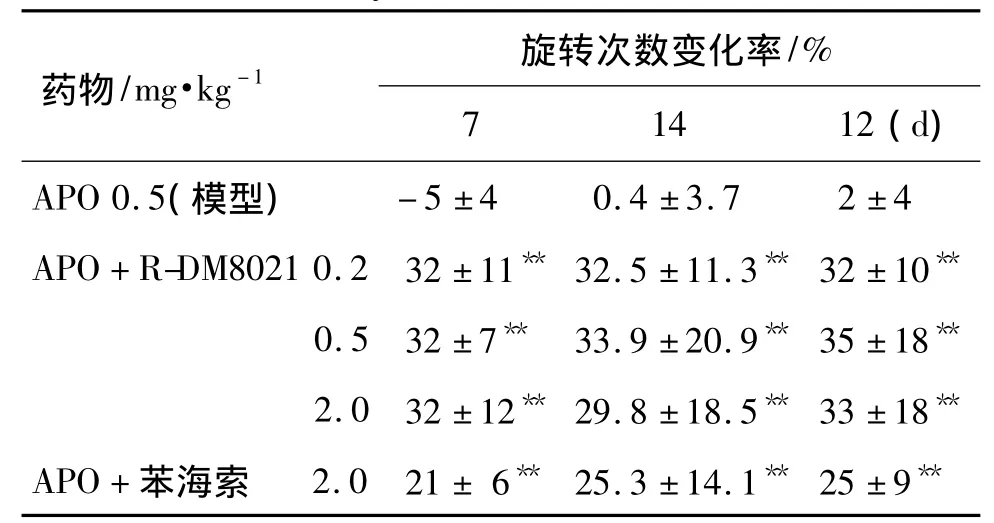
表2 长期给予R-DM8021对APO诱导大鼠旋转行为的影响Tab.2 Effect of long-term administration of R-DM8021 on rotation test evoked by APO in rats

表3 给予R-DM8021 7 d对大鼠自发活动的影响Tab.3 Effect of R-DM8021 for 7 d on locomotor activity in rats
2.3 R-DM8021对槟榔碱致小鼠肌肉震颤模型震颤持续时间的影响
小鼠ip给予槟榔碱35 mg·kg-1后,出现明显肌肉震颤,持续时间为(8.9 ±1.0)min,R-DM8021 和苯海索均可剂量依赖性地降低小鼠肌肉震颤持续时间(图1),R-DM8021 40 mg·kg-1和苯海索100 mg·kg-1可完全阻断槟榔碱致小鼠肌肉震颤反应,两药对槟榔碱致小鼠肌肉震颤持续时间抑制作用的ED50分别为(6.87 ±1.33)mg·kg-1和(41.14 ±9.31)mg·kg-1,两者相比具有显著性差异(P<0.01)。

图1 R-DM8021和苯海索对槟榔碱致小鼠震颤持续时间的影响.ig给予 R-DM8021 0.25~40 mg·kg-1以及苯海索 5~100 mg·kg-130 min 后,ip 注射氢溴酸槟榔碱 35 mg·kg-1.震颤持续时间抑制率(%)=(模型组持续时间-药物组持续时间)/模型组持续时间 ×100%.±s,n=8.Fig.1 Effect of R-DM8021 and trihexyphenidyl on the duration of tremor evoked by arecoline hydrobromide in mice.
2.4 R-DM8021对MPTP模型小鼠自发活动路程的影响
表4结果显示,建模成功后,小鼠3 min内自发活动路程较正常组显著降低(P<0.01),连续ig给予R-DM8021和苯海索3 d可明显提高小鼠自发活动路程,R-DM8021对小鼠自发活动的改善效果显著优于等剂量的苯海索(P<0.01)。
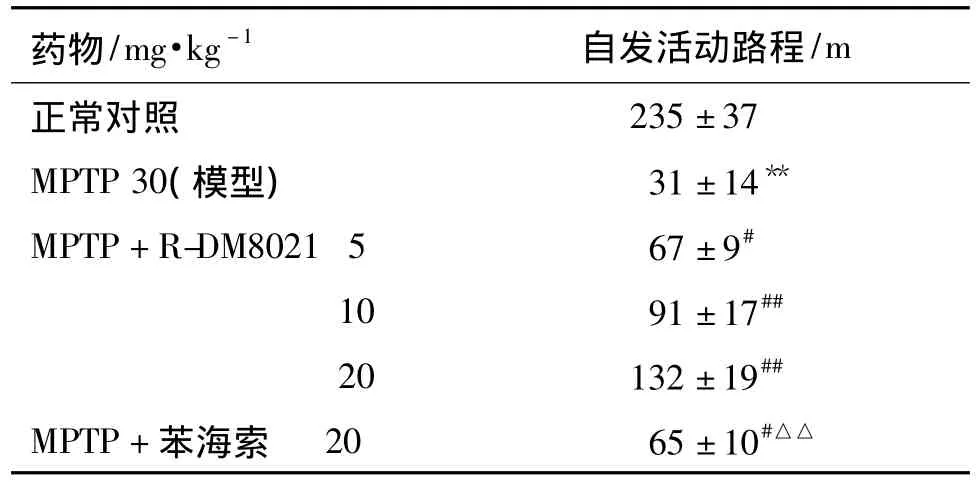
表4 R-DM8021 和苯海索对 1-甲基-4 苯基-1,2,3,6-四氢吡啶(MPTP)模型小鼠自发活动路程的影响Tab.4 Effect of R-DM8021 and trihexyphenidyl on locomotor activity in 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridin(MPTP)model mice
3 讨论
本研究在3种PD模型上评价新型抗胆碱药R-DM8021对模型动物行为的改善作用。结果表明,R-DM8021对3种PD模型动物行为的改善效果均优于临床常用抗胆碱药苯海索。本研究结果为临床开发新型抗胆碱药提供实验依据。
6-OHDA大鼠模型是经典的PD模型,能较好地模拟PD早期病理变化。6-OHDA损毁大鼠黑质神经元后损毁侧纹状体内多巴胺受体数量代偿性上调,敏感性增高,在多巴胺受体激动剂APO的作用下大鼠出现向健侧旋转的行为,旋转次数与其损伤侧黑质神经元的损伤程度和多巴胺受体的敏感性成正比[20]。大鼠实验结果发现,R-DM8021单次和长期给药均能显著增加模型大鼠APO诱导的旋转次数,而R-DM8021本身并不能诱导模型大鼠出现旋转行为,这提示R-DM8021能够协同APO增强后者对多巴胺受体的激动能力,其机制可能与增加损伤侧多巴胺受体功能有关,包括表达量的上调和敏感性的提高。此外,长期给予R-DM8021还能显著增加模型大鼠自发活动路程,且效果优于等剂量的苯海索,结果提示R-DM8021可显著改善6-OHDA定向损毁诱导的运动失能,疗效优于临床常用药物苯海索。
在肌肉震颤模型上,R-DM8021能显著降低模型小鼠肌肉震颤持续时间,ED50约为苯海索的1/6,抗胆碱作用显著强于后者,这可能与对M受体的亲和力和选择性有关,具体机制将进一步探讨。
1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)发现于20世纪80年代,具有特异性的神经毒性作用,MPTP能被黑质神经元选择性吸收通过阻断线粒体呼吸链复合物I的活性造成神经元的损伤,能导致人类及多种动物出现PD症状,被广泛用于建立PD模型[21]。在该模型上本研究进一步观察到与等剂量苯海索相比,R-DM8021对模型小鼠自发活动的改善作用显著强于前者,药效学评价同样强于临床常用药物苯海索,该作用可能对M受体的亲和力和选择性有关,对其具体机制的理解需要进一步研究。
综上所述,R-DM8021对3种PD动物模型的治疗作用均优于苯海索,有望成为治疗PD的新型抗胆碱药。
[1] Bartels AL,Leenders KL.Parkinson's disease:the syndrome,the pathogenesis and pathophysiology[J].Cortex,2009,45(8):915-921.
[2] Zhang ZX, Roman GC, Hong Z, Wu CB,Qu QM,Huang JB,et al.Parkinson's disease in China:prevalence in Beijing,Xi'an,and Shanghai[J].Lancet,2005,365(9459):595-597.
[3] Farooqui T,Farooqui AA.Aging:an important factor for the pathogenesis of neurodegenerative diseases[J].Mech Ageing Dev,2009,130(4):203-215.
[4] Lee FJ,Liu F.Genetic factors involved in the pathogenesis of Parkinson's disease[J].Brain Res Rev,2008,58(2):354-364.
[5] Migliore L, Coppedè F. Environment-induced oxidative stress in neurodegenerative disorders and aging[J].Mutat Res,2009,674(1-2):73-84.
[6] Drechsel DA,Patel M.Role of reactive oxygen species in the neurotoxicity of environmental agents implicated in Parkinson's disease[J].Free Radic Biol Med,2008,44(11):1873-1886.
[7] Fukae J,Mizuno Y,Hattori N.Mitochondrial dysfunction in Parkinson's disease[J].Mitochondrion,2007,7(1-2):58-62.
[8] Toulouse A,Sullivan AM.Progress in Parkinson's disease - where do we stand[J]?Prog Neurobiol,2008,85(4):376-392.
[9] Nagatsua T,Sawadab M.L-dopa therapy for Parkinson's disease:past,present,and future[J].Parkinsonism Relat Disord,2009,15(Suppl 1):S3-S8.
[10] Nadjar A,Gerfen CR,Bezard E.Priming for l-dopa-induced dyskinesia in Parkinson's disease:a feature inherent to the treatment or the disease[J]?Prog Neurobiol,2009,87(1):1-9.
[11] 高 洁,张惠娟.帕金森病治疗药物的特点[J].中国临床康复,2002,6(14):2127,2129.
[12] Wang LY, Wang Y, Zheng JQ, Zhong BH,Liu H,Dong SJ,et al.Pharmacological profiles of an anticholinergic agent,phencynonate hydrochloride,and its optical isomers[J].Acta Pharmacol Sin,2005,26(5):527-532.
[13] Wang LY,Zheng JQ,Wang Y,Zhong BH,Ruan JX,Liu LL.Comparative study on pharmacological effects of DM-phencynonate hydrochloride and its optical isomers[J].Acta Pharmacol Sin,2005,26(10):1187-1192.
[14] Langmead CJ,Watson J,Reavill C.Muscarinic acetylcholine receptors as CNS drug targets[J].Pharmacol Ther,2008,117(2):232-243.
[15] 刘 毅,杨明会,窦永起,王海明.6-羟基多巴胺诱发帕金森病大鼠模型的制作和评价[J].解放军医学杂志,2007,32(11):1160-1162.
[16] 包新民,舒斯云.大鼠脑立体定位图谱[M].北京:人民卫生出版社,1991:30-59.
[17] 张耀芬,段德义,徐群渊.6-羟基多巴胺帕金森病大鼠模型的制作和行为学评价[J].解剖科学进展,2005,11(1):49-53.
[18] 张如意,李 林,艾厚喜,叶翠飞.健行颗粒对3种拟帕金森病震颤模型小鼠的干预作用[J].中国康复理论与实践,2004,10(1):38-40.
[19] 许耀刚,庞晓峰,汲娟娟.MPTP损伤的小鼠PD模型的制作与评价[J].生物化学与生物物理进展,2006,33(10):1014-1018.
[20] Kerkerian L,Nieoullon A.Supersensitivity of presynaptic receptors involved in the dopaminergic control of striatal high affinity glutamate uptake after 6-hydroxydopamine lesion of nigrostriatal dopaminergic neurons[J].Exp Brain Res,1988,69(2):424-430.
[21] Smeyne RJ,Jackson-Lewis V.The MPTP model of Parkinson's disease[J].Brain Res Mol Brain Res,2005,134(1):57-66.

