5-羟基癸酸盐对大鼠低氧性肺动脉高压的抑制作用
张丽萍,李 秋,舒 鹰,李云雷,陈成水
(温州医学院附属第一医院呼吸内科,浙江温州 325000)
肺动脉高压(pulmonary arterial hypertension,PAH)是以肺小动脉的血管痉挛、内膜增生和重构及微血栓形成为主要特征的一种疾病[1],患者最终常因右心衰竭而死亡。离体实验研究表明,慢性低氧时大鼠肺动脉平滑肌细胞线粒体能够感受血氧的下降,引起线粒体膜电位的去极化,并通过一系列途径促进细胞增殖和抑制细胞凋亡,而线粒体膜上ATP敏感钾通道特异性抑制剂5-羟基癸酸盐(5-hydroxydecanoate,5-HD)能够降低线粒体膜电位最终使肺动脉平滑肌细胞凋亡增多以及增殖减少[2-3]。炎症机制在PAH的发生发展中起着重要的作用,然而目前尚无5-HD能通过调节外周及肺组织中的某些炎症因子及趋化因子而降低肺动脉压的报道。本研究通过对低氧性PAH大鼠血清及肺组织炎症指标及肺动脉压力和血管结构的检测,探讨5-HD对大鼠PAH影响的机制和其对炎症的作用,为PAH和肺源性心脏病新的防治方法的探索提供实验依据。
1 材料与方法
1.1 动物
健康清洁级雄性SD大鼠24只(由上海实验动物购买中心提供),体质量200~250 g。清洁级环境饲养,室温控制在22~25℃,湿度控制在40% ~70%,颗粒饲料喂养,自由饮水。
1.2 试剂及仪器
5-HD(美国Sigma公司),白细胞介素6(interleukin 6,IL-6),IL-8,巨噬细胞炎症蛋白(macrophage inflammatory protein,MIP)-1a及单核细胞趋化蛋白(monocyte chemoattractant protein,MCP)-1 ELISA 试剂盒(武汉华美生物技术有限公司),1%NP-40裂解液(江苏碧云天生物科技公司),IL-6,MCP-1山羊多克隆抗体(美国Santa公司),超敏即用型二步法(非生物素)检测试剂盒PV-9003及DAB显色试剂盒(北京中杉金桥生物技术有限公司),酶标仪(美国Biotek公司),MedLab生物数据记录分析系统(南京美易科技有限公司),Image-pro plus6.0图像采集系统(江苏省捷达科技发展有限公司)。
1.3 动物分组及模型制备
适应环境1周后,24只大鼠随机分成正常对照组、低氧模型组及低氧+5-HD组。将低氧模型组和低氧+5-HD组在常压低氧(9.5% ~10.5%)氧舱中进行低氧处理,采用间断性常压低氧模型,每天进行低氧处理8 h,每周6 d,舱内水分用无水氯化钙吸收,二氧化碳用钠石灰吸收。1周后,低氧模型组每天sc给予PBS 5 mg·kg-1溶液,低氧+5-HD组大鼠每天先sc给予5-HD 5 mg·kg-1,再进入低氧舱,连续3周。
1.4 血流动力学指标及右心室肥厚指数的计算
大鼠ip给予5%水合氯醛400 mg·kg-1溶液行全身麻醉,然后将大鼠仰卧固定,分离右颈外静脉,采用灌有肝素钠溶液的聚乙烯导管,自右颈外静脉插入,并将插管缓慢推入右心室进而插入肺动脉内,用YL-4型压力传感器,将信号联入MedLab生物数据记录分析系统,测定平均肺动脉压(mean pulmonary arterial pressure,mPAP)。采血后,开胸取出心脏,剪去左右心房、心耳、血管末端及其周围的组织后,沿肺动脉出口处剪开右心室,其余为左心室和室间隔组织,然后分别称重,按公式计算右心肥厚指数(right ventricular hypertrophy index,RVHI),RVHI=右心室质量/(左心室质量+室间隔组织质量)。
1.5 生物标本收集及处理
测压完毕后,立即右心室取静脉血3 ml,以700×g,4℃离心10 min后取上清液,-70℃冰箱保存,待测IL-6,IL-8,MIP-1a及MCP-1浓度。
处死大鼠,取右下肺组织,滤纸吸去表面的血迹和水分,用电子天平称取肺组织约200 mg后放入-70℃冰箱中备用。所有的标本收集完毕后,取出肺组织复温,剪碎,用1%NP-40裂解液裂解制备成肺组织匀浆,以6000×g,4℃离心5 min后,留取上清液待测IL-6,IL-8,MIP-1a及MCP-1浓度。
1.6 肺血管形态学分析
取左下肺组织,置于4%多聚甲醛溶液中固定,常规脱水、石蜡包埋、切片(3 μm)。在苏木素-伊红(HE)染色切片上,光镜下观察肺组织与肺动脉形态学改变,选取断面较圆的直径20~150 μm的肺细小动脉,用图像分析软件测定肺动脉相对中膜厚度(pulmonary artery medial thickness,PAMT)。
1.7 血清及肺中 IL-6,IL-8,MIP-1a及 MCP-1浓度测定
采用双抗体夹心酶联免疫吸附试验(ELISA)法测定,操作步骤严格按照说明书进行,用酶标仪测定波长450 nm吸光度值(absorbance,A)。
1.8 免疫组化法测定肺动脉和支气管中IL-6和MCP-1水平
免疫细胞化学染色采用超敏即用型二步法,按照PV-9003试剂盒说明书进行,并用二氨基联苯胺(DAB)显色。每种一抗的稀释度均为1∶100。正常对照组用PBS代替一抗。细胞质染成棕黄色为阳性细胞。每一标本在肺动脉及细小支气管各随机选取5个视野,用Image-pro plus6.0图像分析软件测定阳性产物的A值。
1.9 统计学分析
2 结果
2.1 5-羟基癸酸盐对低氧性肺动脉高压大鼠血流动力学指标及右心肥厚指数的影响
与正常对照组相比,低氧模型组mPAP及RVHI显著升高(P<0.05);与低氧模型组相比,低氧+5-HD组压及 RVHI显著降低(P<0.05),基本恢复至正常对照组水平。表明5-HD能降低大鼠的PAH及 RVHI(表1)。
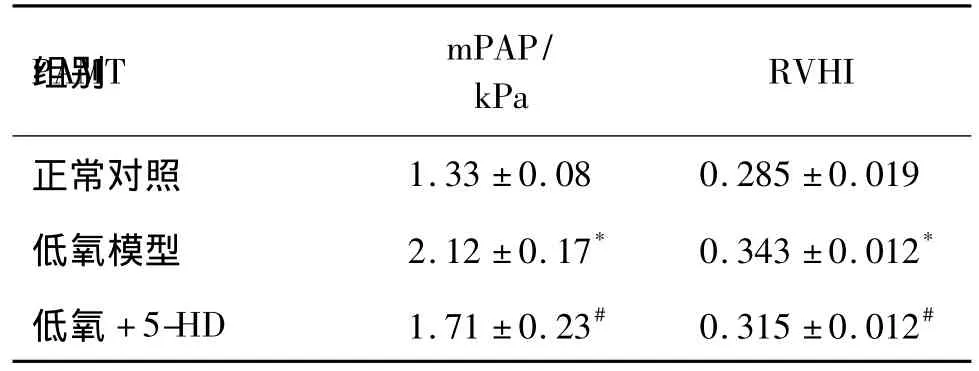
表15-羟基癸酸盐(5-HD)对低氧性肺动脉高压(PAH)大鼠肺动脉平均压(mPAP)和右心肥厚指数(RVHI)的影响Tab.1 Effect of 5-hydroxydecanoate(5-HD)on mean pulmonary arterial pressure(mPAP)and right ventricular hypertrophy index(RVHI)in hypoxia-induced pulmonary arterial hypertension(PAH)rats
2.2 5-羟基癸酸盐对低氧性PAH大鼠肺小血管组织形态的影响
光镜下观察HE染色肺组织切片显示,正常组大鼠肺小动脉管壁较薄,管腔较大(图1A);低氧模型组大鼠肺小动脉中膜平滑肌细胞显著增生,管壁明显增厚,管腔明显狭窄,出现了肺血管重构现象(图1B);而低氧+5-HD组大鼠肺小动脉中膜平滑肌细胞增殖受抑,管壁明显变薄,管腔变大,肺血管重构程度较低氧模型组明显减轻(图1C)。肺小动脉图像分析结果显示,低氧模型组PAMT为0.311±0.030,较正常对照组0.169±0.033显著升高(n=8,P <0.05),与低氧模型组比较,5-HD组PAMT的0.197±0.027显著降低(P <0.05)。
2.3 5-HD对低氧性大鼠血清及肺匀浆中 IL-6,IL-8,MIP-1a和MCP-1水平的影响
如表2和表3所示,与正常对照组相比,低氧模型组大鼠血清IL-6,IL-8,MIP-1a,MCP-1水平均显著升高(P<0.05);与低氧模型组相比,而5-HD组大鼠血清IL-8,MIP-1a,MCP-1水平显著降低(P<0.05),但IL-6水平与低氧模型组比较无明显差异;在肺匀浆中各组大鼠的IL-6,IL-8,MIP-1a,MCP-1水平均无明显差异。表明5-HD能降低PAH大鼠循环血中IL-8,MIP-1a和MCP-1水平。
2.4 5-HD对肺动脉和支气管中IL-6和MCP-1的影响
低氧模型组肺动脉中IL-6和MCP-1表达水平明显高于正常对照组(P<0.05),5-HD组肺动脉中IL-6,MCP-1表达水平与低氧模型组比较无明显差异,但均有下降趋势(图2A,图3A,表4)。本实验结果还显示,低氧模型组支气管IL-6表达水平明显高于正常对照组(P<0.05),而5-HD组支气管IL-6表达水平与低氧模型组比较无明显差异;各组支气管MCP-1表达水平差异均无统计学意义(图2B,图3B,表4和表5)。
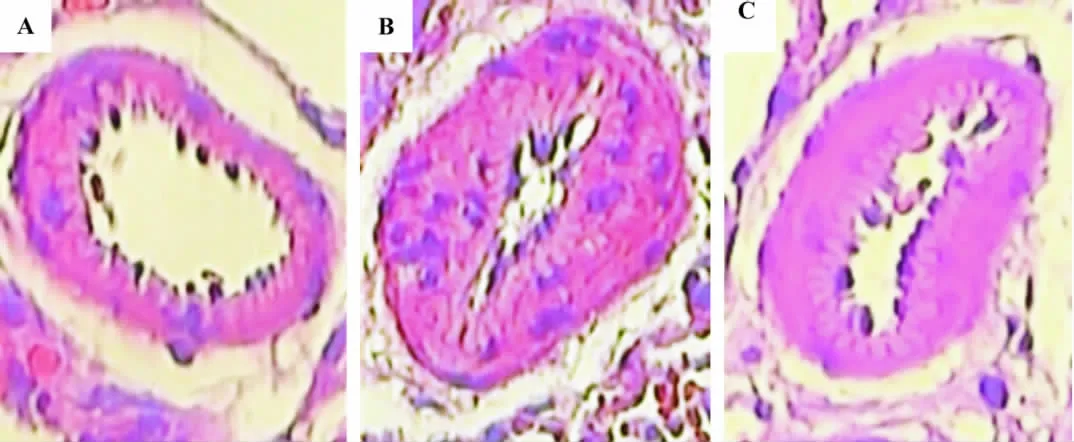
图1 5-HD对低氧性PAH大鼠肺动脉形态的影响 (HE,×200).A:正常对照;B:低氧模型;C:低氧+5-HD.Fig.1 Effect of 5-HD on pulmonary artery histopathology in hypoxia-induced PAH rats(HE,×200).
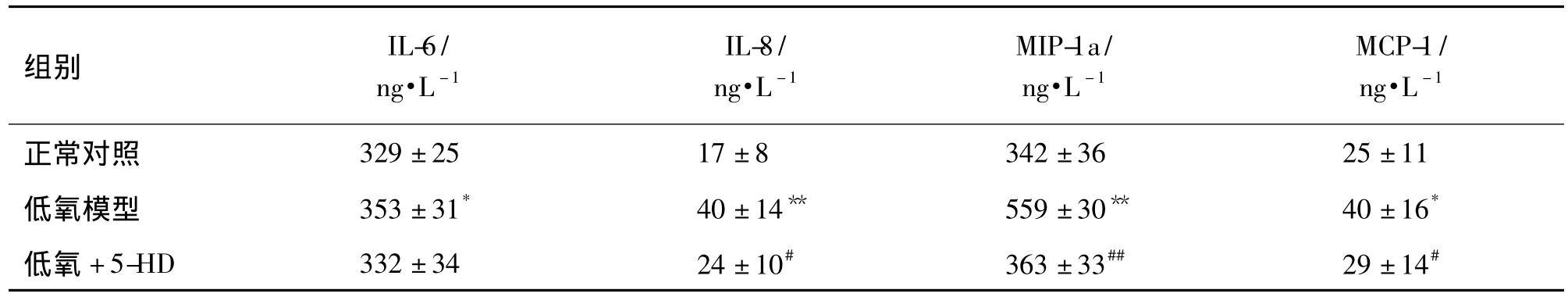
表25-HD对低氧性PAH大鼠血清中白细胞介素IL-6,IL-8,巨噬细胞炎症蛋白(MIP)-1a和单核细胞趋化蛋白(MCP)-1水平的影响Tab.2 Effect of 5-HD on interleukin 6(IL-6),IL-8,macrophage inflammatory protein(MIP)-1a and monocyte chemoattractant protein(MCP)-1 in the serum of hypoxia-induced PAH rats

表35-HD对低氧性PAH大鼠肺中IL-6,IL-8,MIP-1a和MCP-1水平的影响Tab.3 Effect of 5-HD on IL-6,IL-8,MIP-1a and MCP-1 in the lungs of hypoxia-induced PAH rats
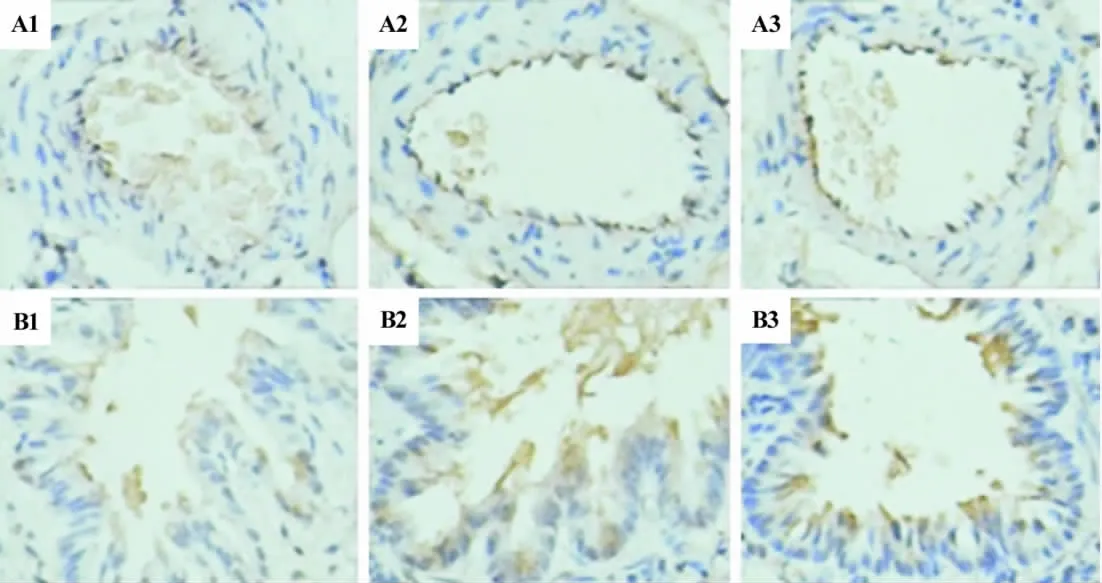
图25-HD对低氧性PAH大鼠肺动脉(A)及支气管(B)中IL-6水平的影响 (DAB ×400).棕黄色阳性表达细胞.1:正常对照组;2:低氧模型组;3:低氧+5-HD组.Fig.2 Effect of 5-HD on the IL-6 level of pulmonary artery(A)and bronchia(B)in hypoxia-induced PAH rats by immunohistochemistry(DAB ×400).
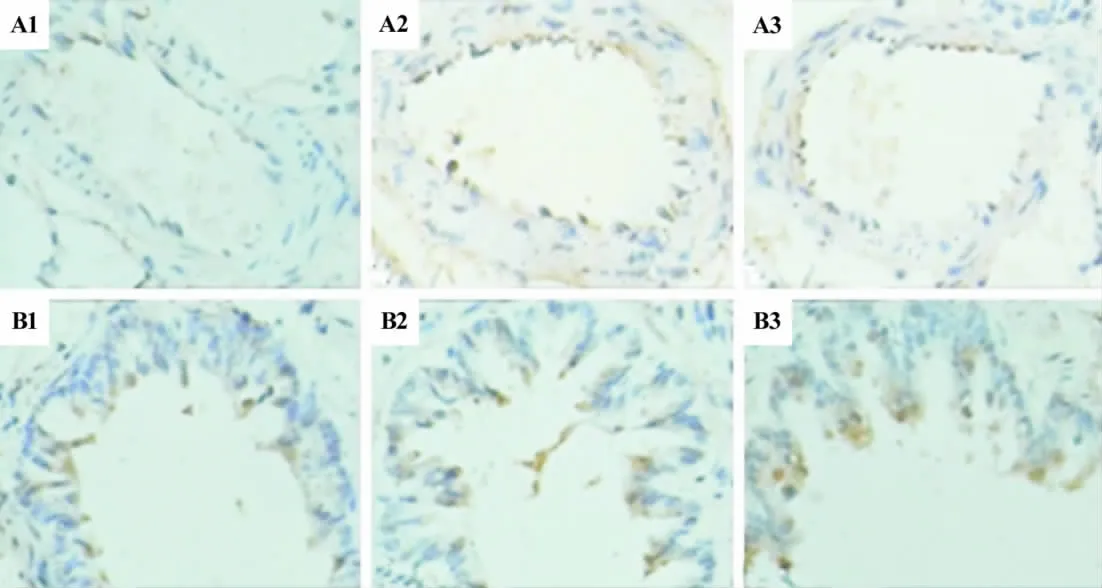
图35-HD对低氧性PAH大鼠肺动脉(A)及支气管(B)中MCP-1表达的影响.(DAB ×400).棕黄色阳性表达细胞.1:正常对照组;2:低氧组;3:低氧+5-HD组.Fig.3 Effect of 5-HD on the MCP-1 level of pulmonary artery(A)and bronchia(B)in hypoxia-induced PAH rats by immunohistochemistry(DAB ×400).
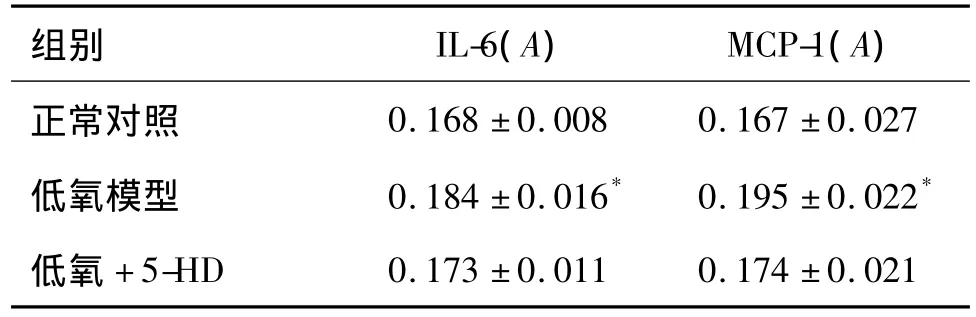
表45-HD对低氧性PAH大鼠肺动脉中IL-6和MCP-1水平的影响Tab.4 Effect of 5-HD on IL-6 and MCP-1 in pulmonary artery of hypoxia-induced PAH rats
动物分组处理见表1.采用超敏即用二步法测定肺动脉中炎症因子

表55-HD对低氧性PAH大鼠支气管中IL-6和MCP-1水平的影响Tab.5 Effect of 5-HD on IL-6 and MCP-1 levels in bronchia of hypoxia-induced PAH rats
3 讨论
肺血管重构是低氧引起的PAH中晚期的主要表现,是由于血管壁细胞增殖和凋亡失衡所致[4]。内皮功能的失调是PAH的特征性表现,内皮功能失调导致血管舒张因子和收缩因子平衡失调,影响肺动脉平滑肌细胞,使血栓形成及炎症细胞因子产生[5],导致肺动脉平滑肌细胞发生增殖,使管壁增厚,管腔狭窄。本实验成功复制了低氧性PAH的模型,表现为mPAP增高,肺小动脉管壁增厚,管腔变小,右心室肥厚。
已有大量证据支持炎症机制参与PAH的病理生理过程[6-7]。PAH患者的循环血IL-1和IL-6等炎症细胞因子及MIP-1a,MCP-1,T细胞激活分泌调节因子和表皮可溶性趋化因子等趋化因子的水平升高,周围血管有淋巴细胞和吞噬细胞等炎症细胞的浸润[8-10]。IL-6是一种由内皮细胞、平滑肌细胞、巨噬细胞和成纤维细胞等产生和分泌的多功能的炎症前细胞因子,在PAH形成过程中有调节肺血管炎症及重塑的作用。IL-8是重要的趋化和激活多形核中性粒细胞的细胞因子,能够激活中性粒细胞和趋化吸引中性粒细胞到炎症部位,触发脱颗粒和表面黏附分子的表达及活性氧分子产物的释放,是中性粒细胞激活和迁移的重要调节因子。MIP-1a和MCP-1均属于趋化因子家族中成员,由内皮细胞、平滑肌细胞和巨噬细胞等炎症细胞分泌,能够促使单核细胞由外周循环迁移至炎症部位聚集并激活,加重局部炎症反应。MIP-1a一方面可通过调节炎症过程促使PAH的形成,另一方面通过促进血管生成而促使PAH基础病理形成[11]。本研究结果显示,低氧模型组血清中IL-6,IL-8,MIP-1a和MCP-1水平均明显高于正常对照组,提示低氧可加重肺循环炎症反应,引起循环血中炎症因子及趋化因子表达增加,这与国外的多项研究结果相符[6,12-13]。
研究显示,在机体低氧的情况下,mitoKATP通道开放,K+内流,线粒体膜去极化,从而影响细胞氧自由基、细胞色素C等的生成和分配及多种蛋白激酶或转录因子的活性,抑制细胞凋亡[14-15]。前期在体实验已经证实,5-HD能降低低氧引起的大鼠PAH及肺血管重构[16]。但对于5-HD是如何降低在体大鼠PAH的机制尚不明确。本研究结果显示,应用5-HD能显著降低低氧引起的大鼠肺动脉平均压及RVHI,并显著降低血清中IL-8,MIP-1a和MCP-1水平。5-HD可能通过抑制某些趋化因子的分泌,减轻低氧引起的PAH大鼠的炎症反应。肺组织匀浆中IL-6,IL-8,MIP-1a和MCP-1水平在各组中的表达未见明显差别,提示PAH大鼠总体炎症因子的水平主要取决于循环血而并非由肺部决定。
免疫组化研究结果显示,低氧能诱导肺动脉IL-6和MCP-1表达增加,这与以往实验结果符合[17],5-HD干预后其表达有所下降。低氧还能诱导大鼠支气管中IL-6表达增加,而5-HD并不能减少其在支气管的表达;并发现MCP-1对支气管无显著影响。
综上所述,目前研究表明,mitoKATP的抑制剂5-HD对在体大鼠PAH具有一定的抗炎作用。5-HD可能具有有效降低低氧性PAH大鼠循环血中IL-8,MIP-1a和MCP-1水平,延缓PAH的发生,降低PAH的严重程度。但由于目前5-HD在PAH中的研究仍属较少,其具体机制及对其他器官的作用有待进一步研究和证实。
[1] Jeffery TK,Morrell NW.Molecular and cellular basis of pulmonary vascular remodeling in pulmonary hypertension[J].Prog Cardiovasc Dis,2002,45(3):173-202.
[2] 胡红玲,汪 涛,张珍祥,赵建平,徐永健.线粒体膜电位对缺氧人肺动脉平滑肌细胞内氧自由基的变化及细胞增殖的作用[J].中华结核和呼吸杂志,2006,29(11):727-730.
[3] Wang T,Zhang ZX,Xu YJ,Hu QH.5-Hydroxydecanoate inhibits proliferation of hypoxic human pulmonary artery smooth muscle cells by blocking mitochondrial K(ATP)channels[J].Acta Pharmacol Sin,2007,28(10):1531-1540.
[4] Prabha M,Jin HF,Tian Y,Tang CS,DU JB.Mechanisms responsible for pulmonary hypertension[J].Chin Med J(Engl),2008,121(24):2604-2609.
[5] Morrell NW,Adnot S,Archer SL,Dupuis J,Jones PL,MacLean MR,et al.Cellular and molecular basis of pulmonary arterial hypertension[J].J Am Coll Cardiol,2009,54(1 Suppl):S20-S31.
[6] Tuder RM,Voelkel NF.Pulmonary hypertension and inflammation[J].J Lab Clin Med,1998,132(1):16-24.
[7] Humbert M,Monti G,Brenot F,Sitbon O,Portier A,Grangeot-Keros L,et al.Increased interleukin-1 and interleukin-6 serum concentrations in severe primary pulmonary hypertension[J].Am J Respir Crit Care Med,1995,151(5):1628-1631.
[8] Savale L,Tu L,Rideau D,Izziki M,Maitre B,Adnot S,et al.Impact of interleukin-6 on hypoxia-induced pulmonary hypertension and lung inflammation in mice[J].Respir Res,2009,10:6.
[9] Dorfmüller P,Zarka V,Durand-Gasselin I,Monti G,Balabanian K,Garcia G,et al.Chemokine RANTES in severe pulmonary arterial hypertension[J].Am J Respir Crit Care Med,2002,165(4):534-539.
[10] Balabanian K,Foussat A,Dorfmüller P,Durand-Gasselin I,Capel F,Bouchet-Delbos L,et al.CX(3)C chemokine fractalkine in pulmonary arterial hypertension[J].Am J Respir Crit Care Med,2002,165(10):1419-1425.
[11] Pellegrino A,Vacca A,Scavelli C,Dammacco F.Chemokines and tumors[J].Recent Prog Med,2002,93(11):642-654.
[12] Itoh T,Nagaya N,Ishibashi-Ueda H,Kyotani S,Oya H,Sakamaki F,et al.Increased plasma monocyte chemoattractant protein-1 level in idiopathic pulmonary arterial hypertension[J].Respirology,2006,11(2):158-163.
[13] Sanchez O,Marcos E,Perros F,Fadel E,Tu L,Humbert M,et al.Role of endothelium-derived CC chemokine ligand 2 in idiopathic pulmonary arterial hypertension[J].Am J Respir Crit Care Med,2007,176(10):1041-1047.
[14] Xu MF,Wang YG,Ayub A,Ashraf M.Mitochondrial KATPchannel activation reduces anoxic injury by restoring mitochondrial membrane potential[J].Am J Physiol Heart Circ Physiol,2001,281(3):1295-1303.
[15] Platoshyn O, Zhang S, McDaniel SS, Yuan JX.Cytochrome c activates K+channels before inducing apoptosis[J].Am J Physiol Cell Physiol,2002,283(4):C1298-C1305.
[16] 董 莉,朱海萍,李云雷,李 秋,陈成水.5-差劲基癸酸盐对低氧肺动脉高压大鼠肺血管重建的影响及其机制[J].温州医学院学报,2010,40(15):445-449.
[17] Yan SF,Tritto I,Pinsky D,Liao H,Huang J,Fuller G,et al.Induction of interleukin 6(IL-6)by hypoxia in vascular cells.Central role of the binding site for nuclear factor-IL-6[J].J Biol Chem,1995,270(19):11463-11471.

