cAMP-PKA信号通路对L02细胞药物代谢酶CYP3A的调控作用
李 敏,张 冰,刘小青
(1.陕西中医学院药学院,陕西咸阳 712046;2.北京中医药大学中药学院,北京 100102)
肝是机体药物代谢的主要器官,大多数药物都要经过肝代谢酶作用发挥效应,其中细胞色素P4503A(cytochrome P4503A,CYP3A)是最主要的药物代谢酶。CYP3A的活性直接影响药物对机体的治疗作用及毒性反应[1]。CYP3A表达主要通过核受体孕烷X受体(pregnane X receptor,PXR)调控[2]。cAMP-PKA信号通路介导体内多种信号传导,该信号通路可能调节 CYP3A 的表达[3]。8-Br-cAMP和 H-89 分别是cAMP-PKA信号通路的激动剂和抑制剂,本实验研究8-Br-cAMP及H-89作用于L02细胞,观察CYP3A的变化,研究CYP3A的表达机制,探讨该信号通路对药物代谢酶的影响。
1 材料与方法
1.1 药品、试剂和仪器
L02细胞由北京中医药大学中药学院生物技术系王春梅老师惠赠。锥虫蓝(MTT),8-Br-cAMP和H-89均购自美国Sigma公司;RPMI1640培养基(干粉)、胎牛血清、D-Hanks均购自美国Gibco公司;无水甲醇、磷酸二氢钾、磷酸、异丙醇均为分析纯,购自北京化学试剂公司。胰酶、青霉素和链霉素购自Gibco公司。
超净工作台(天津医药净化设备厂);CO2细胞培养箱(美国Nap-co公司);Bio-Rad-550酶标仪(美国Metertech公司);低温高速离心机、Nikon生物显微镜和NIS图像采集分析系统(日本Nikon公司);电泳仪和转膜机(美国Bio-Rad公司)。
1.2 细胞培养及MTT法[4]检测L02细胞活性
液氮罐中取出冻存的L02细胞株,复苏培养,培养基为 1640(含 10%FCS,青霉素100 kU·L-1,链霉素100 kU·L-1),置 37℃、5%CO2饱和湿度培养箱中培养,24 h后更换培养基,细胞为单层贴壁生长,当细胞贴壁大于85%时(对数生长期)可传代培养。
细胞传至第四、五代状态较好时,调整细胞密度108L-1,培养12 h后,大于85%的细胞贴壁,吸出原培养基,按组别分别加入含药的无血清培养基,每孔加入 100 μl浓度为 10-3,10-4,10-5,10-6,10-7,10-8和10-9mol·L-1的 8-Br-cAMP 或 H-89 溶液,设5 个复孔,培养48 h,每孔加20 μl MTT 溶液5 g·L-1(pH=7.4)。继续孵育4 h后,小心吸弃孔内培养上清液。每孔加二甲亚砜150 μl,微量振荡器振荡10 min,在波长 570 nm酶标仪测定吸光度(absorbance,A)值,观察8-Br-cAMP和H-89对细胞活力的影响。
1.3 L02细胞分组处理
L02细胞108L-1,接种于12孔板,正常对照组,8-Br-cAMP 10 μmol·L-1组,H-89 10 μmol·L-1组,培养48 h后收集细胞,检测相关指标,每组设3个平行,重复3次,测PKA的培养孔中放入圆形盖玻片,细胞爬片后做免疫组化用。
1.4 免疫组化法检测PKA表达
有盖玻片的培养板小心吸去培养液,加入4%的多聚甲醛,4℃,固定24 h。取出盖玻片,依次用PBS漂洗3×5 min,3%的H2O220 min。① 兔抗PKA抗体稀释液(1∶100,武汉博士德)孵育24 h(4℃),37℃复温40 min,PBS漂洗3×5 min;②二抗羊抗兔IgG 37℃ 40 min,PBS漂洗 3×5 min;③ DAB 显色。常规脱水、透明、封固,光镜下观察并拍摄照片。采用图像分析系统测定PKA阳性免疫反应产物的积分灰度值(着色深者灰度值低)进行分析。
1.5 Western印迹法检测PXR表达
小心倾去培养液,用PBS洗2次,0.25%胰酶消化,收集细胞,126×g离心5 min,小心吸出上清液,PBS再清洗,126×g离心5 min,倒净 PBS,加入200 μl裂解液(1.4 ml单去污剂裂解液和 20 μl PMSF),冰上裂解 30 min,4℃,13 427×g离心 8 min,吸取约 170 μl,-80℃保存待测。
采用考马斯亮蓝法测定蛋白含量,每孔加40 μl蛋白,采用SDS-PAGE电泳,13%分离胶,5%的浓缩胶,半干转膜法将蛋白转至PVDF膜上,0.5%脱脂奶粉封闭1 h后加入β肌动蛋白一抗4℃过夜(1∶2000)。用含吐温-20的PBS(PBST)洗涤3次,每次5 min,加入二抗,密封,室温1 h,PBST液洗3次,加入PXR 一抗(1∶150),室温1 h,PBST 液洗3 次,加二抗,PBST液洗3次,加显色剂2 min,在暗室内压胶片曝光,观察结果并扫描分析。PXR表达水平用目的条带积分吸光度值(integrated absorbance,IA)与内参β肌动蛋白条带的IA比值定量表示。
1.6 红霉素-N-脱甲基法检测CYP3A的活性
倾去培养液,PBS洗2次,0.25%胰酶消化,收集细胞,4023×g离心10 min,吸出上清液,加入0.2 ml pH 7.4的甘油磷酸缓冲液重悬细胞,用超声破碎仪破碎细胞,1450×g,4℃离心15 min,取上清液,按照红霉素-N-脱甲基法检测CYP3A的活性[5]。
1.7 统计学分析
2 结果
2.1 8-Br-cAMP和H-89对L02细胞活力的影响
与正常对照组比较,8-Br-cAMP 1 mmol·L-1使细胞活性明显降低(P <0.05),H-89 1 和 0.1 mmol·L-1使细胞活性明显降低 (表 1)。所以8-Br-cAMP和H-89选择对细胞没有损害的10 μmol·L-1作为实验浓度。

表1 8-Br-cAMP和H-89对L02细胞活力影响Tab.1 Effect of 8-Br-cAMP and H-89 on the activity of L02 cells
2.2 8-Br-cAMP和H-89对L02细胞PKA表达的影响
如图1所示,PKA主要分布在胞浆之中,免疫组化染色后,可发现细胞胞浆中分布着棕黄色阳性颗粒。正常对照组有部分阳性细胞,胞浆分布有棕黄色颗粒,正常对照组PKA表达灰度值211±20相比,8-Br-cAMP 10 μmol·L-1组阳性细胞数较多,且阳性颗粒着色较深,其阳性面积及PKA表达灰度值(296±18)明显增加(P <0.05,P <0.01),H-89 组阳性细胞数较少、颗粒着色也比较浅,PKA表达灰度值(176±14)显著降低(P <0.05)。
2.3 8-Br-cAMP和H-89对L02细胞PXR表达的影响
与正常对照组比较,8-Br-cAMP 10 μmol·L-1作用于细胞后,细胞PXR表达明显增强(P<0.05),而 H-89 10 μmol·L-1组 PXR 表达没有明显差异(图2)。
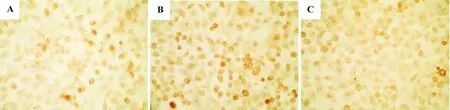
图18-Br-cAMP和H-89对L02细胞PKA蛋白表达影响 (×400).A:正常对照组;B:8-Br-cAMP 10 μmol·L-1组;C:H-89 10 μmol·L-1组.Fig.1 Effect of 8-Br-cAMP and H-89 on the expression of PKA in L02 cells(×400).
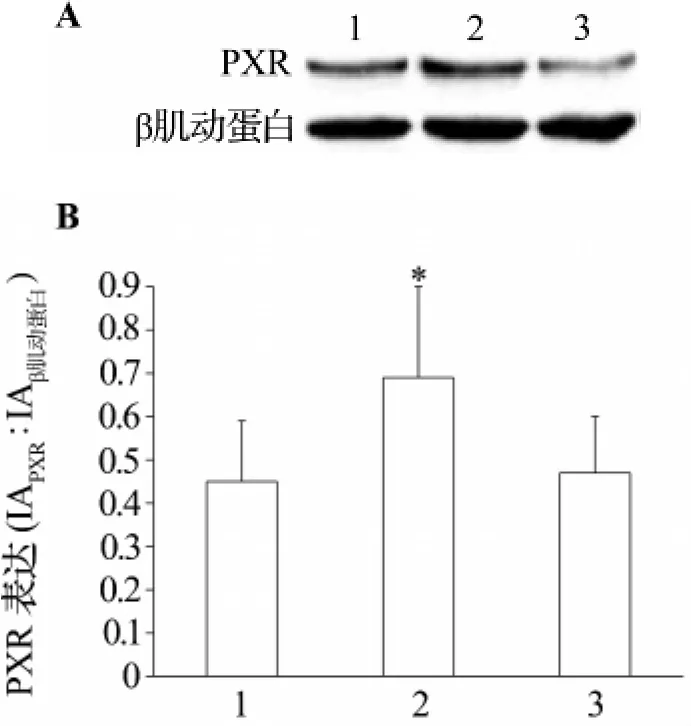
图2 Western印迹法检测8-Br-cAMP和H-89对LO2细胞孕烷X受体(PXR)表达的影响.1:正常对照;2:8-Br-cAMP 10 μmol·L - 1;3:H-89 10 μmol·L -1 .Fig.2 Effect of 8-Br-cAMP and H-89 on the expression of PXR in L02 cells detected by Western blotting.
2.4 8-Br-cAMP和 H-89对 L02细胞 CYP3A活性的影响
与正常对照组比较,8-Br-cAMP 10 μmol·L-1作用于L02细胞后,细胞CYP3A活性明显增强(P<0.05),H-89 10 μmol·L-1组细胞 CYP3A 活性无明显差异(表2)。
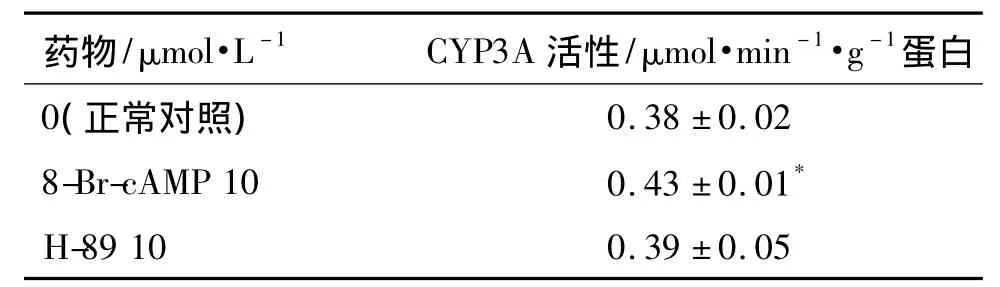
表28-Br-cAMP和H-89对L02细胞中CYP3A活性的影响Tab.2 Effect of 8-Br-cAMP and H-89 on the activity of CYP3A in L02 cells
3 讨论
肝药物代谢酶的表达及活性变化直接影响药物的体内过程,使药物血药浓度变化,对机体产生不同的生物学效应。CYP3A是肝Ⅰ相药物代谢酶中较为重要的代谢酶,介导临床60%药物的代谢,与药物效应密切相关,CYP3A的表达主要由上游因子PXR调控。cAMP-PKA信号通路介导机体多种生物效应[6],与 CYP3A 的表达也密切关联[3]。
本研究通过体外实验,观察cAMP-PKA信号通路药物代谢酶CYP3A的调控作用。L02细胞是体外培养的正常人类肝脏细胞,肝脏是药物代谢酶存在的主要器官,因此L02细胞中有较完整的肝脏药物代谢酶系,可作为体外实验考察肝脏药物代谢酶变化合适的细胞株。故实验选用L02细胞,考察cAMP-PKA通路激动剂8-Br-cAMP、抑制剂H-89对L02细胞中CYP3A及PXR的影响,探讨cAMP-PKA通路对CYP3A的调控的机制[7-8]。
实验应用 MTT[8]法观察8-Br-cAMP,H-89对细胞活性的影响,选择合适的实验浓度。结果显示,8-Br-cAMP 1 mmol·L-1有一定的细胞毒性,随着浓度降低,对细胞损害越小,8-Br-cAMP 10 μmol·L-1及更低的浓度时,对细胞基本没有损害,故选用8-Br-cAMP 10 μmol·L-1作为实验浓度。同样选择 H-89 10 μmol·L-1作为实验浓度。
8-Br-cAMP 和 H-89 10 μmol·L-1作用于 L02 细胞后,PKA,PXR和CYP3A都发生变化。8-Br-cAMP 10 μmol·L-1,可以增强细胞中 PKA 和 PXR 表达,并上调 CYP3A 的活性,可见 8-Br-cAMP 10 μmol·L-1可以上调cAMP-PKA通路,并能增强PXR表达,从而使CYP3A 活性增强。H-89 10 μmol·L-1使 L02 细胞的PKA表达降低,对细胞的PXR表达、CYP3A的活性影响不大。可见,cAMP-PKA信号通路处于上调状态时可以增强PXR表达,从而增加CYP3A的活性,说明cAMP-PKA信号通路可以调控CYP3A的表达。H-89 10 μmol·L-1使 cAMP-PKA 信号通路处于抑制状态,PKA表达下降,PXR蛋白表达和CYP3A活性无明显改变,说明cAMP-PKA信号通路抑制时,可能存在其他途径诱导PXR介导的CYP3A的表达,其综合效应使PXR蛋白表达和CYP3A活性无明显变化,可见,除了cAMP-PKA信号通路,同时可能还有其他途径共同调控CYP3A的表达。
cAMP-PKA信号通路在CYP3A表达中有积极意义,是影响CYP3A表达的途径之一,进一步实验宜从基因和蛋白层次观察该通路对CYP3A表达的影响。可见,通过干预机体cAMP-PKA信号通路,影响CYP3A表达,可改变机体药物代谢水平,为研究影响药效的深层次机制提供实验依据。
[1] 冷欣夫,邱星辉.细胞色素p450酶系的结构、功能与应用前景[M],北京:科学出版社,2001:78,139.
[2] Lehmann JM,McKee DD,Watson MA,Willson TM,Moore JT,Kliewer SA.The human orphan nuclear receptor PXR is activated by compounds that regulate CYP3A4 gene expression and cause drug interactions[J].J Clin Invest,1998,102(5):1016-1023.
[3] Ding X,Staudinger JL.Induction of drug metabolism by forskolin:the role of the pregnane X receptor and the protein kinase a signal transduction pathway[J].J Pharmacol Exp Ther,2005,312(2):849-856.
[4] 张均田.现代药理实验方法[M].北京:北京医科大学中国协和医科大学联合出版社,1998:1651-1652.
[5] 孙大业,郭艳林,马力耕.细胞信号转导[M].北京:科学出版社,1998:52,65.
[6] 程东军,徐永健,刘先胜,熊盛道,张珍祥.PKA和PKG信号通道对平滑肌细胞Kv亚型1.5表达的影响[J].医药论坛杂志,2007,28(16):1-3.
[7] Lo KW,Ashe KM,Kan HM,Lee DA,Laurencin CT.Activation of cyclic AMP/protein kinase:a signaling pathway enhances osteoblast cell adhesion on biomaterials for regenerative engineering[J].J Orthop Res,2011,29(4):602-608.
[8] Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J].J Immunol Methods,1983,65(1-2):55-63.

