猪IgGⅡB类Fc受体剪接异构体胞外区及结构域的原核表达与抗体制备
刘肖萍,张志远,刘玉松,赵 琳,范 旭,徐红运,张凤华,夏平安,崔保安
(河南农业大学牧医工程学院,河南郑州450002)
Fc受体(FcR)是特异亲和免疫球蛋白(Ig)Fc片段的细胞表面分子,广泛表达于效应细胞和免疫辅助细胞表面[1],属于 Ig基因超家族成员.Fc受体通过与Ig Fc区域结合,参与Ig介导的生理功能或病理损伤过程,它不仅赋于免疫细胞杀伤病毒与细菌、清除免疫复合物、溶解癌变细胞的能力,而且参与免疫反应的启动与调节,在免疫防御中发挥非常重要的作用[2].
人的 FcγR 有 FcγRI,FcγRII,FcγRIII共3 个亚群,小鼠的 FcγR 有 FcγRI,FcγRII,FcγRIII,FcγRIV共4个亚群,每一个亚群都存在几种亚类和不同的RNA剪接异构体.FcγR在功能上可以分为活化性受体和抑制性受体.前者大都通过偶联含有免疫受体酪氨酸激活基序ITAM的γ二聚体传递活化信号;后者则主要通过自身分子胞浆区的免疫受体酪氨酸抑制基序ITIM传导抑制信号.FcγRIIB作为目前唯一发现的抑制性FcγR,在天然免疫和适应性免疫反应的负性调节方面发挥重要作用[3].从猪体内分离到的 Fc 受体有 FcγRI,FcγRII,FcγRIII 3 个亚群[4~6].猪的 FcγRIIB(swFcγRIIB)氨基酸序列与人、鼠的相比较,有高度的同源性,胞内区都含有1个保守的ITIM抑制基序.推断猪FcγRIIB可能有相似的抑制功能[5].QIAO 等[5]克隆并鉴定了swFcγRIIB受体,其胞外区含有 2个 Ig结构域(EC1,EC2).刘玉松等[7,8]随后发现其存在 RNA剪接异构体 swFcγRIIB1(GenBank accession No.FJ608551),与 swFcγRIIB受体相比,胞内区有57个碱基的插入,为了进一步研究swFcγRIIB1各结构域的生物学功能及其免疫调节机制,本研究表达了 swFcγRIIB1 胞外区 swFcγRIIB1-EY,EC1 结构域swFcγRIIB1-AY 和 EC2结构域 swFcγRIIB1-BY 融合蛋白.并对表达蛋白进行纯化,用3种纯化蛋白分别免疫小鼠,制备抗3种融合蛋白多克隆抗体,经Western blot检测证实制备的多抗可以与各自的融合蛋白特异性结合,表明制备的多抗具有高度特异性.从而为进一步研究swFcγRIIB RNA剪接异构体swFcγRIIB1结构、功能和免疫特性奠定了基础.
1 材料与方法
1.1 质粒与菌株
猪 FcγRIIB1 克隆载体 pTG19-T-swFcγRIIB1,原核表达载体pET-32a,宿主菌 DH5α,BL21均由河南农业大学兽医微生物与免疫学研究室保存.
1.2 主要试剂
T4 DNA连接酶、rTaq酶、限制性内切酶 KpnⅠ,EcoRⅠ购自大连宝生物公司,IPTG,DAB显色试剂盒,尿素购自上海生工生物工程技术服务有限公司,HRP标记的羊抗鼠IgG为北京博奥森生物技术公司产品,DNA胶回收纯化试剂盒购自北京百泰克生物技术有限公司,酶标板购自华美生物工程公司.硝酸纤维素膜(NC膜)购自大连宝生物工程有限公司.
1.3 引物设计
通过分析swFcγRIIB1基因序列,应用Premier软件,分别设计3对引物并在引物两端加入KpnⅠ和EcoRⅠ酶切位点.上述引物由上海博瑞生物公司合成.
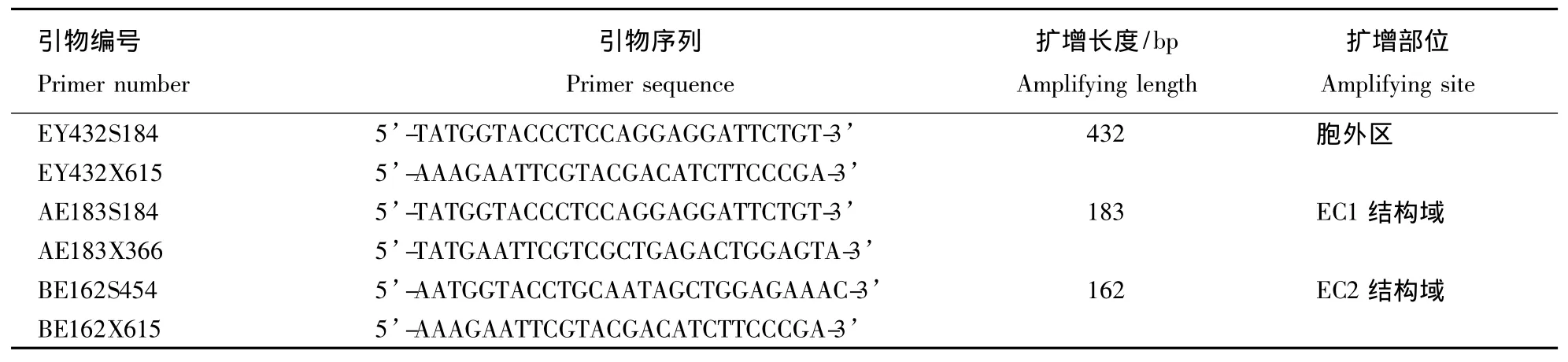
表1 扩增swFcγRⅡB1胞外区及结构域引物序列Table 1 The sequences of swFcγRⅡB1 and primers used in amplifying extracellular domain and structural domains
1.4 重组原核表达载体的构建
以pTG19-T-swFcγRIIB1为模板,设计3对引物扩增目的片段.反应条件为:95℃预变性5 min,PCR循环为95℃ 45 s,退火温度55.8℃ 45 s,72℃ 45 s,30个循环后,72℃延伸10 min.PCR产物经切胶回收,用KpnⅠ和EcoRⅠ双酶切后连接至pET-32a载体中,按常规方法[9]转化大肠杆菌DH5α,并涂布于琼脂平板培养,挑取阳性菌落,进行PCR鉴定,酶切鉴定及序列测定,筛选阳性重组表达质粒 pET-EY,pET-AY,pET-BY.
1.6 融合蛋白在大肠杆菌中的表达
将重组质粒pET-EY,pET-AY,pET-BY转化大肠杆菌BL21感受态细胞,在转化平皿中挑取单个菌落,37℃振荡培养16 h,将培养物以1∶100的稀释度接种于含终质量浓度为100 mg·L-1氨苄青霉素新鲜LB液体培养基中,于37℃振荡培养至OD600达到为0.5~1.0时,分别加入不同终浓度的IPTG(0.2,0.4,0.6,0.8,1.0 nmol·L-1)和进行不同时间(2,3,4,5,6,7 h)的诱导表达,同时设立重组质粒和空载体未诱导,空载体诱导和BL21对照.然后收取表达产物通过12%的SDS-PAGE电泳检测融合蛋白的表达量,以确定 swFcγRIIB1-EY,swFcγRIIB1-AY,swFcγRIIB1-BY 融合蛋白的最佳诱导表达条件.
1.7 涵体的制备、洗涤与纯化
按最佳诱导表达条件诱导表达基因工程重组菌500 mL,离心收集菌体,按每克湿菌沉淀加入约3 mL 50 mmol·L-1PBS(pH 值为 8.0)悬浮菌体,反复冻融10次,加入终质量浓度为100 mg·L-1溶菌酶,混匀后冰浴10 min,然后4℃作用30 min.随后在冰浴中进行超声波处理,每次超声处理4 s,间隔10 s,共作用80~100次,加入终质量浓度为10 mg·L-1DNase,作用至菌液不再粘稠.按参考文献[10]提供方法进行包涵体的洗涤与纯化.
1.8 包涵体的复性
将溶解的上清装入已处理的透析袋内,置于复性缓冲液中在4℃下进行梯度透析,复性缓冲液中尿素浓度依次递减 4,3,2,1,0.5,0 mol·L-1,换液间隔时间为10~12 h.之后将其置于双蒸水中4℃搅拌过夜.
1.9 抗融合蛋白多克隆抗体的制备
选取6周龄雄性小白鼠60只,随机分为3组,每组20只(试验组10只和对照组10只).试验组分别以3种纯化的融合蛋白为抗原,按体积比1∶1混合弗氏完全佐剂皮下注射进行初次免疫,抗原量为120 μg·只-1.初免后免疫佐剂改为弗氏不完全佐剂,每2周免疫1次,共免疫2次,对照组免疫佐剂不加融合蛋白,免疫程序同试验组.
1.10 ELISA检测小鼠血清抗体效价
采用方阵滴定法确定3种融合蛋白抗原的包被浓度以及阴、阳性血清的最佳工作浓度,通过优化包被时间、封闭液及其作用时间,酶标二抗稀释度及作用时间,根据结果确定最佳反应条件[11],ELISA检测小鼠血清抗体.
1.11 融合蛋白的免疫活性检测
按常规方法进行Western blot分析[12],应用所制的鼠源抗3种融合蛋白的抗体和HRP标记的羊抗鼠IgG检测融合蛋白的免疫学活性.同时设空白载体诱导产物,BL21对照.
2 结果与分析
2.1 目的片段扩增
分别利用3对引物通过 PCR方法从载体pTG19-T-swFcγRIIB1分别扩增胞外区,EC1结构域和EC2结构域,扩增的片段大小分别为432,183,162 bp,结果分别见图1~图3.

2.2 重组表达质粒的鉴定
分别将编码swFcγRⅡB1胞外区及EC1结构域、EC2结构域的DNA亚克隆到pET32a表达载体的T7启动子下游,提取重组表达质粒pET-EY,pET-AY,pET-BY用PCR鉴定,扩出了预期条带.用KpnⅠ,EcoRⅠ酶切鉴定,分别得到了与预期结果相附的2个片段(图4~图6).测序分析表明,成功构建了pET-EY,pET-AY,pET-BY 3种质粒.

2.3 融合蛋白的表达及纯化
swFcγRIIB1-EY,swFcγRIIB1-BY,swFcγRIIB1-AY融合蛋白分别含有144,61,54个氨基酸,分子量约为36,29,27 kD.表达产物均以包涵体形式存在,经12%SDS-PAGE,与预计大小一致.诱导6 h表达量最高,swFcγRIIB1-EY,swFcγRIIB1-BY 融合蛋白以终浓度为1.0 mmol·L-1的IPTG诱导表达效果最佳,swFcγRIIB1-AY 融合蛋白为 0.8 mmol·L-1.融合蛋白经提取与纯化后所占菌体蛋白百分比可提升到85%.结果见图7~图9.

图7 重组质粒pET-EY在大肠杆菌中的表达Fig.7 Expression of the recombinant plasmid pET-EY

图8 重组质粒pET-AY在大肠杆菌中的表达Fig.8 Expression of the recombinant plasmid pET-AY
2.4 抗融合蛋白鼠源抗体效价
ELISA方法检测获得的3种鼠源血清,结果显示其血清中含有较高活性的特异性抗体.3种融合蛋白免疫抗体效价分别达到1∶5 120,1∶5 120,1∶10 240.
2.5 Western blotting 分析
经Western blot分析,3种融合蛋白分别在36,29,27 kD处出现特异性条带,而pET-32a空载体及BL21对照未出现特异性条带,证实表达的融合蛋白与制备的鼠源抗体具有较好的反应原性(图10~图12).

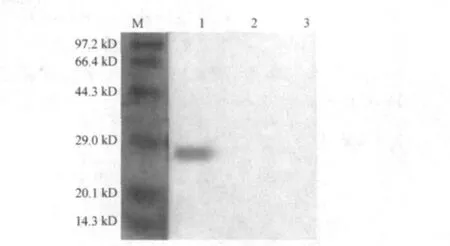
图12 swFcγRIIB1-BY融合蛋白Western blot分析Fig.12 Western blot analysis of the recombinant protein swFcγRIIB1-BY
3 小结与讨论
目前已知的抑制性受体有30多种,按结构特征可分为2类:一类属 C型凝集素超家族(CL SF),属Ⅱ型跨膜蛋白,主要包括Ly49家族,NKG2家族和 DCIR等.另一类为免疫球蛋白超家族(IgSF),大多属于Ⅰ型跨膜蛋白,主要包括FcγRIIB,Ig样转录物(ILT)、信号调节蛋白(SIRP)等[13].FcγRIIB 属于 I型跨膜蛋白,胞内区含有一个ITIM酪氨酸抑制基序,FcγRIIB和其他含有ITAM的活化性受体交联时,胞内区的ITIM发生酪氨酸磷酸化后可以结合SHP-1,SHP-2,SHIP等具有2个串联SH2结构域的蛋白酪氨酸磷酸酶,并通过后者传递抑制信号,在免疫细胞的自我负反馈调节方面发挥重要作用,这种抑制作用减弱会导致免疫功能亢进,产生自身免疫病.FcγRIIB属于低亲和力受体,仅能与抗原抗体复合物或多聚IgG结合,相关研究表明猪的FcγRIIB能够介导PRRSV的ADE作用[13].目前,诸多研究致力于通过主动干预FcγRIIB的异常表达,寻找治疗自身免疫性疾病或肿瘤新的切入点.
在猪的FcγRIIIA中发现存在胞外区只有1个Ig结构域的选择性剪切异构体,且这种剪切异构体不具备结合免疫复合物的功能,然而,这种剪切异构体可以和包含另一结构域的其他选择性剪切异构体互相作用,促进Fc受体与免疫复合物的结合,并提高 FcγRIII受体产生的信号强度[15].猪FcγRIIB虽尚未克隆出包含单个Ig结构域的选择性剪切异构体,但并不排除有这样的可能性,将swFcγRIIB1 2个Ig结构域进行分段表达并制备抗体,为进一步研究2个Ig结构域在swFcγRIIB1结合免疫复合物的功能中发挥怎样的作用,封闭一个Ig结构域后与swFcγRIIB相互作用,是否促进了FcγRII受体免疫复合物的摄取等方面打下基础.
[1] COHEN-SOLAL J F,CASSARD L,FRIDMAN W H,et al.Fc γ receptors[J].Immunology Letters,2004,92(3):199-205.
[2] SINCLAIR N R S,PANOSDALTSIS A.Immunoregulation by Fc signals[J].Immunol Today,1987,8:76 -79.
[3] 姚 忻,闻玉梅.抑制性 IgG受体(FcγRIIB)的免疫调节作用及意义[J].生命科学,2009,21(1):49-52.
[4] ZHANG G P,QIAO S L,LI Q M,et al.Molecular cloning and expression of the porcine high-affinity immunoglobulin G Fc receptor(FcγRI)[J].Immunogenetics,2006,58(10):845-849.
[5] QIAO S L,ZHANG G P,XIA C H,et al.Cloning and characterization ofporcine Fc gamma receptorⅡ(FcγRII)[J].Veterinary immunology and immunopathology,2006,114:178 -184.
[6] HALLORAN P J,SWEENEY S E,STROHMEIER C M,et al.Molecular cloning and identification of the porcine cytolytic trigger molecule G7 as a Fc gamma RⅢalpha(CD16)homologue[J].Immunol,1994,153 2631-2641.
[7] 刘玉松,夏平安,赵 琳,等.重组猪IgGIIB类Fc受体蛋白的原核表达和抗体的制备[J].中国兽医科学,2010,40(1):70-74.
[8] 刘玉松,夏平安,刘肖萍,等.猪IgGⅡB类Fc受体基因剪接异构体的克隆及序列分析[J].河南农业大学学报,2010,44(5):542 -549.
[9] 梁国栋.最新分子生物学实脸技术[M].北京:科学出版社,2001.
[10]王中明,李素平,夏平安,等.猪繁殖与呼吸综合征病毒Hn-1/06株GP3蛋白的原核表达与纯化[J].华北农学报,2009,24(1):103 -107.
[11]夏平安,尹彦涛.猪繁殖与呼吸综合症病毒重组N蛋白的高效表达及间接ELISA方法的建立[J].中国兽医学报,2009,29(5):537 -541.
[12]萨姆布鲁克 J,拉塞尔 D W.分子克隆实验指南[M].黄培堂,译.北京:科学出版社,2002.
[13]李 龙,马海霞,沈 红,等.巨噬细胞抑制性受体及其免疫调节作用[J].现代免疫学,2007,27(6):512-515.
[14] TIAN X H,WANG A P,QIAO S L,et al.Expression,purication and characterization of a functional extracellular domain of porcine FcγRII[J].Protein Expression and Purication,2009,68:12 -17.
[15] HYUN B J,DAESONG Y,YOON B K.Porcine FcγRIIIA isoforms are generated by alternative splicing[J].Molecular Immunology,2009,46:1189 -1194.

