河南地区猪戊型肝炎病毒的检测及基因序列分析
张小霞,许 锋,梁振普,乔冠华
(河南农业大学生命科学学院,河南郑州450002)
戊型肝炎(Hepatitis E,HE)是一种由戊型肝炎病毒(HEV)引起的急性传染病,主要经粪-口传播.该疾病在公共卫生体系不发达的地区较为流行,一般由水源污染引起大规模暴发.戊型肝炎在热带和亚热带地区爆发严重,而发达国家主要以散发性病例为主[1~5].HEV为无囊膜的正链 RNA 病毒,基因组全长约7.2 kb,包括5’端和3’端的非编码区以及3个开放阅读框架(ORFs).ORF1长约5.1 kb,编码一些非结构蛋白,如甲基转移酶、依赖RNA的RNA聚合酶等;ORF2长约1.98 kb,编码主要的结构蛋白;ORF3较小,与ORF2有部分重叠[6],编码1个磷酸化蛋白,与细胞骨架相互作用[7],并可能参与病毒从细胞中的释放[8].在ORF1和ORF2内各有1段序列差异较大的区域,该区域是目前国际上通用的HEV基因分型依据.HEV主要分为4个基因型,这些基因型有区域性分布特征.Ⅰ型分布较广,主要分布在亚洲和非洲地区;Ⅱ型主要分布在墨西哥;Ⅲ型分布最广,在亚洲、欧洲、美洲以及大洋洲都有分布;Ⅳ型主要分布在亚洲.中国的HEV基因型主要是Ⅰ型和Ⅳ型[9~11],但是陆一涵等[12]在上海地区也检测到了Ⅲ型HEV病毒.HEV危害较大,对孕妇有较高的致死率.传播途径较多,给防治工作带来了一定难度.越来越多的研究证实动物正成为HEV的主要传播媒介[13].HEV在猪群中广泛存在,对生猪生产是一个不可忽视的隐患.本研究将通过对河南省部分地区猪群中的HEV进行检测,并进行基因序列分析,为HEV的防控提供必要的理论依据.
1 材料与方法
1.1 试验样品采集
133份猪血清采自河南省郑州、洛阳、新乡、焦作、周口等5个地市,存于-80℃待检.200份粪便样品分别从郑州、中牟、新郑、济源、濮阳采集.其中,郑州粪便样品50份,中牟样品50份,新郑样品30份,济源样品共40份,濮阳样品30份.在各地市分别从猪栏里采集独立的新鲜粪便样品,低温保存,存于-80℃待检.
1.2 主要试剂
提取RNA用的RNAiso Plus,RNA酶抑制剂,Taq酶,dNTP购自大连宝生物公司.反转录酶M-MLV购自Promega公司,DEPC(焦碳酸二乙酯)购自美国AMRESCO公司,胶回收试剂盒购自上海捷瑞公司.
1.3 菌种和克隆载体
菌种为大肠杆菌DH5a,克隆载体pMD-18T载体购自大连宝生物公司.
1.4 血清抗体检测
血清抗体检测试剂盒购自北京万泰公司.血清抗体检测严格按照试剂盒说明书进行.
1.5 引物
HEV阳性样品筛选所用的反转录和巢式PCR的引物及条件参照文献[14]的方法;河南病毒株基因组3’末端序列克隆引物由河南农业大学生命科学学院分子生物学实验室参考序列比对设计,并由上海博尚公司合成.试验所用引物序列见表1.
1.6 样品处理和RNA提取
1.6.1 粪便样品的处理 将1 g粪便样品溶于DEPC 水配置的10 mL PBS(0.01 mol·L-1,pH 值为7.2~7.4)中.使用涡旋震荡仪进行混匀,4℃,8 000 r·min-1离心 8 min.取上清液 200 μL 进行RNA提取.

表1 引物序列Table 1 Sequence of primers
1.6.2 RNA的提取 按照RNAiso Plus说明书提取RNA.
1.7 RT-PCR
按照反转录酶说明书完成反转录体系.反转录过程为:42℃ 60 min,95℃ 5 min.结束后迅速将管拿出置于冰上冷激2 min以上.反转录好的cDNA直接进行PCR,或存于-80℃.巢式PCR条件及过程参照文献[14],将PCR产物进行琼脂糖凝胶电泳检测.
河南HEV病毒株3’端部分序列扩增条件如下:以oligo(dT)为反转录引物进行反转,反转步骤同上.然后用正向引物E和反向引物oligo(dT)进行PCR扩增.PCR体系为25 μL.扩增条件如下:94℃预变性3 min,94℃变性1 min,44℃退火1 min,72℃延伸1 min,30个循环,最后72℃延伸10 min.将PCR产物进行琼脂糖凝胶电泳检测.
1.8 目的基因的测序
根据阳性样品的地域分布特点,将3个阳性样品的巢式PCR产物(JY6,JY40和ZZ9)送至上海生工直接进行测序.将JY40基因组3’末端约800 bp PCR产物胶回收纯化后,连接到pMD-18T载体上转化到DH5α,蓝白斑筛选检测后送到北京博尚生物公司进行测序.
1.9 系统发育
将巢式PCR测序结果以及JY40基因组3’端804 bp序列测序结果通过软件Clustal x和MEGA 4.0进行比对,使用 Kimura-2-parameter法进行系统发育分析.巢式PCR产物参照GeneBank中的30条序列(表2)进行系统进化分析.
2 结果与分析
2.1 血清学检测结果
用酶联免疫试剂盒对分离到的血清进行抗体检测,发现不同地区抗体的阳性率不同,且没有明显的分布规律;部分地区的抗体阳性率高达100%,抗体阳性率最低也在61%以上(表3).这种结果可能和各地区采集的样品总数有关.经过检测,血清样品中HEV抗体总阳性率达到79.70%.

表2 系统发育分析比较的序列Table 2 HEV strains used in the phylogenetic and sequence analyses

表3 血清样品检测结果Table 3 Results of serum detected
2.2 粪便样品阳性率检测结果
对200份样品进行RT-PCR,结果显示,在郑州采集的50份样品中只有1个为阳性;在新郑和中牟采集的80份样品均为阴性;在济源采集的40份样品中8份样品呈阳性;在检测的30份濮阳样品中6份样品呈阳性.HEV RNA总体阳性率达到7.5%.检测到的阳性样品均能在1%的琼脂糖凝胶上观察到436bp的条带,将PCR产物送往上海生工测序验证.部分样品的琼脂糖凝胶电泳结果见图1.
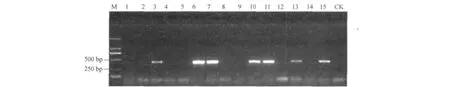
图1 部分阳性粪便样品检测结果Fig.1 Result of some positive fecal sample tested
2.3 序列对比与分析
2.3.1 巢式PCR结果序列的对比与分析 将3个河南分离株的测序结果进行序列同源对比(图2),结果显示JY6与JY40同源性高达98%,与ZZ9同源性为84%;JY40与ZZ9同源性为83%.为进一步研究3个河南分离株的基因型,将其与NCBI中收录的部分Ⅰ,Ⅱ,Ⅲ,Ⅳ型HEV的相应核苷酸进行对比(图略).比对发现,3个河南分离株与HEVⅠ,Ⅱ,Ⅲ,Ⅳ型同源性分别为77% ~79%,74% ~76%,76% ~81%,79% ~86%.结果显示,相对于Ⅰ,Ⅱ,Ⅲ型HEV而言,3个河南分离株与Ⅳ型HEV的同源性较高.
2.3.2 JY40 3’末端 826bp 序列的对比与分析为进一步研究河南HEV病毒株的特点,克隆了JY40分离株3’端长约800 bp的序列.将测序后的病毒分离株 JY40 3’端序列去掉 polyA,命名为“HN-JY”.将其同国内6个基因Ⅳ型代表株进行同源对比.结果显示,HN-JY与湖北分离株(WH09)同源性最高,达到95.3%;而与长春分离株(Ch-S-1)同源性最低,为84.1%.

图2 3个河南分离株的核苷酸同源性分析Fig.2 Nucleotide sequence identity of the three Henan HEV strains
2.4 系统发育分析
使用表2中的相应序列,对得到的HEV河南株进行了系统发育分析(图4).分析结果显示,分离到的3个河南分离株都属于Ⅳ型HEV.2个济源株(JY6,JY40)属于同一个亚型,郑州株(ZZ9)属于另一个亚型.

图4 基于ORF2中核苷酸序列的系统发育分析Fig.4 Phylogenetic tree constructed by based nucleotide sequence of ORF2
3 小结与讨论
1)中国猪群携带的HEV的基因型主要是Ⅰ型和Ⅳ型.陆一涵等[12]在上海地区检测到了国内首例Ⅲ型HEV病毒,说明在同一地区会有不同型别HEV病毒并存的可能.本研究对河南省部分地市猪群中的HEV抗体及病毒进行了检测,发现HEV抗体的总阳性率达到79.70%,个别地方甚至达到100%,说明猪戊型肝炎病毒可能在河南省猪群中广泛存在.经过测序,筛选的3个河南分离株都为Ⅳ型.
2)HEV在感染动物的初期即可进行传播,使得传统的疫苗并不能产生十分有效的作用.LORENZO等[15]发现HEV在体内经过传代会产生突变,可能会通过这种途径规避体内免疫机制对病毒的破坏.这也可能降低HEV疫苗的作用.因此,应建立完善的监管体制,尽量避免戊型肝炎从猪群传播到人,保障人民群众的切身利益.
[1] GREGORY R R,MICHAELA A P,JUNGSUHP K,et al.Isolation of a cDNA from the virus responsible for enterically transmitted non-A,non-B hepatitis [J].Science,1990,16:1335 -1339.
[2] MENG X J,PURCELL R H,HALBUR P G,et al.A novel virus in swine is closely related to the human he patitis E virus[J].Proceedings of the National Acade-my of Sciences of the United States of America,1997,94:9860-9865.
[3] SUN Z F,LARSEN C T,DUNLOP A,et al.Genetic identification of avian hepatitis E virus(HEV)from healthy chicken flocks and characterization of the capsid gene of 14 avian HEV isolates from chickens with hepatitis-splenomegaly syndrome in different geographical regions of the United States[J].Journal of General Virology,2004,85:693 -700.
[4] WANG Y C,LING R G,ERKER J C,et al.A divergent genotype of hepatitis E virus in Chinese patients with acute hepatitis[J].Journal of General Virology,1999,80:169 -177.
[5] JOHNE R,PLENGE B A,HESS M,et al.Detection of a novel hepatitis E-like virus in faeces of wild rats using a nested broad-spectrum RT-PCR[J].Journal of General Virology,2010,91:750 – 758.
[6] HIROAKIE O.Genetic variability and evolution of hepatitis E virus[J].Virus Research,2007,127:216-228.
[7] KANNAN H,SUNMINFAN E,PATEL D,et al.The hepatitis E virus open reading frame 3 product interacts with microtubules and interferes with their dynamics[J].Journal of Virlogy,2009,83:6375-6382.
[8] YAMADA K,TAKAHASHI M ,HOSHINO Y,et al.ORF3 protein of hepatitis E virus is essential for virion release from infected cells[J].Journal of General Viro logy,2009,90:1880 -1891.
[9] 马 勋,陆承平.新疆猪粪便戊型肝炎病毒 RNA的检测及序列分析[J].中国病毒学,2004,19(4):360-363.
[10]宁海强,李 震,于瑞嵩,等.上海地区猪戊型肝炎病毒部分序列的克隆与分析[J].西南农业学报,2007,20(5):1105-1108.
[11]孙中锋,金宁一,朱光泽,等.长春地区人与猪戊型肝炎病毒分子流行病学及部分基因序列分析[J].2006,22(10):941-945.
[12]陆一涵,郑英杰,朱建福,等.中国发现基因3型戊型肝炎病毒[J].疾病控制杂志,2007,11(1):5-10.
[13] MENG X J.Hepatitis E virus:Animal reservoirs and zoonotic risk [J].Veterinary Microbiology,2010,140:256-265.
[14] LI W G,SHE R P,WEI H T,et al.Prevalence of hepatitis E virus in swine under different breeding environment and abattoir in Beijing,China[J].Veterinary Microbiology,2009,133:75 -83.
[15] LORENZO F R,TANAKA T,TAKAHASHI H,et al.Mutational events during the primary propagation and consecutive passages of hepatitis E virus strain JE03 to 1760F in cell culture[J].Virus Research,2008,137:86-96.

