航天诱变菌株黑曲霉ZM-8降解小麦秸秆产纤维素酶条件的优化
天水师范学院生命科学与化学院 马旭光 张宗舟
利用微生物酶解法预处理纤维素资源与传统的物理处理法、化学处理法相比,具有节约能源、反应条件温和、副产物少或无副产物、无环境污染等优点。微生物产生的纤维素酶对纤维素的降解是一个复杂的生物化学过程,受原料成分、培养温度、培养pH值、培养时间等众多因素的影响(蒋芳等,2006;徐昶等,2005;王景林等,2000)。因此,在具有性价比较高的纤维素酶产生菌株的基础上,优化其分泌纤维素酶的各种条件就显得至关重要。
本试验在前期已确定影响黑曲霉ZM-8在小麦秸秆为主要原料产纤维素酶的单因素研究基础上(马旭光等,2008),应用正交试验对各单因素进行优化,以期为提高农作物秸秆的利用效率、拓宽其饲用范围提供可靠的工艺参数。
1 试验材料
1.1 菌种 航天诱变黑曲霉 (Aspergillus niger)突变株ZM-8(马旭光等,2007),保存于PDA斜面培养基。
1.2 发酵主要原料 小麦秸秆粉 (过40目筛),麸皮(市售)。
1.3 试剂及仪器
1.3.1 主要试剂 DNS试剂,柠檬酸缓冲液,水杨素(Sigma),羧甲基纤维素钠,新华定性滤纸,其他均为国产的化学纯或分析纯。
1.3.2 主要仪器 恒温培养箱;高速冷冻离心机;722型分光光度计;恒温水浴锅等。
1.4 培养基
1.4.1 种子培养基 小麦秸秆粉10 g,营养液[(2% (NH4)2SO4,0.08%MgSO4·7HO2,0.04%KH2PO4)]25 mL。
1.4.2 固体产酶培养基 小麦秸秆粉6g,麸皮4g,营养液[(2.0%(NH4)2SO4,0.08%MgSO4·7HO2,0.04%KH2PO4)]25mL。
上述培养基均需在 1.0×105Pa,121℃灭菌30 min,pH 值自然。
2 试验方法
2.1 产酶培养基组分的优化 在前期单因素研究中发现,发酵培养中的麸皮添加量、氮源、含氮量以及水料比等都会不同程度地影响酶活力 (马旭光等,2008)。 本试验采用 L16(44)正交试验设计的方法对产酶培养基组分优化,试验因素水平见表1。
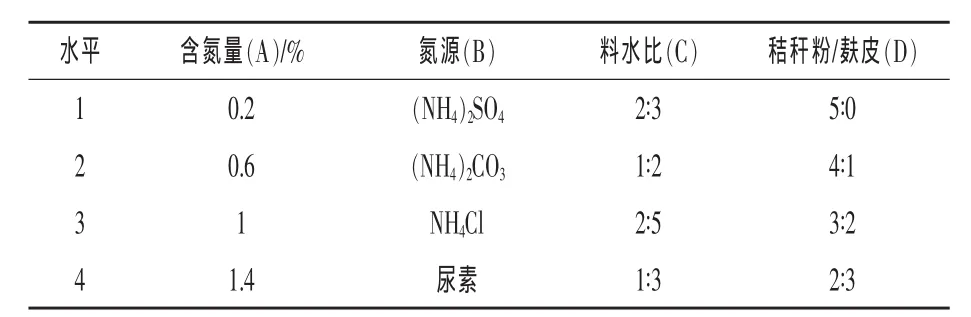
表1 产酶培养基正交试验因素水平
2.2 产酶培养条件的优化 前期的单因素研究表明,培养时间、温度、初始pH值和接种量都会对酶活有不同的影响(马旭光等,2008)。本试验均采用L16(44)正交试验设计方法进行发酵环境条件的优化,试验因素水平表见表2。
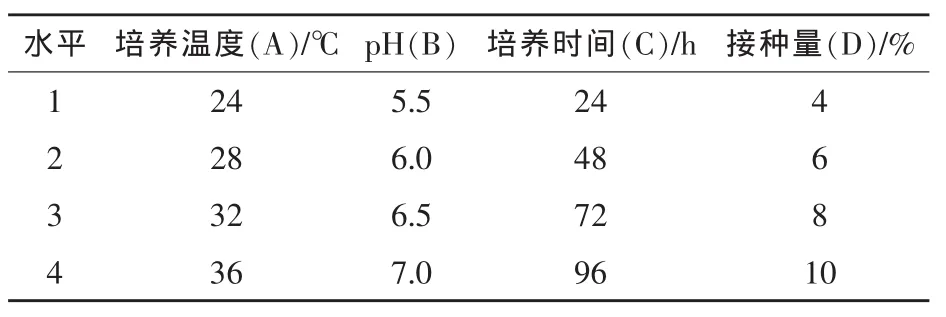
表2 产酶培养条件正交试验因素水平
2.3 复证 在已确定的最佳培养基组分和培养条件下测定酶活,并与在未优化培养基上的酶活力进行比较,以验证优化效果。
3 测定方法
3.1 发酵方法 将黑曲霉ZM-8的斜面孢子用无菌生理盐水洗脱,制成孢子悬浮液 (106~107个/mL),按10%(V/m)的接种量接入种子培养基中,28℃恒温培养72 h,待菌丝生长旺盛、孢子丛生时即可放入冰箱保存,供种曲备用。然后将制备的种曲按一定比例接入固体产酶培养基进行培养,28℃恒温培养72 h后取样测定酶活。
3.2 粗酶液的制备 取生长良好的固体发酵曲5 g,加水 50 mL,于 30℃保温 1 h,用沙芯漏斗过滤,然后在转速10000 r/min冷冻离心机上离心10 min,提取上清液定容至 100 mL,得 1∶20粗酶液。
3.3 酶活力的测定
3.3.1 FPU酶(滤纸酶)活力的测定 取适当稀释的酶液0.5 mL,加入50 mg滤纸条 (约1 cm×6 cm)和1.5 mL 0.05 mol/L的缓冲液,并向对照试管中加入1.5 mLDNS溶液以钝化酶活性,然后在50℃保温1 h,取出后立即向待测试管中加入1.5 mLDNS溶液以中止酶反应,充分摇匀后沸水浴5 min,冷却后在540 nm的波长下测定其光密度值。
3.3.2 CMC酶(内切酶)活力的测定 加入的底物为1.5 mL 0.51%CMC缓冲液,在50℃水浴中保温0.5 h,其余操作同3.3.1。
3.3.3 纤维素酶活力单位定义 在50℃,pH 4.8,恒温30 min条件下以水解反应中每小时由底物生成1 μmol葡萄糖所需的酶量为一个酶活力单位(U)(邬敏辰等,1997)。 计算公式为:

式中:5.56为1 mg葡萄糖的μmol数(1000/180=5.56)。
样品重为发酵后的固体干曲重量。
3.3.4 数据分析及处理方法 参考李春喜等(2000)对正交试验所得数据利用DPS软件进行极差分析。
4 结果与分析
4.1 产酶培养基组分的优化结果 结果见表3。
由表3可知,各因素对FPU酶活力的影响大小顺序为 A(含氮量)、B(氮源)、D(麸皮加入量)、C(加水量)。其最佳的产酶培养基组成为A3B2D2C2,即含氮量1.0%、氮源为碳酸铵、小麦秸秆与麸皮之比4∶1、料水比为1∶2。 对CMC酶活力的影响大小顺序为 B(氮源)、C(加水量)、A(含氮量)、D(麸皮加入量)。其最佳的产酶培养基成分为:B2C2A4D2,即:氮源为碳酸铵,料水比为 1∶2,含氮量为1.4%,小麦秸秆粉与麸皮之比4∶1。
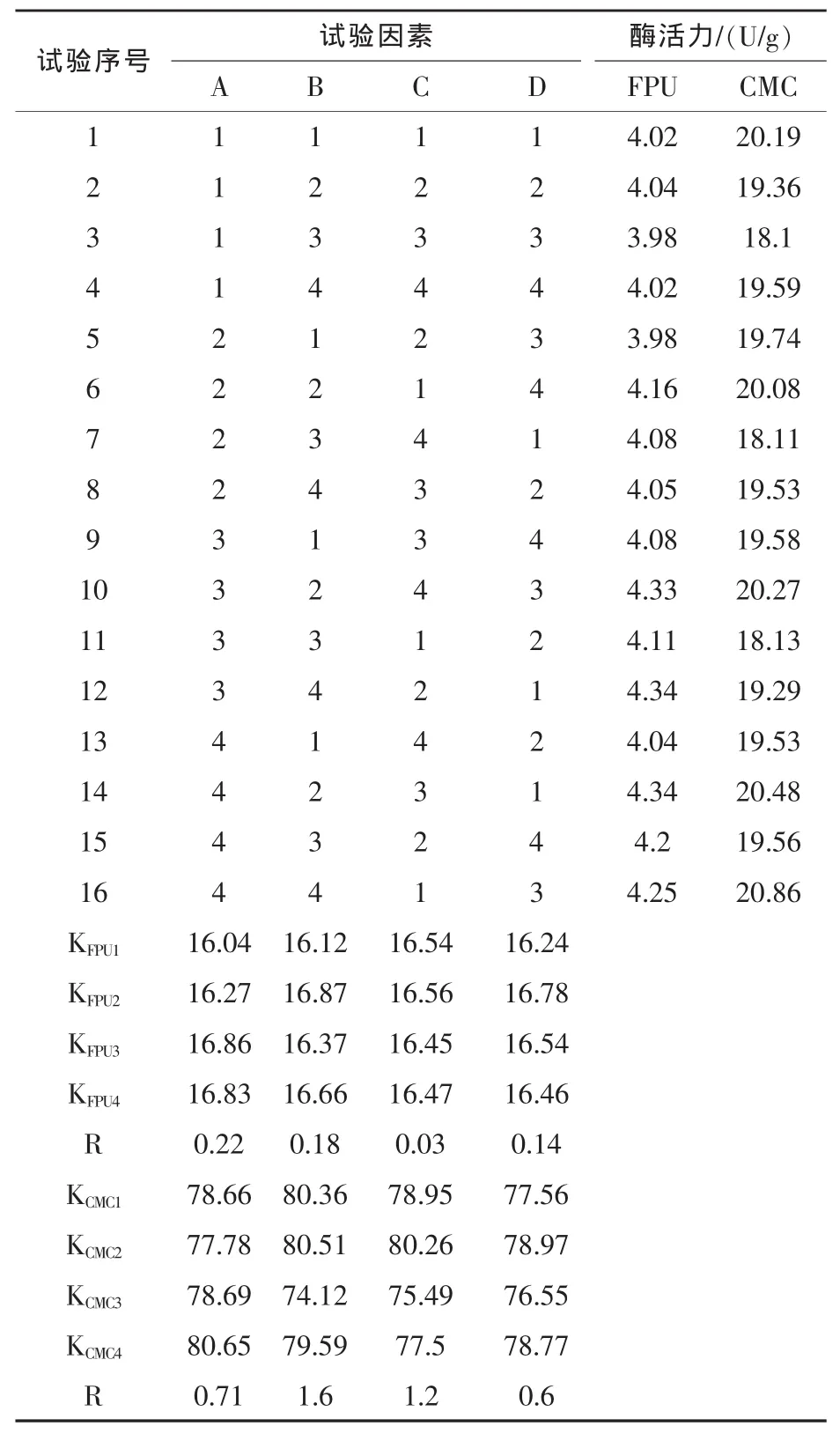
表3 产酶培养基组分的正交试验极差分析
FPU是表征纤维素酶系中各组分酶之间的协同作用(徐昶等,2005),而CMC酶活代表外切β-1,4葡聚糖酶活力和内切酶活力的总和 (孔健,2005),再根据各因素对纤维素酶的影响大小,最终将产酶培养基确定为:氮源为碳酸铵、料水比为1∶2、含氮量 1.4%、秸秆粉与麸皮之比为 4∶1。
4.2 产酶培养条件的优化结果 结果见表4。
由表4可知,其FPU酶较佳产酶条件为A3B3D1C4,即:培养温度为 32 ℃,pH 值为 6.5,接种量为4%,培养时间为96 h。CMC酶的较佳产酶条件为A2C3B3D1,即:培养温度为28℃,pH值为6.5,接种量为4%。培养时间为72 h,培养温度和培养时间是影响CMC产酶的主要因素;培养温度对FPU的影响大于pH值和培养时间,其极差小于CMC酶;培养时间对FPU的影响较大,其极差远大于CMC酶;pH值和接种量对两种酶活的影响都不明显。综合上述分析,可将黑曲霉产酶的最佳条件确定为:C4A2B3D1。
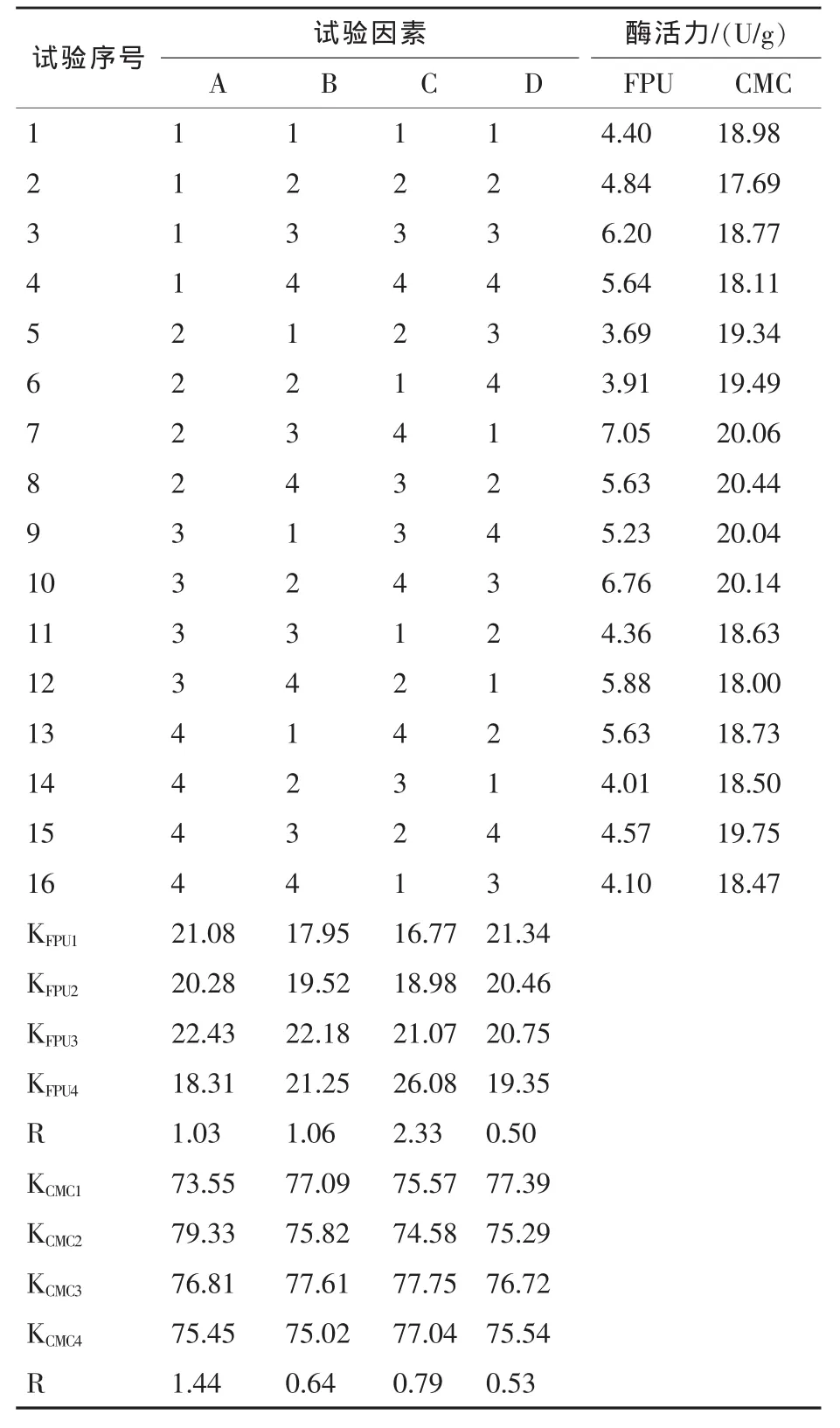
表4 产酶培养条件的正交试验极差分析
4.3 复证 在已确定的最佳培养基组分和培养条件下测定酶活,即培养基配方:氮源为碳酸铵,含氮量1.4%、料水比为1∶2、小麦秸秆粉与麸皮之比为4∶1;培养条件:培养温度为28℃、培养时间为96 h、初始pH值为6.5、接种量为4%。测定结果表明:FPU和CMC的酶活分别为6.57 U/g和22.38 U/g。
5 小结
5.1 含氮量和加水量是影响产酶的最主要因素,其产酶培养基组分的最优组合为:最佳氮源为碳酸铵,含氮量1.4%,料水比为1∶2,小麦秸秆粉与麸皮之比为 4∶1。
5.2 培养时间和培养温度是影响产酶的最主要环境因子,其产酶的最佳培养条件为:培养温度为28℃,培养时间为 96 h,pH值为6.5,接种量4%。
5.3 在优化的培养基配方和培养条件下,其FPU和CMC的酶活分别为6.57 U/g和22.38 U/g。
[1]蒋芳,增林子,张强,等.饲用细菌纤维素酶的发酵条件优化与性质研究[J].中国饲料,2006,6:6 ~ 9.
[2]孔健.农业微生物技术[M].北京:化学化工出版社,2005.112~137.
[3]李春喜,王志和,王文林.生物统计学,2版[M].北京:科学出版社,2000.149~153.
[4]马旭光,张宗舟,蔺海明,等.黑曲霉高产纤维素酶活突变株ZM-8的筛选[J].中国饲料,2007,5:30 ~ 32.
[5]马旭光,张宗舟,刘星斌.航天诱变黑曲霉菌株ZM-8产纤维素酶的固态发酵条件研究[J].中国酿造,2008,23:37 ~ 40.
[6]王景林,刘晓明,吴东林,等.纤维素酶产生菌黑曲霉X-15的选育及其产酶条件[J].中国兽医学报,2000,1:97 ~ 99.
[7]邬敏辰,李江华,邬显章.黑曲霉固态培养生产纤维素酶的研究[J].酿酒,1997,6:5 ~ 9.
[8]徐昶,龙敏南,邬小兵,等.高产纤维素酶菌株的筛选及产酶条件的研究[J].厦门大学学报(自然科学版),2005,44(1):107 ~ 111.

