太行菊细胞悬浮培养体系的建立
桑叶子,孙 明,2,张启翔,2
(1.北京林业大学园林学院,北京100083;2.国家花卉工程技术研究中心,北京100083)
植物细胞悬浮培养体系的建立是分离次生代谢产物、进行原生质体融合与遗传转化的重要基础工作,同时亦可用于植物抗性生理的研究及各种生理生化指标的测定,还可作为诱变的对象,减少嵌合体的产生[1,2].迄今,木本植物香花槐[3]、毛泡桐[4],药用植物红景天[5]及一些观赏植物高羊茅、石竹、一品红、薰衣草[6~9]等都已成功建立细胞悬浮培养体系,该体系在荔枝和龙眼[10]上实现了作为转基因受体的功能.但菊科植物只有栽培品种小菊建立了细胞悬浮培养体系[11],但野生种鲜有报道.太行菊(Opisthopappus taihangensis)是菊科菊蒿亚族太行菊属多年生宿根草本植物,是中国的特有种,分布在山西(陵川、晋城)、河南(济源).太行菊生于海拔300 m以上的石壁或裸露的石砾坡地上.其植株低矮,耐干旱、瘠薄,抗逆性很强,并且植株具有一种独特的香气,作为地被植物在园林中推广应用具有可观的前景.太行菊属与菊科其他属的二倍体野生种杂交亲和性较好,这使得通过体细胞融合获得属间杂种的可能性大大提高.因此在遗传育种和园林应用上太行菊都具有很高的研究价值[12,13].本研究以太行菊作为试材,探索建立细胞悬浮培养体系的方法,以期为遗传转化、诱变育种奠定基础.
1 材料与方法
1.1 材料
太行菊采自河北太行山区,在北京林大林业科技股份有限公司PC板双坡面连栋加温温室培养保存.
1.2 方法
1.2.1 无菌苗的获得 采健康无病虫害、生长势健壮的植株,修剪成带1~2个腋芽的茎段.流水冲洗30 min后在体积分数为70%乙醇中浸泡30 s,冲洗干净再加入吐温的0.1%氯化汞处理3.5 min,最后用无菌水冲洗4遍.接种到1/2 MS培养基上,诱导腋芽萌发.每3周继代1次.培养条件为25℃,16 h/8 h光周期.
1.2.2 愈伤组织诱导培养基的筛选 将无菌苗的叶片剪去,茎段剪成约3~5 mm(不带腋芽)的小段,横放在培养基上.根据预试验的结果,采用3因素3水平的正交设计培养基,配方如表1所示.
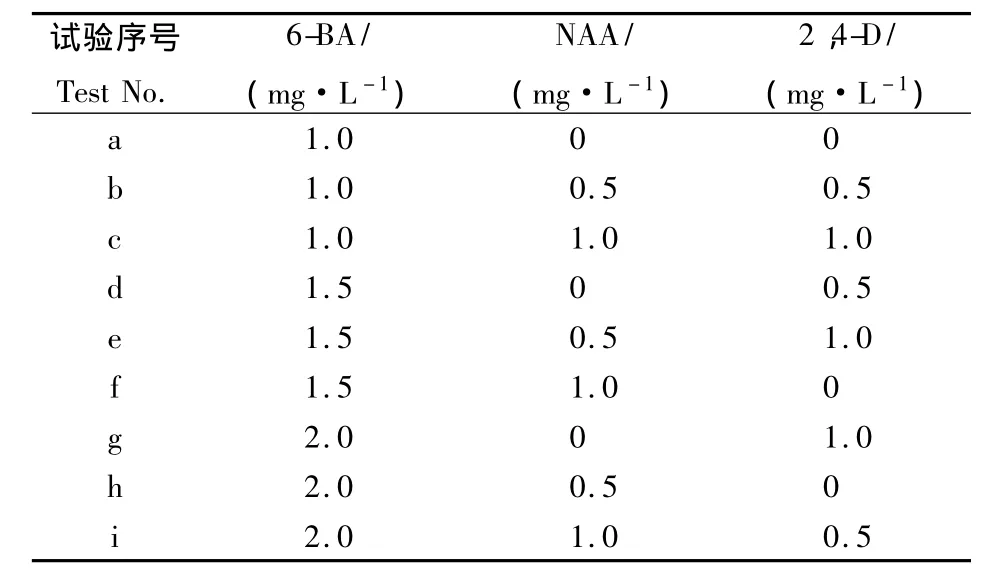
表1 愈伤组织诱导培养基正交试验设计Table1 Orthogonal design of callus induction
每瓶培养基中放入10根茎段,每个处理重复3次.每10 d观察1次,4 d后统计愈伤诱导率、死亡率和愈伤组织生长状态.普通拍照采用CANON IXUS50拍摄,显微观察及照相采用LEICA S8AP0体视显微镜和ZEISSPrimo Star显微镜.
愈伤诱导率=(诱导愈伤的外植体数/接种外植体数)×100%
根据预试验的结果,将不同外观的愈伤组织同解剖结构联系起来,最终将愈伤组织根据软硬程度分为5级[11],做为评价愈伤组织生长状态的指标.1级:疏松呈水渍状膨大,黄色愈伤组织,用解剖针挑破会有汁液渗出;2级:疏松表面有颗粒感,黄绿色愈伤组织,用镊子可以轻易从表面剥离成若干小球状颗粒;3级:软,绿色愈伤组织表面有颗粒感,用镊子解剖针挑开内部无褐化;4级:硬,绿色愈伤组织表面紧实,用手术刀切开,接近培养基部分褐化泛黄;5级:坚硬,绿色愈伤组织表面干硬泛白,用手术刀切开,且内部发黑.
1.2.3 细胞悬浮培养基的筛选 将在1.2.2中筛选的培养基上诱导的愈伤组织放入液体培养基进行悬浮培养.悬浮培养基根据预实验的结果,采用3因素3水平的正交设计培养基,配方如表2所示.
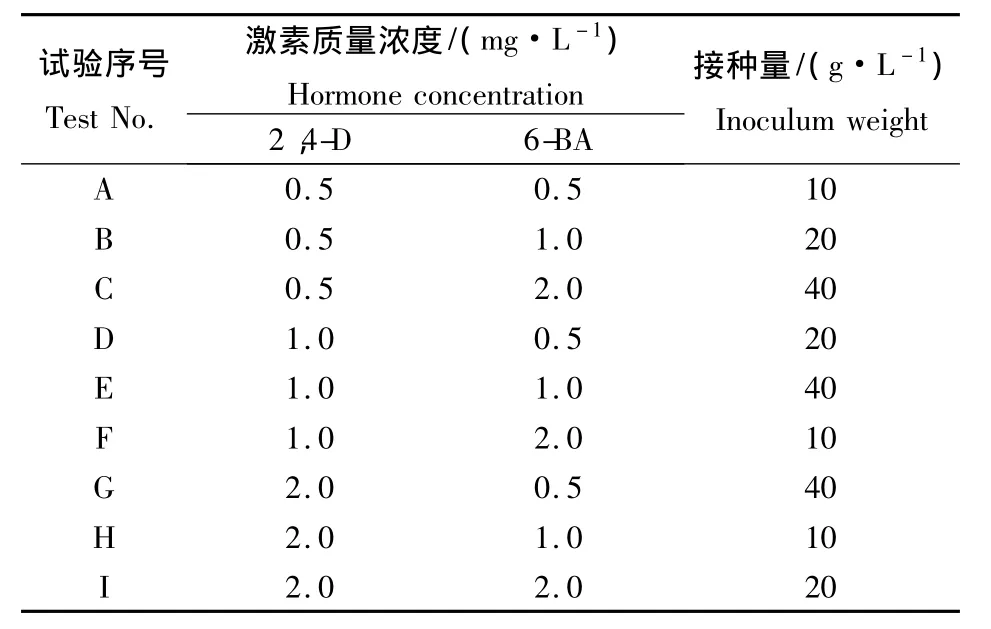
表2 液体培养基正交试验设计Table2 Orthogonal design of liquid medium
将愈伤组织切碎后称重,放入100 mL三角瓶中,每瓶加入50 mL液体培养基.培养条件为:摇床转速100 r·min-1,(25±1)℃,弱光.每2 d对悬浮细胞进行观察计数,悬浮液用60目分样筛(孔径为250μm)尼龙网过滤,取混匀的细胞悬浮液1 mL,在其中抽取40μL进行显微计数,平行测定3次,连续观察10 d.
细胞悬浮液浓度=(40μL悬浮细胞液中细胞个数/40)×1000
测量指标:细胞悬浮液浓度.以每毫升悬浮细胞液中单细胞和小细胞团的密度作为衡量悬浮细胞生长速率的指标.
2 结果与分析
2.1 愈伤组织诱导培养基的筛选
太行菊试管苗比地被菊等其他品种的菊花生长势较弱茎秆纤细,且容易莲座化,这个问题普遍存在,通过改良培养基配方也很难解决.因此诱导愈伤的过程中一部分会自然枯黄、褐化,但是存活的外植体愈伤诱导率很高,添加不同的激素对愈伤组织的生长状态有较大影响.

表3 不同培养对愈伤组织诱导的影响Table3 The effect of different medium to the induction of callus
由表3得知,a培养基单纯添加细胞分裂素,导致外植体较快的褐化死亡;而b,e培养基细胞分裂素与生长素添加质量浓度的比值相当,此时愈伤组织多质地疏松偏黄,部分呈水渍状;而d,h培养基中细胞分裂素比重大于生长素2~3倍,愈伤组织偏绿色质地硬实不宜分散.g,i培养基中细胞分裂素比重大于生长素1倍左右时,愈伤组织生长状况比较适中,排列紧密质地松软.

表4 愈伤组织诱导正交试验的极差分析Table4 Variance analysis of callus induction orthogonal design
从表4可以看出,3个因素处理间差异均显著.第3因素2,4-D质量浓度的极差最大,其次是第1因素6-BA质量浓度,说明太行菊以茎段为外植体的愈伤组织诱导受到生长素2,4-D质量浓度的影响最大,其次是细胞分裂素6-BA的质量浓度.从平均值看,第1因素的第3水平最好,第2因素的第2水平最好,第3因素的第3水平最好.所以各因素最好的搭配是MS+6-BA 2.0 mg·L-1+NAA 0.5 mg·L-1+2,4-D 1.0 mg·L-1.
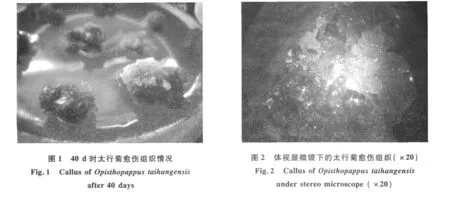
通过对愈伤组织生长状态的连续观察发现,由茎段诱导太行菊愈伤组织,接种4 d后可见两端切口处增大,10 d以后茎段两端开始膨大,产生黄色的愈伤组织,20 d后外植体表面全部覆盖愈伤组织,40 d后产生大量愈伤组织外植体呈球状体如图1所示.体视显微镜下解剖发现(图2),球状体表面覆盖着一层绿色的愈伤组织,并有少量分化的芽点,内部成黄绿色的愈伤组织排列紧密,但质地松软,表面细胞呈球形,类似胚性愈伤组织.
2.2 细胞悬浮培养基筛选
2.2.1 正交试验的极差分析 从表5可以看出,第3因素接种量的极差最大,其次是第1因素2,4-D的质量浓度,说明细胞悬浮培养初期细胞团的个数受到接种量的影响最大,其次是生长素的质量浓度.从平均值看,第1因素的第1水平最好,第2因素的第3水平最好,第3因素的第3水平最好.所以各因素最好的搭配组合是MS+2,4-D 0.5 mg·L-1+6-BA 2.0 mg·L-1+ 接种量 40 g·L-1.在0.05水平上,第1因素和第3因素处理间差异显著,其余均不显著,而在0.01水平上,各个因素的处理间差异不显著.
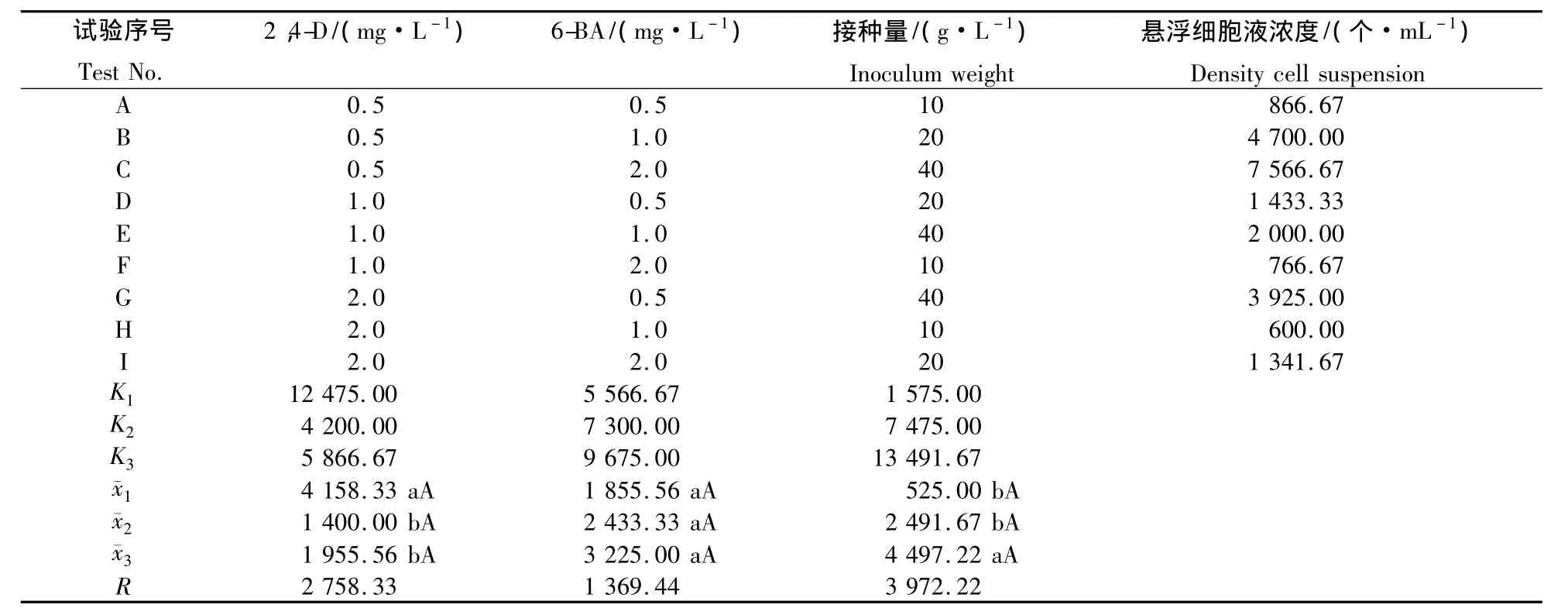
表5 细胞悬浮培养正交试验极差分析Table5 Variance analysis of cell suspension culture orthogonal design
通过对细胞悬浮液中细胞(图3)的观察发现,初代培养的细胞悬浮液中包括小细胞团、球形细胞和长型细胞.一些细胞团是在细胞脱离愈伤组织团块的基础上自身分裂产生的(图4),细胞团中的细胞处于有丝分裂的不同时期.一般这类的细胞团细胞个数较少,在10个左右或10个以下.初代培养球形单细胞(图5)的个数较少,通常是以2~3个细胞组成细胞团的形式出现.初代培养中,长型细胞以及部分的畸形细胞产生率较高.

图3 细胞悬浮液(×100)Fig.3 Cell suspension liquid(×100)
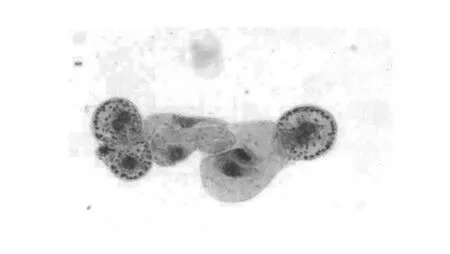
图4 旺盛分裂的细胞团(×200)Fig.4 Fast division cell cluster(×200)
2.2.2 正交设计培养基中细胞生长曲线 由图6可以看出,悬浮培养细胞生长曲线呈现抛物线型,2~4 d生长缓慢,4~6 d进入对数生长期,6 d以后呈现极速下降的趋势.原因主要是由于后期培养基中养分的消耗和pH值的变化使得悬浮细胞的生长环境急剧恶化,导致其分裂速度大幅下降,细胞死亡.因此,太行菊细胞悬浮培养的继代周期为6~7 d.

图6 不同培养基上太行菊悬浮细胞生长曲线Fig.6 The growth curve of Opisthopappus taihangensis suspension cells in different mediums
3 讨论
细胞悬浮培养体系的建立多来源于胚性愈伤组织,但是胚性愈伤组织的界定没有一个统一的标准,不同种植物的胚性愈伤组织也存在一定的差异.通常对于进行细胞悬浮培养所采用的愈伤组织不同研究者都有自己的划分方式,红景天[5]、草地早熟禾[17]、薰衣草[9]等几种植物材料的细胞悬浮培养体系建立,对于不同种类的愈伤组织有自己的划分.也有研究者笼统地将其描述为生长旺盛、疏松易于分散的愈伤组织,益母草[14]、桑树[15]、杜仲[16]等植物的细胞悬浮培养体系建立中是采取这种描述的.而对于太行菊,根据经验,结合了上述2种方式,从外观以及解剖触感等方面以软硬程度为划分标准,人为将其划分为5个梯度,以2和3为较适合进行悬浮培养的愈伤组织[11].

图5 球型单细胞(×400)Fig.5 Spherical cell(×400)
太行菊的细胞悬浮培养体系初代培养中细胞的几种形态,与报道的其他种类植物相似[17],有细胞团、球形细胞及长形细胞.而悬浮细胞的生长曲线与报道的小菊悬浮细胞半抛物线生长曲线有所不同[18],而与红景天[5]、丰花月季[19]的类似,悬浮细胞的生长曲线有明显的峰值,经过对数生长期后较明显的下降,这样的结果可能是由于培养体系较小,培养液的缓冲能力差,造成培养液环境过酸不适合细胞的生长,也有可能是太行菊悬浮细胞对于酸性的环境耐受度较差造成的.
综上所述,以太行菊为试验材料初步建立了细胞悬浮培养体系:以试管苗茎段为外植体,在MS+6-BA 2.0 mg·L-1+NAA 0.5 mg·L-1+2,4-D 1.0 mg·L-1培养基上诱导出的愈伤组织生长迅速,且排列紧密质地松软适合进行细胞悬浮培养.将获得的愈伤组织在液体培养基MS+6-BA 2.0 mg·L-1+2,4-D 0.5 mg·L-1中震荡培养,建立细胞悬浮培养体系.
[1] ROBERTO M,EMANUELA V,CHIARA R,et al.Nitric oxide is involved in cadmium-induced programmed cell death in Arabidopsis suspension cultures[J].Plant Physiology,2009,150:217-228.
[2] 李晓蕙,陈 蕾.植物细胞培养技术的发展与应用[J].安徽农学通报,2006,12(5):74-75.
[3] 胡海英,赵亚美,阎晓磊,等.香花槐愈伤组织的诱导与细胞悬浮培养技术[J].北京林业大学学报,2007,29(5):26-30.
[4] 翟晓巧,胡文远,范国强.毛泡桐悬浮细胞培养及其植株再生[J].河南农业大学学报,2010,44(1):34-40.
[5] 丁 婷,马 庆,项 艳.红景天愈伤组织的诱导及细胞悬浮培养[J].中国农学通报,2008,24(5):224-227.
[6] 胡张华,陈火庆,吴关庭,等.高羊茅悬浮细胞系的建立及绿色植株的高频再生[J].草业学报,2003,12(3):95-99.
[7] 李宗艳.石竹细胞悬浮培养研究[J].广西植物,2004,24(3):266-269.
[8] 朱根发,吕复兵,陈明莉,等.一品红体细胞胚胎发生与植株再生[J].亚热带植物科学,2004,33(4):37-38.
[9] 许耀祖,王晓军,赵民安,等.薰衣草细胞悬浮培养体系的优化[J].细胞生物学杂志,2005,27(6):701-704.
[10]郑启发,胡桂兵,陈大成,等.荔枝龙眼细胞悬浮培养和转基因研究[J].果树学报,2005,22(2):125-128.
[11]陈发棣,蒋甲福,郭维明.小菊悬浮细胞辐射育种初步研究I.基因型外植体和诱导愈伤组织培养基的选择[J].南京农业大学学报,2003,26(4):26-29.
[12]胡 枭,赵惠恩.太行菊属与菊属亚菊属远缘杂交试验初报[J].现代农业科学,2008,15(6):13-14.
[13]ANNADANA S,RADEMAKER W,RAMAMMA M,et al.Response of stem explants to screening and explant source as a basis for methodical advancing of regeneration protocols for chrysanthemum[J].Plant Cell,Tissue and Organ Culture,2000,62(1):47-55.
[14]李学栋,龚真才,马 勇,等.不同培养条件对益母草悬浮培养细胞生长的影响[J].西华师范大学学报:自然科学版,2008,29(2):136-140.
[15]李 勇,邢 辉,张金芳.桑树悬浮细胞生长规律及其生理特性的研究[J].蚕业科学,2007,33(1):91-94.
[16]王亚琴,叶青华,朱 媛.杜仲细胞悬浮培养生产绿原酸的初步研究[J].广西植物,2008,28(5):671-674.
[17]方文娟,韩烈保,张振环,等.草地早熟禾悬浮体系的建立及悬浮过程中细胞形态观察[J].生物技术通报,2006(2):85-87.
[18]陈发棣,蒋甲福,郭维明,等.小菊悬浮细胞培养与植株再生研究[J].园艺学报,2006,33(5):1021-1026.
[19]王艳红,龚束芳,车代弟.丰花月季愈伤组织的诱导及细胞悬浮培养[J].东北农业大学学报,2007,38(2):161-165.

