ANG-1基因重组腺病毒载体的构建及其转染骨髓间充质干细胞的实验研究
刘 君,徐 皓,陈建梅,姚晓东
基础研究
ANG-1基因重组腺病毒载体的构建及其转染骨髓间充质干细胞的实验研究
刘 君,徐 皓,陈建梅,姚晓东
目的构建携带大鼠血管生成素-1(angiopoietin-1,ANG-1)基因的重组腺病毒载体,并检测其转染对大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)活力的影响。方法RT-PCR法获取大鼠ANG-1基因并亚克隆至穿梭质粒pAdTrack-CMV,经测序无误后与骨架质粒pAdEasy-1在BJ5183中同源重组。重组质粒pAdEasy-1-ANG-1经鉴定后转染293细胞进行病毒包装扩增。体外转染BMSCs,检测转染后BMSCs中ANG-1的表达。MTT法评估常氧及缺氧环境下ANG-1对BMSCs的影响。结果重组腺病毒载体pAdEasy-1-ANG-1经测序及酶切鉴定正确;BMSCs经转染ANG-1基因后表达ANG-1。MTT法检测提示常氧及缺氧条件下转染前后BMSCs活性的差异均无统计学意义(缺氧组与缺氧下转染组相比,P>0.05;常氧组与常氧下转染组相比,P>0.05)。结论成功构建大鼠ANG-1基因重组腺病毒载体,且其转染在体外不影响BMSCs的活性。
血管生成素-1;腺病毒科;遗传载体;重组,遗传;转染;骨髓间充质干细胞
【Key words】Angiopoietin-1;Adenoviridae;Genetic vectors;Recombination,genetic;Transfection;Bone marrow mesenchymal stem cells
脊髓损伤的修复是亟待解决的世界性难题,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)移植为脊髓损伤的修复和治疗提供了一种新的途径[1-3]。但有报道显示,单纯进行BMSCs移植细胞存活率低,治疗作用有限[4]。究其原因可能是由于脊髓损伤造成缺血缺氧的微环境,而BMSCs对缺血、缺氧耐受性差所致。新近研究提示,血管生成素-1(angiopoietin-1,ANG-1)基因在缺氧环境下仍能诱导毛细血管形成[5],并通过构建新生血管网络改善缺血缺氧的微环境。本研究构建携带ANG-1基因的重组腺病毒载体并转染大鼠BMSCs,观察转染ANG-1基因对BMSCs的影响,为ANG-1基因修饰的BMSCs移植治疗脊髓损伤奠定实验基础。
1 材料和方法
1.1 主要实验材料和仪器
1.1.1 主要实验材料 AdEasy载体系统、DH5α、XL10-gold、293细胞株(本科留存),Trizol试剂盒、M-MLV逆转录酶、Lipofectamine 2000(Invitrogen公司,美国),DNA纯化试剂盒、DNA胶回收与纯化试剂盒、质粒抽提试剂盒(Omega公司,美国),质粒抽提试剂盒(Qiagen公司,德国),Taq聚合酶(Fermentus公司,美国),BglⅡ、SalⅠ、PmeⅠ、PacⅠ、T4连接酶(New England Biolabs公司,美国),CIP酶(Takara公司,日本),DNAMarker(TransGen公司,法国),PCR引物(上海生物工程有限公司),BCA蛋白检测试剂盒(Pierce公司,美国),山羊抗大鼠ANG-1多克隆抗体(Santa Cruz公司,美国),二甲基亚砜(Sigma公司,美国)。12%分离胶:ddH2O 1.6 mL,30%丙烯酰胺2.0 mL,1.5 MTris(pH 8.8)1.3 mL,10%SDS 0.05 mL,10%过硫酸铵0.05 mL,TEMED 0.002 mL。15%分离胶:ddH2O 1.15 mL,30%丙烯酰胺2.5 mL,1.5 MTris(pH 8.8)1.25 mL,10%SDS 0.05 mL,10%过硫酸铵0.05 mL,TEMED 0.002 mL。5%浓缩胶:ddH2O 2.1 mL,30%丙烯酰胺0.5 mL,1.0 MTris(pH 6.8)0.38 mL,10%SDS 0.03 mL,10%过硫酸铵 0.03 mL, TEMED 0.003 mL。SD大鼠BMSCs由同一实验组提供,按参考文献[6]方法制备。
1.1.2 主要实验仪器 Bio-Photometer微量核酸-蛋白定量仪(Eppendorf公司,德国),BX51/IX51型生物倒置显微镜(Olympus,日本),SZX2-ILLB型荧光显微镜(Olympus,日本),Fluor-S凝胶成像系统(BIO-RAD公司,美国),HEPA Class100型CO2培养箱(Thermo,美国),HEPA Class100型低氧培养箱(Thermo,美国),PE 2400PCR扩增仪(ABI公司,美国),Q-IMAGING型显微数码照相系统(Olympus,日本)。
1.2 实验方法
1.2.1 目的基因扩增及构建重组穿梭质粒 根据大鼠ANG-1基因的Genebank信息NM_053546,运用Primer Premier 5.0软件,设计SD大鼠ANG-1基因上下游引物扩增ANG-1基因的全长CDS区,上游引物加入BglⅡ位点,下游引物加入SalⅠ位点。上游引物:5'-GCGAGATCTATGACAGTTT TCCTTTCCTTTGC-3',下游引物:5'-GCACTG TCGACTCAGAAGTCCAAGGGCCGG-3'。Trizol试剂抽提SD大鼠胎盘组织总RNA,M-MLV逆转录酶合成cDNA。以此cDNA为模板设定PCR反应获得ANG-1基因片段并经琼脂糖电泳鉴定后胶回收纯化。纯化后的PCR产物与穿梭质粒pTrack-CMV分别经BglⅡ、SalⅠ进行双酶切,切胶纯化后T4连接酶连接。利用氯化钙法[7]转化感受态大肠杆菌DH5 α,抽提质粒(pAdTrack-CMV-ANG-1)双酶切鉴定,根据酶切结果取阳性克隆送测序。
1.2.2 细菌内同源重组构建重组腺病毒载体 制备感受态大肠杆菌BJ5183(含骨架质粒pAd Easy-1),将测序正确的重组质粒pAdTrack-CMV-ANG-1通过PmeⅠ酶切线性化后转化BJ5183感受态。酶切鉴定后获得阳性重组体pAdEasy-1-ANG-1,转化XL 10-gold大量扩增。
1.2.3 重组腺病毒在293细胞中的包装 复苏293细胞并传代培养,将PacⅠ酶切后的重组质粒产物通过lipofectamine 2000试剂盒转染293细胞,包装出有感染能力的重组腺病毒pAdEasy-1-ANG-1并扩增病毒。
1.2.4 重组腺病毒滴度测定 采用标记基因为GFP的重组病毒滴度测定法[8],以文献所述5∶1浓度稀释计算。
1.2.5 大鼠BMSCs的培养 SD大鼠BMSC长至80%融合后传代,置于37℃、5%CO2、饱和湿度的CO2培养箱中培养。倒置显微镜下观察细胞形态及生长状况。
1.2.6 ANG-1基因转染大鼠BMSCs及其表达检测取传代至第3代的BMSCs,加入感染复数(multiplicity of infection,MOI)值分别为50、200和400的腺病毒液,与完全培养基混匀成200 μL加入BMSCs各组中,病毒液体积按照每孔细胞的数量及所需MOI值计算。对照组不做处理。荧光显微镜观察GFP表达情况,检测重组腺病毒的感染效率。
1.2.7 Western blot法检测 ANG-1的表达 取MOI=200的腺病毒液转染48 h,可见大部分BMSCs表达荧光时所收集的细胞和转染前收集的BMSCs,分别提取细胞总蛋白。参照Pierce BCA蛋白定量试剂盒说明书检测蛋白含量,微量核酸-蛋白定量仪自动换算蛋白浓度。按配方配制12%、15%分离胶5 mL,5%浓缩胶3 mL,进行聚丙烯酰氨凝胶电泳。电泳结束后进行转膜、免疫印迹反应。
1.2.8 MTT法检测修饰后BMSCs的活性 按最优MOI转染BMSCs,培养箱中继续培养3~4 d,使BMSCs充分表达相应目的基因。将细胞分6组培养:(1)常氧组(5%CO2、95%空气);(2)低氧组(5% CO2、6%O2、89%N2);(3)常氧下感染腺病毒的BMSCs组;(4)低氧下感染腺病毒的BMSCs组;(5)常氧下空白载体转染的BMSCs组;(6)低氧下空白载体转染的BMSCs组。各组分设6个平行孔,在相应实验条件下培养24 h后,按10 μL/孔分别加入MTT,其终浓度为5 mg/mL。37℃培养4 h后吸弃上清,按150 μL/孔加入二甲基亚砜。用全自动酶标仪570 nm检测光密度值(OD570)。各实验均重复3次以上。
1.2.9 统计学处理 采用SPSS 17.0软件进行数据处理,所得结果以均值±标准差表示。各组数据比较采用单因素方差分析,两两比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 重组穿梭质粒pAdTrack-CMV-ANG-1的鉴定
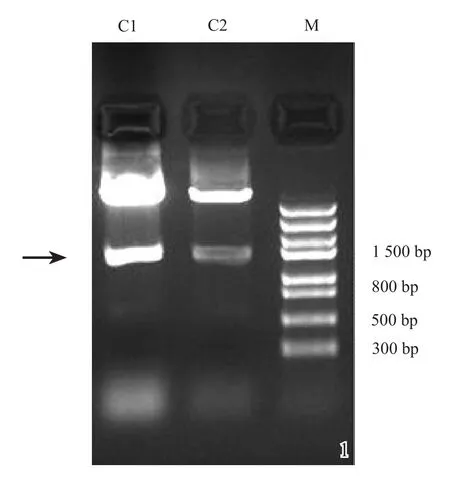
图1 根据GeneBank信息NM_053546,基因的全长PCR产物应为1 534 bp。pAdTrack-CMV-ANG-1经BglⅡ与SalⅠ双酶切后可见约1 500 bp处的目的条带(箭头处)及大片段的穿梭质粒条带M:5 kb DNA marker;C1、C2:pAd-Track-CMV-ANG-1/BglⅡ+SalⅠ
Trizol法成功提取大鼠胎盘组织总RNA,所提取RNA的OD260/OD280=1.92,RNA浓度:0.92× 4=3.68(μ g/μ L)。ANG-1/BglⅡ +SalⅠ与pAdTrack-CMV/BglⅡ+SalⅠ连接后构建成pAdTrack-CMV-ANG-1,扩增后抽提质粒,酶切鉴定结果如图1所示。经酶切鉴定后挑选出阳性重组质粒送测序。测序结果与GenBank提供的序列一致。

图2 用PacⅠ酶切重组质粒,阳性重组体出现一大于30 kb和4.5 kb的特征性条带(箭头处)M:5 kb DNA marker;C1:pAd-Easy-1-ANG-1/PacⅠ;C2:pAd-Easy-1/PacⅠ
2.2 重组腺病毒载体pAdEasy-1-ANG-1的鉴定
用AdEasy系统构建出重组质粒pAdEasy-1-ANG-1,PacⅠ进行酶切鉴定,并与空载体酶切进行比对(图2)。
2.3 重组腺病毒的包装扩增
用PacⅠ线性化pAdEasy-1-ANG-1,脂质体法转染到293细胞,包被病毒。9 d后贴壁细胞变圆,核变大,胞间紧密连接消失,细胞呈粗糙颗粒感并脱落,出现病毒感染后的病理改变,11 d后可见病毒空斑即噬菌斑(图3)。

图3 荧光显微镜下观察pAdEasy-1-ang-1在293细胞中包装过程中的GFP表达(×100)
2.4 重组腺病毒的滴度测定
感染293细胞20 h后,在第12孔仅有2个GFP阳性细胞(<5个),此孔作为计量孔,病毒滴度= 512×10=2.44×109(U/mL)。
2.5 ANG-1基因转染大鼠BMSCs及表达检测
MOI=50时(图4A,4B),3 d后仅少量荧光表达,10 d后方可见大部分BMSCs表达GFP荧光,所需时间过长。MOI=200时(图4C,4D),转染速度明显加快,24 h后镜下即可见部分荧光表达,且大部分BMSCs在48 h表达荧光。MOI=400时(图4E,4F),24 h后镜下即见大部分BMSCs表达GFP荧光,但在倒置相差显微镜下观察,见大多细胞生长状态明显较差。故以200作为最优MOI。Western blot法检测MOI=200转染后ANG-1的表达(图5)。
2.6 MTT法检测修饰后BMSCs的活性
6组修饰后BMSCs的光密度值结果如表1所示。常氧组分别与常氧+ANG-1组、常氧+空白质粒组比较,差异无统计学意义(P=0.996,P= 1.000);缺氧组分别与缺氧+ANG-1组、缺氧+空白质粒组相对比,差异无统计学意义(P=1.000,P= 0.967);而常氧+ANG-1组与常氧+空白质粒组、缺氧+ANG-1组与缺氧+空白质粒组相比较,差异亦无统计学意义(P=0.991,P=0.889)。
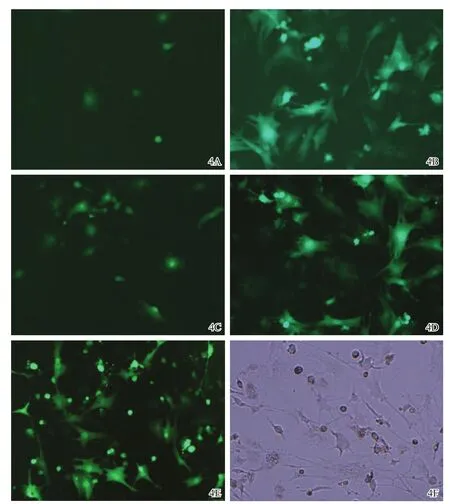
图4 以不同MOI值转染BMSCs的荧光表达情况 4A,4B 3 d后仅少量荧光表达,10 d后方可见大部分BMSCs表达GFP荧光(MOI=50转染BMSCs后荧光表达×200)4C,4D MOI=200时,转染速度明显加快,24 h后镜下即可见部分荧光表达,大部分BMSCs也在48 h表达荧光(×200)4E,4F MOI=400时,24h后镜下即见大部分BMSCs表达GFP荧光,但在倒置相差显微镜下观察见大多细胞生长状态明显较差(×200)
3 讨论
ANG-1是最重要的血管生成因子之一,它具有抑制内皮细胞凋亡,促进内皮细胞出芽、迁徙的作用;同时还可降低血管通透性,减少血管萎缩和退化,起到稳定血管和防止渗漏的作用[9];此外,ANG-1可通过抵制炎症因子表达来改善炎症。研究还显示,MAPK和PI-3 kinase/Akt信号传导途径在ANG-1改善内皮细胞存活率方面起着决定性作用[10]。
在缺氧条件下,ANG-1在介导血管生成过程中产生以H2O2为主的活性氧。H2O2可调节p44/42和p38促分裂原活化蛋白激酶活性,促进细胞迁移和血管形成;同时减轻氧化应激造成的细胞凋亡反应。研究表明,ANG-1和自体骨髓细胞移植联合治疗不仅可以增加局部缺血组织血管再生的数量,同时还可提高再生质量[11]。Onda等[12]将成人BMSCs和ANG-1转染的BMSCs输入永久性脑缺损的大鼠模型后,发现二者均能明显减少损伤体积和改善损伤程度,而ANG-1转染组损伤处的血流改善明显多于新生血管生成。由此推测,若将有效的基因载体介导ANG-1基因转染用于移植的BMSCs,则有望改善移植部位缺血缺氧的微环境,提高移植后BMSCs存活率。
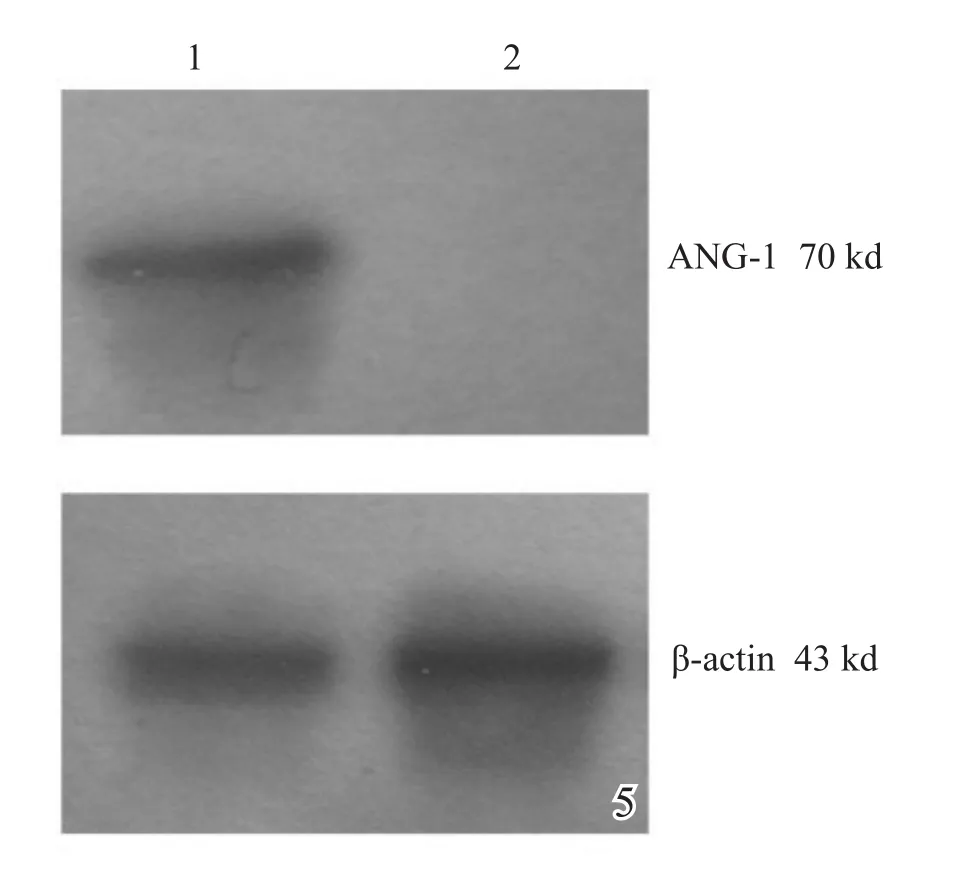
图5 Western blot检测转染后BMSCs表达ANG-1水平,未转染的BMSCs不表达ANG-1 1:转染后BMSCs;2:未转染的BMSCs
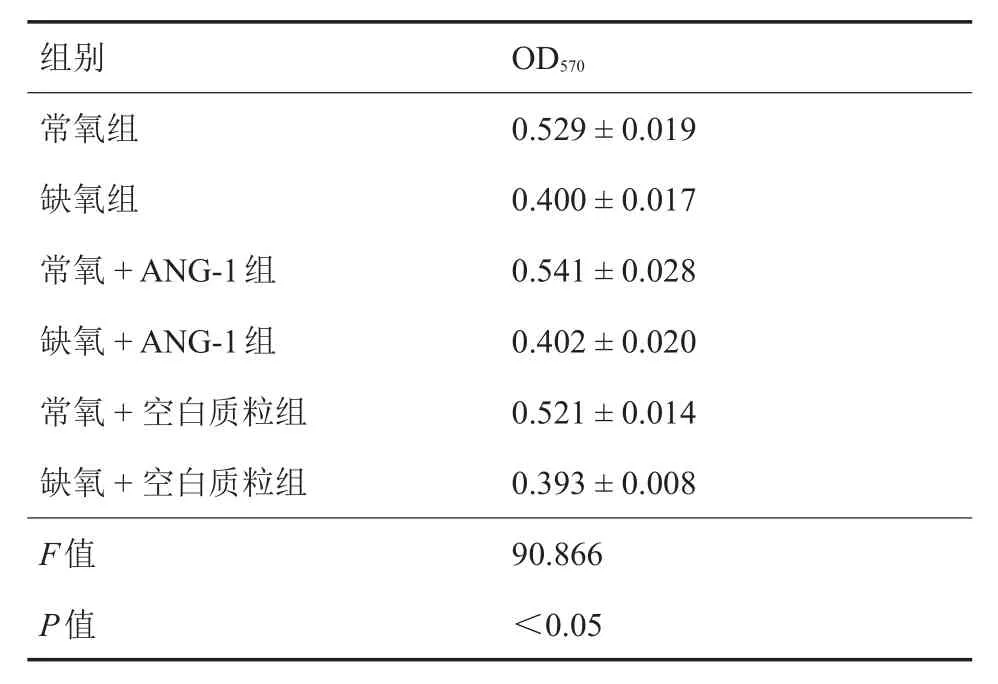
表1 MTT法检测6组修饰后BMSCs的光密度值结果
腺病毒载体高效、安全、快捷[13],是基因治疗较为理想的载体。本研究选用的是AdEasy腺病毒载体系统,利用GFP作为报告基因,可在荧光显微镜下直视了解转染效率,快速判读病毒滴度,加速重组腺病毒载体的构建、筛选和纯化过程,提高效率。
制备腺病毒载体的常用方法有体外连接法、同源重组法、位置特异性重组法、Cre/LoxP法等,本研究应用细菌内同源重组法制备重组腺病毒载体,首先将目的基因克隆到穿梭质粒中,再将腺病毒骨架质粒与其共转化感受态细菌,在细菌中完成同源重组,筛选后转染包装细胞系包装。此法在细菌中重组,重组效率较细胞内重组高,且技术成熟、重复步骤少、实验时间短,避免了多轮筛选鉴定。AdEasy系统骨架质粒pAdEasy-1为氨苄青霉素抗性,缺失E1区和E3区,E1区为病毒复制所必需,293细胞能提供反式补偿,实现病毒包装,包装出的病毒可表达目的基因,但不能自我复制,为复制缺陷型,用其进行研究对靶细胞的损害较少。
由于骨架质粒pAdEasy-1较大,系统本身推荐电转化法,但需要昂贵的电穿孔仪[14]。本研究尝试利用氯化钙法进行两步法转化,既可满足实验要求,又可降低实验成本。先将骨架质粒pAdEasy-1以氯化钙法转化入感受态大肠杆菌BJ5183,经抗性筛选、酶切鉴定后,再将含目的基因的穿梭质粒同样以氯化钙法转化大肠杆菌BJ5183(pAdEasy-1+)。经此法改进后的AdEasy系统使骨架质粒AdEasy-1在大肠杆菌内预先形成多拷贝环境,同源重组时即可获得更高的效率,同样对实验室条件要求较低。本研究制备出高效的大肠杆菌BJ5183(pAdEasy-1+)菌种,经氯化钙制备为感受态后,可重复利用,简单方便。此外,通过改进的方法获得极高的重组阳性率,为大量扩增创造了条件。
不同载体对相同靶细胞的转染效率不同,相同载体对不同靶细胞的转染效率亦不同。腺病毒载体转染率高,在时间固定的情况下,一定范围内通过提高MOI值,可以克服细胞对腺病毒转染的抵抗,进一步提高转染率。但有研究表明,当MOI值超过50时,细胞开始受到损伤,推测可能是病毒蛋白的高表达所致[15];MOI值为300时,转染大鼠BMSCs在48h后即获得90%以上的转染率,但细胞损伤较大[16]。亦有研究显示,MOI为400时转染效率最高,>400后转染效率将不再增加[17]。由此可见,即使是为了提高转染率,亦不可使用过高的MOI,以免产生负面影响。本实验设置50、200、400的MOI梯度,观察发现GFP阳性细胞数量和MOI值呈正比,且MOI值越高,GFP表达也越早,说明BMSCs对于腺病毒而言具有易感性。转染后在相同时间点,当MOI值为400时转染效率最高,但腺病毒本身对靶细胞具有一定的损伤作用,此时在倒置显微镜下观察到的细胞生长状态不佳,无法用于进一步研究;而当MOI=200时,48 h内即可见大部分细胞表达GFP,且BMSCs生长形态未见明显变化,为本研究的最优MOI。
MTT法是目前实验室广泛应用的体外检测细胞活力的方法,该方法所需细胞少,操作简便,可用于BMSCs的体外活性检测[18]。本实验比较常氧及低氧环境下对照组与实验组的细胞活力,并通过与重组腺病毒空白质粒转染对照组的对比(缺氧组与缺氧+空白质粒组相比,P>0.05;常氧组与常氧+空白质粒组相比,P>0.05)排除了腺病毒载体本身对BMSCs存活率的影响。结果证实,转染ANG-1基因未对BMSCs的活性造成不利影响(缺氧组与缺氧+ANG-1组相比,P>0.05;常氧组与常氧+ANG-1组相比,P>0.05)。据报道[19],缺氧环境下ANG-1能提高或恢复缺氧部位Tie-2的表达水平,并通过激活Tie-2的酪氨酸激酶活性,使其发生磷酸化,产生抗凋亡作用,保护细胞。由于ANG-1基因的受体Tie-2特异性地表达于血管内皮细胞,而BMSCs上缺乏该受体,故导致ANG-1在体外无法起到有效的保护作用,这与本次MTT的检测结果也是一致的(常氧+ANG-1组与常氧+空白质粒组相比,P>0.05;缺氧+ANG-1组与缺氧+空白质粒组相比,P>0.05)。本次实验中常氧组检测结果提示,MOI=200时转染ANG-1基因对BMSCs的活性无不利影响,从而证实了ANG-1基因转染BMSCs的安全性,同时为ANG-1基因修饰的BMSCs移植治疗脊髓损伤的动物模型研究提供依据。
[1] Itosaka H,Kuroda CS,Shihinohe H,et al.Fibrin matrix provides a suitable scaffold for bone marrow stromal cells transplanted into injured spinal cord:a novel material for CNS tissue engineering[J].Neuropathology,2009,29(3): 248-257.
[2]阮智,黄慧,孙建华,等.异体骨髓间充质干细胞移植治疗大鼠脊髓损伤[J].中国组织工程研究与临床康复,2010,l4 (36):6729-6732.
[3]Cho JS,Park HW,Park SK,et al.Transplantation of mesenchymalstem cellsenhancesaxonaloutgrowth and cell survival in an organotypic spinal cord slice culture[J]. Neurosci Lett,2009,454(1):43-48.
[4]冯大雄,钟德君,宋跃明.静脉移植骨髓间充质干细胞在大鼠损伤脊髓中的存活与分化[J].中国脊柱脊髓杂志,2006,l6 (7):527-530,插3.
[5]Kanda S,Kanetake H,Miyata Y.Role of Src in angiopoietin 1-induced capillary morphogenesis of endothelial cells:effect of chronic hypoxia on Src inhibition by PP2[J].Cell Signal, 2007,19(3):472-480.
[6]潘廷明.转染cxcr4基因对骨髓间充质干细胞向SDF-1趋化能力的影响[D].福州:福建医科大学,2009:30-31.
[7]汤福祥,郑权,黄宗海,等.应用改进的AdEasy系统制备重组腺病毒[J].第一军医大学学报,2003,23(5):501-503.
[8]江千里,王健民,温丽敏,等.批量快速测定法测定标志基因为GFP的重组病毒滴度[J].第二军医大学学报,2002,23 (9):1034-1035.
[9] Childs EW,Tharakan B,Byrge N,et al.Angiopoietin-1 inhibitsintrinsic apoptotic signaling and vascularhyperpermeability following hemorrhagic shock[J].Am J Physiol Heart Circ Physiol,2008,294(5):H2285-H2295.
[10]Abdel-Malak NA,Mofarrahi M,Mayaki D,et al.Early growth response-1 regulates angiopoietin-1-induced endothelial cell proliferation,migration,and differentiation[J]. Arterioscler Thromb Vasc Biol,2009,29(2):209-216.
[11]Kobayashi K,Kondo T,Inoue N,et al.Combination of in vivo angiopoietin-1 gene transferand autologous bone marrow cell implantation for functional therapeutic angiogenesis[J].Arterioscler Thromb Vasc Biol,2006,26(7): 1465-1472.
[12]Onda T,Honmou O,Harada K,et al.Therapeutic benefits by human mesenchymalstem cells(hMSCs)and ANG-1 gene-modified hMSCs after cerebral ischemia[J].J Cereb Blood Flow Metab,2008,28(2):329-340.
[13]Roelants V,Labar D,de Meester C,et al.Comparison between adenoviral and retroviral vectors for the transduction of the thymidine kinase PET reporter gene in rat mesenchymal stem cells[J].J Nucl Med,2008,49(11):1836-1844.
[14]Zeng M,Smith SK,Siegel F,et al.AdEasy system made easier by selecting the viral backbone plasmid preceding homologous recombination[J].Biotechniques,2001,31(2):260-262.
[15]Matsumoto R,Omura T,Yoshiyama M,et al.Vascular endothelialgrowth factor-expressing mesenchymalstem cell transplantation for the treatment of acute myocardial infarction[J].Arterioscler Thromb Vasc Biol,2005,25(6): 1168-1173.
[16]Bivalacqua TJ,Deng W,Kendirci M,et al.Mesenchymal stem cells alone or ex vivo gene modified with endothelial nitric oxide synthase reverse age-associated erectile dysfunction[J].Am J Physiol Heart Circ Physiol,2007,292(3): H1278-H1290.
[17]刘霞,孙宏晨,刘金钟,等.血管内皮细胞生长因子基因转染大鼠骨髓间充质干细胞生物学效应的研究[J].口腔医学研究,2009,25(1):26-29.
[18]Tabera S,Pérez-Simón JA,Díez-Campelo M,et al.The effect of mesenchymal stem cells on the viability,proliferation and differentiation of B-lymphocytes[J].Haematologica,2008,93 (9):1301-1309.
[19]Kugathasan L,Dutly AE,Zhao YD,et al.Role of angiopoietin-1 in experimentaland human pulmonary arterial hypertension[J].Chest,2005,128(6 Suppl):633-642.
Construction of recombinant adenovirus vectors encoding angiopoietin-1 gene and its transfection on bone marrow mesenchymal stem cells
LIU Jun,XU Hao,CHEN Jianmei,YAO Xiaodong.Department of Orthopaedics,Fujian Medical University,Fuzhou General Hospital,Fuzhou,Fujian 350025,China. Corresponding author:XU Hao,Email:xiuhao@medmail.com.cn
ObjectiveTo construct recombinant adenovirus vectors encoding rat angiopoietin-1(ANG-1)gene and to evaluate the effects of ANG-1 gene transfection on proliferation of bone marrow mesenchymal stem cells (BMSCs)in vitro.MethodsThe ANG-1 gene sequence was amplified by RT-PCR and then subcloned into shuttle plasmid pAdTrack-CMV,and transformed into BJ5183 carrying backbone plasmid pAdEasy-1 to obtain adenovirus plasmid through homologous recombination.The recombinant vector was identified by digestion with Pac I,and was packaged and amplified in 293 cells.The successfully packaged virus were transfected to BMSCs. The expression of ANG-1 protein in BMSCs were monitored by Western Blot assay,and the effects of ANG-1 on the proliferation of BMSCs under hypoxia and normoxia conditions in vitro were evaluated by MTT assay.ResultsThe recombinant plasmid pAdEasy-1-ANG-1 was identified to be confirmed by double digestion and DNA sequencing.The expression of ANG-1 protein in BMSCs was detected by Western Blot after the transfection of pAdEasy-1-ANG-1.MTT assay suggested that the expression of ANG-1 protein in BMSCs had no significant effect on the proliferation of BMSCs before and after transfection(hypoxia+ANG-1 vs hypoxia:P>0.05;normoxia+ANG-1 vs normoxia:P>0.05).ConclusionThe recombinant adenovirus vector named pAdEasy-1-ANG-1 carrying ANG-1 gene have been constructed successfully.The transfection of ANG-1 has no significant effect on the proliferation of BMSCs in vitro.
R394,R329.2
A
1674-666X(2011)03-0199-08
2011-05-15;
2011-06-27)
(本文编辑 白朝晖)
10.3969/j.issn.1674-666X.2011.03.008
福建省青年人才基金(2007F3079)
350025福州,福建医科大学福总临床医学院骨一科
徐皓,E-mail:xiuhao@medmail.com.cn

