Y染色体AZFc区缺失与原发性男性不育相关性研究
(昆山市锦溪人民医院男性科,江苏 昆山215300)
姚卫国(兴化市第五人民医院男性科,江苏 兴化225766)
不孕不育一直是生殖健康领域亟待解决的重大科学问题。根据世界卫生组织统计,世界上有8%~15%的育龄夫妇患有不育症,其中由男方原因引起的不育占一半左右。造成男性不育的原因很多,主要包括生精障碍、输精管道梗阻、附属性腺器官异常、性功能异常、全身性疾病引起的不育等。其中又以精子发生障碍最为常见。而在精子发生障碍的患者中有大约30%的患者是由于遗传学的异常引起的 。自Tiepolo等发现 “无精子症因子(azoospermia Factor)”以来,Y染色体微缺失被认为是原发性男性不育的重要原因,并成为男性不育研究的热点[1]。
“无精子症因子”分布于Y染色体长臂的三个不同区域,被称为AZFa、AZFb和AZFc[2]。与其他染色体不同,Y染色体上约95%的区域不会与X染色体发生重组,所以被称为非重组区(non-recombining region,NRY),也称为男性特异区(MSY),其上某些序列经过了自我复制,相互之间高度同源,即存在回文序列(palindrome)结构,Y染色体的这种特殊的结构容易发生非等位同源重组,进而产生各种大片段的缺失,AZFc区域尤其容易发生缺失,因为该区域完全由回文序列结构构成,从而容易诱发该区内的各种缺失再发[3-4]。例如,典型AZFc缺失亚型b2/b4缺失发生在扩增子b2和扩增子b4之间。b2/b4缺失使整个AZFc区域(包含8个基因,其中3个编码睾丸特异性蛋白)缺失,是我们所知的与精子生成障碍紧密相关的确定的病因[5](图1)。在AZFc区的结构被鉴定之后,AZFc区部分缺失以及导致这些缺失的潜在的分子机制的探究引起了更多的关注[6]。
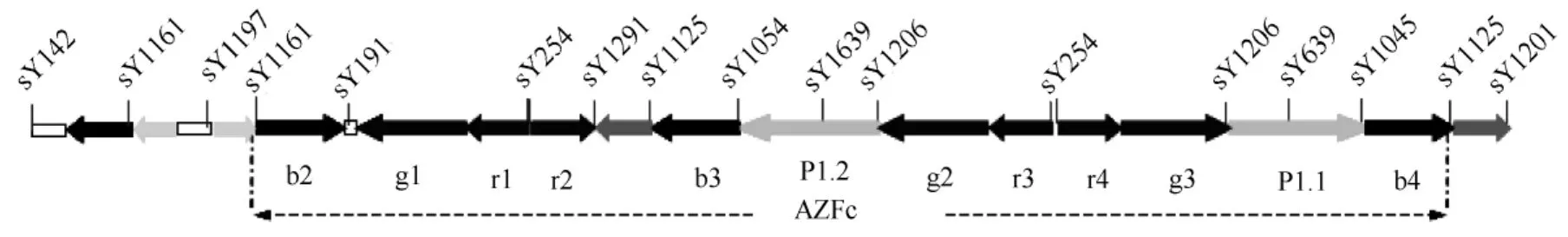
图1 AZFc区重复序列结构及STS位点布局
gr/gr部分缺失和b2/b3部分缺失是AZFc区部分缺失的两种主要缺失形式。gr/gr部分缺失是由于顺向重复序列(g1-r1-r2和g2-r3-r4)间发生同源重组,造成AZFc区中约1.6Mb长的片断及其上基因拷贝被去除。b2/b3部分缺失是在gr/rg倒位或b2/b3倒位的基础上进一步发展而来,造成AZFc区中约1.8Mb长的片断及其上基因拷贝被去除。但是学术界对它们在精子生成过程中的影响作用存在争论。
本课题以昆山市锦溪人民医院与兴化市第五人民医院为样本采集点,开展了以医院人群为基础的分子流行病学病例—对照研究,我们采用了多种特殊的序列示踪位点(STS)标志物相结合的办法[6-8],检测原发性不育和正常人群样本缺失情况。从分子水平探讨Y染色体AZFc区部分缺失同男性原发性不育之间的关系,为高危人群的筛检和更好的开展辅助生育工作提供理论依据。
1 对象与方法
1.1 对象
本研究病例来自昆山市锦溪人民医院、兴化市第五人民医院的男性不育门诊病例;对照来自昆山市锦溪人民医院自愿参加生殖内分泌激素水平和血清代谢物水平检测的,有正常生育史的男性医院内对照。病例和对照均来自中国东部的汉族人群,并且年龄匹配。
研究对象的选择和排除标准:所有原发不育病例均无生育史,并且通过体格检查,精液常规检查,血清FSH,LH和T检测和核型分析。通过这些检测确诊原发不育病例393例,年龄25~38岁,并且根据WHO男性不育诊断手册[8],将其分为3组,即:无精病人191例、少精病人 [精液密度:(0.1~20)×106/ml]121例、不育/精子生成正常患者(精液密度:>20×106/ml)81例。所有对照均有近期生育史(1年内),并且进行了体格检查。最终入选对照214例。研究对象均签署知情同意书,且完成流行病学调查和提供血液标本。
1.2 方法
1.2.1 基因组DNA提取 采集静脉血5ml,采用传统的酚-氯仿抽提法提取基因组DNA,用紫外分光光度法(A260/280比值)确定DNA纯度,OD260测定DNA浓度。
1.2.2 Y染色体AZFc区缺失类型检测 序列标签位点(Sequence Tagged Site,STS)是一类在基因组上用以区分不同片段的特征序列,长度从几十个碱基到几百个碱基不等。当染色体上的某个区域有缺失发生时,这段区域连同其上的STS位点会被一同去除。所以,对候选缺失区域上各种STS位点的检测,可以确定缺失发生所涉及的具体DNA片段。STS位点可以直接通过PCR扩增后电泳检测,具有高效和快速的优点,适合大样本人群的检测。因此我们选用该方法检测AZFc区部分缺失。AZFc区部分缺失检测包括三个PCR体系:体系一:sY1206、sY1161、sY639;体系二:sY1291、sY254、sY160;体系三:sY1201,sY1191,sY1125。其中sY1191和sY1291具有最高的信息量,sY1191缺如代表b2/b3缺失,sY1291缺如代表gr/gr缺失,若sY1191和sY1291同时缺如代表AZFc全缺失。
1.3 统计学分析
计数资料的比较采用χ2检验,对于理论频数小于5的采用Fisher’精确概率法。采用Wloof检验计算相对危险度及95%可信区间。对各种缺失类型与原发性男性不育相关性进行单因素统计分析。全部统计学检验均为双侧检验,P<0.05为差异有统计学意义。统计分析软件为Stata 9.0。
2 结 果
2.1 AZFc全缺失在不同生精状态组间的分布
在本研究中共检测AZFc全缺失28例,且全部来自病例组(其中21例来自无精组,7例来自少精组),而在正常对照组中没有检测到。
2.2 AZFc区部分缺失在不同生精状态组间的分布
通过对研究对象AZFc区部分缺失(gr/gr和b2/b3)的检测,分析gr/gr部分缺失和b2/b3部分缺失在不同精子生成状态组间的频率分布情况(见表1)。在214例正常对照中,共检测到18例gr/gr部分缺失、9例b2/b3部分缺失,而在393例原发性男性不育病例中,共检测到41例gr/gr部分缺失、36例b2/b3部分缺失样本。b2/b3部分缺失在原发性男性不育组和正常对照组间的频率分布具有统计学差异(OR=2.49,95%CI:1.18~5.28,P=0.014),而gr/gr部分缺失在这两个组之间的分布没有差异。上述结果提示b2/b3部分缺失会增加原发性男性不育的风险性。
造成男性不育的因素很多,那么b2/b3部分缺失是通过什么途径引起男性不育的呢?为了探讨这个问题,随后我们将原发性男性不育细分为无精组、少精组、不育/精子生成异常组(包括无精和少精)以及不育/精子生成正常组。在191例无精病人中,总计检测到gr/gr部分缺失21例、b2/b3部分缺失17例;在121例少精病人中,检测到gr/gr部分缺失13例,b2/b3部分缺失11例;在81例不育/精子生成正常组中,检测到gr/gr部分缺失7例,b2/b3部分缺失8例。通过对AZFc区部分缺失在不同生精表型组间分布频率的分析,我们发现,与对照组相比,b2/b3部分缺失在无精组(OR=2.53,95%CI:1.10~5.83,P=0.025)、少精组(OR=2.43,95%CI:0.98~6.06,P=0.05)及不育/精子生成异常组(OR=2.49,95%CI:1.15~5.40,P=0.017)的频率差异具有统计学意义(见表1)。
上述结果表明,b2/b3部分缺失会增加原发性男性不育发生的风险性,而且这种风险性是通过精子生成障碍引起的。
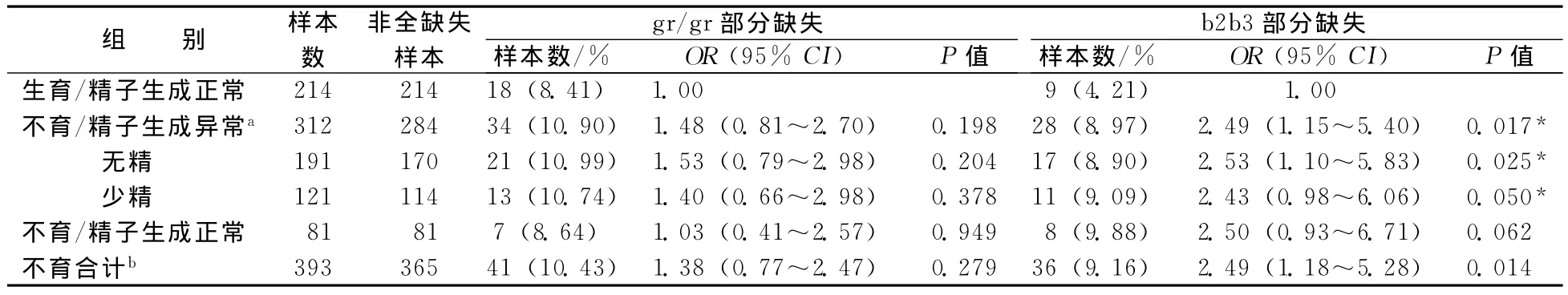
表1 gr/gr和b2/b3部分缺失在不同生精表型组间的分布
3 讨 论
近年来,Y染色体微缺失及AZFc区部分缺失成为男性不育研究的热点。在世界范围内,不同研究人群因为种族等方面的原因Y染色体缺失的发生频率各异,从5%到20%各不相等[9-13]。与典型AZF区缺失相比,AZFc区部分缺失表型存在多样性。通过STS组合分析方法[9],我们对该人群中两种主要缺失类型进行了检测分析:gr/gr部分缺失和b2/b3部分缺失。我们研究发现,中国汉族男性人群中gr/gr部分缺失和b2/b3部分缺失的频率要显著高于其他不同人群。
在中国汉族人群这393名男性不育患者中,gr/gr部分缺失的频率(10.43%)要比美国研究人群所检测出的结果(2.2%)高出很多,甚至要高于对欧美生精功能受损的患病人群所检测出的结果(3.7%~5.1%)[14-17]。这也许是因为研究对象不同的遗传背景造成的,而最近一项有关东亚人群的研究(病例组和对照组gr/gr部分缺失的患病率分别是10.3%和10.1%)也证实了这一点[18]。本研究与欧洲的一些相关的研究结果不同[19],病例组和对照组在gr/gr缺失频率上没有明显的差异(分别为10.43%和8.41%),提示gr/gr部分缺失与中国汉族人群中原发性男性不育无显著关联[20]。考虑到我们所研究的人群是中国汉族男性人群,特定的遗传背景也许再一次发挥了效力。
首次被Sjoerd Repping’s课题组所阐释的b2/b3部分缺失曾一度被人们所忽视。他们对1563位男性进行了检测,发现有25例缺少sY1191位点,但却具有该位点两侧的STSs。在经过原位杂交荧光测定的确证之后,他们发现这种特殊缺失类型发生在b2/b3扩增子之间[16]。由于其发生频率较低,b2/b3部分缺失对男性不育影响程度仍然是未知的[21]。在本研究中,我们发现,b2/b3部分缺失的发生率在原发性男性不育组(9.16%)与正常对照组(4.21%)之间,具有显著差异(P=0.014)。那么b2/b3部分缺失是通过什么途径影响男性不育的呢?随后我们将病例样本细分为无精组、少精组以及不育/精子生成正常组。结果显示b2/b3部分缺失在无精组(P=0.025)、少精组(P=0.050)以及不育/精子生成异常组(P=0.017)的发生率显著高于正常对照组,而在不育/精子生成正常组中的发生率与对照组相比没有显著差异(P=0.062)。综上可以得出:b2/b3部分缺失与精子生成障碍之间有着显著关联,即b2/b3部分缺失会增加精子生成障碍的风险性。
AZFc区是正常生精功能所必需的,b2/b3缺失使AZFc上1.8Mb的长度丢失,其中包括12个睾丸特异表达的基因或转录子。与使AZFc区上1.6Mb长度丢失的gr/gr部分缺失相比,b2/b3部分缺失多出三个基因拷贝缺失,包含1个BPY2拷贝、1个TTTY4拷贝和1个TTTY17拷贝。考虑到这两种部分缺失与男性不育关联程度的不同,一种可能的原因就是存在与精子发生相关的特定的基因拷贝。其次,尽管是相同的基因,不同拷贝的缺失可能会有不同的结局,而这最有力的证据来自DAZ基因家族。已知DAZ基因家族有4个高度同源的拷贝,它们在功能上可能并不完全相同[19]。Ferlin的研究发现DAZ1/2缺失和DAZ3/4缺失对生精功能损伤程度不同,为上述推断提供了有力的佐证。
总的来说,此种关联性研究为后续的功能学研究起到了一定的铺垫作用。我们需要更大规模人群样本来验证这种关联的存在,全面阐述AZFc区不同基因及其不同拷贝在精子发生中的作用,为男性不育的诊断和治疗提供新的思路。考虑到AZFc区部分缺失可能遗传给男性后代[21-23],因此,在行IVF(in-vitro fertilization)或ICSI(intracytoplasmic sperm injection)治疗之前有必要对男性 AZF微缺失以及部分缺失的情况进行检查,并告之不育夫妇可能发生的遗传学后果,为其提供遗传学咨询,以降低不良遗传后果的发生率。
[1]Tiepolo L,Zuffardi O.Localization of factors controlling spermatogenesis in the nonfluorescent portion of the human Y chromosome long arm [J].Hum Genet,1976,34:119-124.
[2]Vogt P H,Edelmann A,Kirsch S,et al.Human Y chromosome azoospermia factors(AZF)mapped to different subregions in Yq11 [J].Hum Mol Genet,1996,5:933-943.
[3]Skaletsky H,Kuroda-Kawaguchi T,Minx P J,et al.The male-specific region of the human chromosome is a mosaic of discrete sequence classes[J].Nature,2003,423:825-837.
[4]Simoni M,Bakker E,Krausz C.EAA/EMQN best practice guidelines for molecular diagnosis of Y-chromosomal microdeletions [J].Int J Androl,2004,27:240-249.
[5]Kuroda-Kawaguchi T,Skaletsky H,Brown L G,et al.The AZFc region of the Y chromosome features massive palindromes and uniform recurrent deletions in infertile men [J].Nat Genet,2001,29:279-286.
[6]de Llanos M,Ballesca J L,Gazquez C,et al.High frequency of gr/gr chromosome Y deletions in consecutive oligospermic ICSI candidates [J].Hum Reprod,2005,20:216-220.
[7]Giachini C,Guarducci E,Longepied G,et al.The gr/gr deletion(s):a new genetic test in male infertility [J]?J Med Genet,2005,42:497-502.
[8]Fernandes S,Paracchini S,Meyer L H,et al.A large AZFc deletion removes DAZ3/DAZ4and nearby genes from men in Y haplogroup [J].N Am J Hum Genet,2004,74:180-187.
[9]Vogt P H.Human chromosome deletions in Yq11,AZF candidate genes and male infertility:history and update [J].Mol Hum Reprod,1998,4:739-744.
[10]Krausz C,McElreavey K.Y chromosome and male infertility [J].Front Biosci,1999,4:1-8.
[11]Krausz C,Forti G,McElreavey K.The Y chromosome and male fertility and infertility [J].Int J Androl,2003,26:70-75.
[12]Fernandes S,Huellen K,Goncalves J,et al.High frequency of DAZ1/DAZ2gene deletions in patients with severe oligozoospermia [J].Mol Hum Reprod,2002,8:286-298.
[13]Repping S,Skaletsky H,Brown L,et al.Polymorphism for a 1.6-Mb deletion of the human Y chromosome persists through balance between recurrent mutation and haploid selection [J].Nat Genet,2003,35:247-251.
[14]Repping S,van Daalen S K,Korver C M,et al.A family of human Y chromosomes has dispersed throughout northern Eurasia despite a 1.8-Mb deletion in the azoospermia factor region [J].Genomics,2004,83:1046-1052.
[15]Ferlin A,Tessari A,Ganz F,et al.Association of partial AZFc region deletions with spermatogenic impairment and male infertility[J].J Med Genet,2005,42:209-213.
[16]Machev N,Saut N,Longepied G,et al.Sequence family variant loss from the AZFc interval of the human Y chromosome,but not gene copy loss,is strongly associated with male infertility [J].J Med Genet,2004,41:814-825.
[17]Hucklenbroich K,Gromoll J,Heinrich M,et al.Partial deletions in the AZFc region of the Y chromosome occur in men with impaired as well as normal spermatogenesis [J].Hum Reprod,2005,20:191-197.
[18]Zhang F,Li Z,Wen B,Jiang J,et al.A frequent partial AZFc deletion does not Render an increased risk of spermatogenic impairment in East Asians[J].Ann Hum Genet,2005,70:304-313.
[19]Lynch M,Cram D S,Reilly A,et al.The Y chromosome gr/gr subdeletion is associated with male infertility [J].Mol Hum Reprod,2005,11:507-512.
[20]Fernando L,Gromoll J,Weerasooriya T R,et al.Y-chromosomal microdeletions and partial deletions of the azoospermia factor c(AZFc)region in normozoospermic,severe oligozoospermic and azoospermic men in Sri Lanka [J].Asian J Androl,2006,8:39-44.
[21]Kent-First M G,Kol S,Muallem A,et al.The incidence and possible relevance of Y-linked microdeletions in babies born after intracytoplasmic sperm injection and their infertile fathers [J].Mol Hum Reprod,1996,2:943-950.
[22]Jiang M C,Lien Y R,Chen S U,et al.Transmission of de novo mutations of the deleted in azoospermia genes from a severely oligozoospermic male to a son via intracytoplasmic sperm injection [J].Fertil Sterility,1999,71:1029-1032.
[23]Oates R D,Silber S,Brown L G,et al.Clinical characterization of 42oligospermic or azoospermic men with microdeletion of the AZFc region of the Y chromosome,and of 18children conceived via ICSI [J].Hum Reprod,2002,17:2813-2824.

