高效液相色谱-荧光检测法测定蜂蜜中的果糖、葡萄糖和麦芽糖
张其安,王 娟,戴建晓,杜培粉,王素轻,卢德梅,杨少波,*
(1.山东华康蜂业有限公司,山东 日照 276500;2.山东水利职业学院,山东 日照 276826;3.咸阳健康蜂业有限公司,陕西 咸阳 713400)
高效液相色谱-荧光检测法测定蜂蜜中的果糖、葡萄糖和麦芽糖
张其安1,王 娟2,戴建晓1,杜培粉1,王素轻1,卢德梅3,杨少波1,*
(1.山东华康蜂业有限公司,山东 日照 276500;2.山东水利职业学院,山东 日照 276826;3.咸阳健康蜂业有限公司,陕西 咸阳 713400)
建立反相离子对色谱法同时测定蜂蜜中果糖、葡萄糖、麦芽糖含量的方法。样品经对氨基苯甲酸衍生化后,采用ODS柱,以0.1mol/L磷酸盐缓冲液(20mmol/L四丁基硫酸氢铵,pH2.5)∶乙腈=95∶5为流动相,荧光检测器检测,外标法定量。结果表明,果糖、葡萄糖、麦芽糖的检出限分别为210、96、240μg/kg,线性范围分别为130~140、52~98、154~98mg/kg,在其线性范围内相关系数r≥0.9988;该方法加标回收率在98.2%~101.2%之间,RSD在3.4%~5.4%之间。该方法灵敏、结果可靠。
高效液相色谱;荧光检测;蜂蜜;还原糖
蜂蜜是蜜蜂采集植物花蜜、分泌物或蜜露,与自身分泌物结合后,在巢脾内转化、脱水贮存至成熟而成的天然甜物质[1-2]。蜂蜜中含有超过180种活性物质,其主要成分为果糖和葡萄糖及4%~5%的低聚果糖,另外蜂蜜中还含有丰富的氨基酸、维生素、活性酶、类黄酮、多酚类、类胡萝卜素等活性物质及多种矿物质[3]。蜂蜜具有抗氧化、抗菌、加速创伤修复、增强免疫力等多种生理活性[4-6],因而蜂蜜不但被作为一种直接有效的营养补充来源,而且被应用于治疗肝炎、癌症、伤口感染、便秘以及改善胃肠功能、提高机体免疫力等[7-8]。近年来,蜂蜜作为一种药食两用的天然保健品,受到越来越多的青睐。
我国是养蜂及蜂蜜出口大国,20世纪90年代我国蜂蜜出口量占世界年贸易量的40%。然而,蜂蜜是一种极易掺假的食品,近年来由于掺假等质量问题,使我国蜂蜜产品的信誉越来越低,出口量逐年下降[9]。为了规范蜂蜜市场,国家标准化委员会于2005年10月26日发布了GB 18796—2005《蜂蜜》国家强制性标准,并规定自2006年3月1日起实施。GB 18796—2005规定蜂蜜中果糖和葡萄糖含量应大于等于60%,而欧盟、日本等蜂蜜进口国还规定了蜂蜜中还原糖含量及果葡比等参数。因此,必须建立一系列蜂蜜中还原糖的测定方法,既可以保护消费者利益,又对蜂蜜生产企业的生产具有指导意义。
目前,关于蜂蜜中还原糖测定的方法主要有滴定法、旋光法、薄层色谱、高效液相色谱法、离子色谱脉冲安培法、气质联用法、高效毛细管电泳法、核磁共振法等[10-17]。但是传统的滴定法、薄层色谱法、旋光度法操作繁琐而且准确度不高。高效液相色谱法采用示差折光检测器或蒸发光散射检测器,灵敏度较低,且受温度、流动相影响大。离子色谱脉冲安培法用于单糖、二糖、小分子寡糖的测定,具有灵敏度高、选择性好、不用衍生、操作简便等有点。但是,离子色谱对试剂、进样样品要求较高,样品前处理步骤要求严格,而且需要专门的离子色谱和脉冲安培检测器[18]。毛细管电泳、气质联用、核磁共振等方法设备昂贵,不易在国内中小型蜂蜜生产企业内普及。本实验采用柱前衍生高效液相色谱-荧光检测法,旨在建立一种同时测定蜂蜜中的果糖、葡萄糖、麦芽糖的方法。
1 材料与方法
1.1 试剂与仪器
对氨基苯甲酸 上海化学试剂供应站试剂厂;氰基硼氢化钠 德国Emerck公司; 果糖(99%)、葡萄糖(99%)、麦芽糖(99%) 上海化学试剂公司;甲醇、乙腈、冰乙酸(均为色谱纯) 天津市光复精细化工研究所;磷酸氢二钠、磷酸(均为分析纯) 天津市科密欧化学试剂开发中心;超纯水。
LC-10AVP Plus高效液相色谱仪(配有RF-10AXL荧光检测器、DGU-20A3在线脱气机、LC-20ATXL泵、CTO-10ASVP柱温箱、手动进样器、LC-Solution数据处理软件)和AUY220型分析天平 日本岛津公司;DZKW-D-2型恒温水浴锅 北京市永光明医疗仪器厂。
1.2 标准液的配制
1.2.1 果糖、葡萄糖、麦芽糖标准液的配制
分别准确称取3g果糖、2.4g葡萄糖、0.24g麦芽糖标准物质置于3个100mL的容量瓶中,用超纯水定容,4℃保存。
1.2.2 混合标准液的配制
分别吸取1.2.1节中各单糖标准液1mL,充分混匀,待衍生化。
1.3 样品处理
准确称取2g蜂蜜置于100mL的烧杯中,加入30mL超纯水,使样品完全溶解,转移至100mL的容量瓶中,然后用超纯水润洗定容,混匀,待衍生化。
1.4 衍生剂的配制
称取0.7g对氨基苯甲酸、1g冰乙酸、0.1g氰基硼氢化钠于具塞试管中,以10mL甲醇定容,4℃保存。
1.5 衍生化反应条件
取50μL单糖标准液、混合标准液或样品溶液,加入100μL衍生剂,充分混匀,于70℃恒温水浴中衍生[19],60min后,冷却定容至2mL。分别稀释不同的倍数,以0.45μm的微孔滤膜过滤后进样。
1.6 色谱条件
色谱柱:Sinochrom ODS-BP柱(4.6mm×250mm,5μm);流动相:0.1mol/L磷酸盐缓冲液(20mmol/L四丁基硫酸氢铵,pH2.5)∶乙腈=95∶5;流速:0.5mL/min;荧光检测波长:λex为313nm,λex为358nm;柱温:30℃;进样量:20μL。
2 结果与分析
2.1 衍生化反应条件优化结果
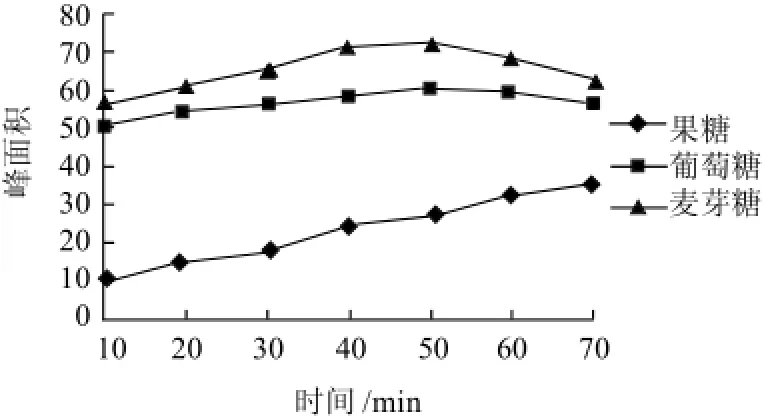
图1 衍生物的峰面积随反应时间的变化曲线Fig.1 Effect of reaction time on derivative peak area
从图1可以看出,在50min内葡萄糖和麦芽糖衍生化产物产率达到最高,50min后葡萄糖和麦芽糖衍生化产物产率开始降低,而果糖衍生化产物产率在60min后达到最高值。由此可见果糖对衍生化试剂对氨基苯甲酸反应不敏感,产物产率较低,为了提高果糖衍生化产物产率,从而增加果糖测定的灵敏度。采用文献[19]中衍生化反应温度,本研究选择反应温度70℃,反应时间60min为衍生化反应条件。
2.2 色谱条件优化结果
由于单糖为高度亲水性化合物,在C18柱上保留时间较短且不能得到较好的分离,高效液相色谱法分析糖类物质时一般需专用的氨基柱。通过衍生化可以改变单糖的局部结构,有助于单糖在C18柱上保留和分离。实验中考察了Sinochrom ODS-BP柱、SHIMADZU VP-ODS C18柱(4.6mm×150mm,5μm)为分离色谱柱对蜂蜜中单糖的分离效果。结果表明,Sinochrom ODS-BP柱能将3中还原糖很好的分离,这可能是因为Sinochrom ODSBP柱更适合分离极性较强的化合物,因此选择Sinochrom ODS-BP柱为该方法的分离色谱柱。

图2 磷酸盐缓冲液-乙腈(90∶10)作为流动相时混合标样(A)和蜂蜜中还原糖(B)色谱图Fig.2 HPLC chromatogram of mixed monosaccharide standards and reducing sugars in honey using 0.1 mol/L phosphate buffer solution-acetonitrile at 90∶10 as mobile phase
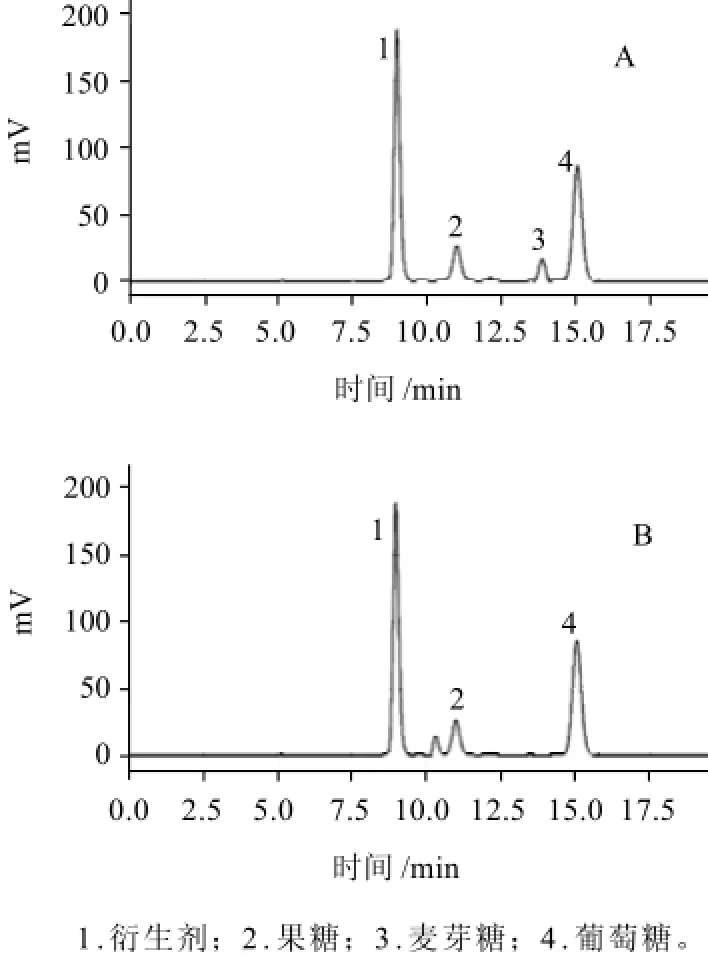
图3 磷酸盐缓冲液-乙腈(95∶5)作为流动相时混合标样(A)和蜂蜜中还原糖(B)色谱图Fig.3 HPLC chromatogram of mixed monosaccharide standards and reducing sugars in honey using 0.1 mol/L phosphate buffer solution-acetonitrile at 95∶5 as mobile phase
以含有20mmol/L四丁基硫酸氢铵的磷酸盐缓冲液-乙腈体系作为流动相,考察不同配比磷酸盐缓冲液-乙腈体系对单糖的分离情况。以磷酸盐缓冲液-乙腈(90∶10)作为流动相时混合标样中各单糖组分得到较好的分离,但是蜂蜜中果糖色谱峰前有一杂峰,且分离效果不好,结果见图2。因此,适当减少流动相中乙腈的含量,以磷酸盐缓冲液(20mmol/L四丁基硫酸氢铵,pH2.5)-乙腈(95∶5)作为流动相时混合标样和蜂蜜中各单糖组分均得到较好的分离,且峰形对称,结果见图3。
2.3 方法的线性范围和检出限
将1.5节中衍生化反应后单糖的混合标准液稀释成一些列不同质量浓度的标准工作液,在以上优化后的高效液相条件下分析。以标准峰面积对标准工作液的浓度进行线性回归,得到3种单糖的线性回归方程和相关系数。同时,使用标准溶液逐步稀释法测得3种单糖的检出限(以RSN=3计),结果见表1。
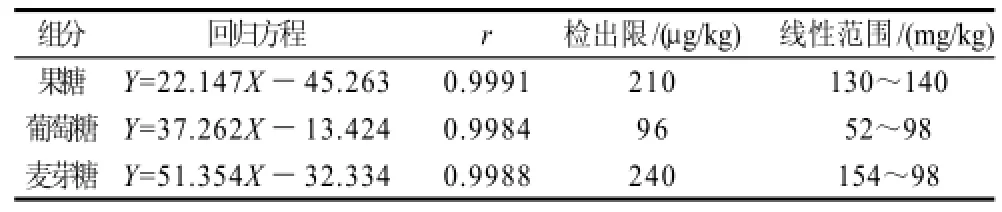
表1 回归方程、相关系数、检出限及线性范围Table 1 Regression equations, correlation coefficients, detection limits and linear ranges
2.4 方法的精密度和回收率实验
在上述优化好的色谱条件下,分别在蜂蜜测试样品中添加标样,进行添加回收率和精密度实验,其测试回收率均在98.2%~101.2%之间,重复测定7次,计算各组分相对标准偏差(RSD)在3.4%~5.4%之间(表2)。结果表明,该方法精密度较高,能够满足实际样品的测定。

表2 方法加标回收率和精密度实验(n=7)Table 2 Spike recoveries and precise RSDs of fructose, glucose, and maltose in honey (n=7)
2.5 蜂蜜中单糖含量测定结果
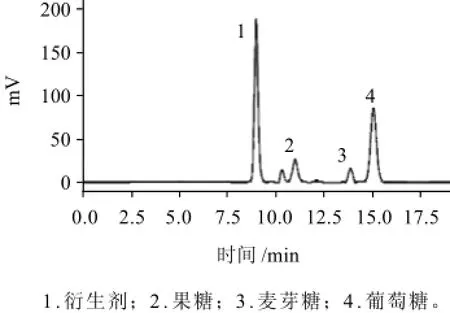
图4 洋槐蜜中还原糖色谱图Fig.4 HPLC chromatogram of reducing sugars in robinia honey
以优化条件对5种蜂蜜样品进行分析,分离效果较好,结果如图4(以洋槐蜜为例)所示。将样品测定的单糖峰面积代入上述回归方程,计算出各种单糖的含量,结果见表3。
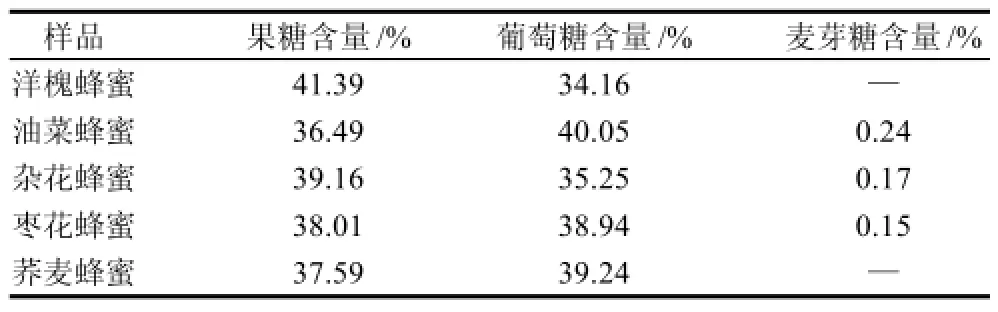
表3 蜂蜜样品中糖含量的测定结果Table 3 Fructose, glucose, and maltose contents in real honey samples
3 结 论
荧光检测器具有灵敏度高、选择性高、线性范围宽、受外界条件影响小等优点,因而在药物和生化分析中起着不可替代的作用。但是单糖本身并不带有荧光基团,而且在C18柱上保留时间短,不容易分离。对单糖进行衍生化处理后,可以使其带上荧光基团,便于荧光检测。同时,经过衍生化改变了单糖分子的局部结构,使其在C18柱上获得较好的保留和分离。本实验以对氨基苯甲酸为衍生化试剂对蜂蜜中的还原糖进行衍生化处理后,以0.1mol/L磷酸盐缓冲液(20mmol/L四丁基硫酸氢铵,pH2.5)∶乙腈=95∶5为流动相,荧光检测器测定蜂蜜中的3种还原糖,检出限分别为果糖210μg/kg、葡萄糖96μg/kg、麦芽糖240μg/kg。本方法的局限性:由于对氨基苯甲酸只能与还原糖反应,因此本方法不能测定蜂蜜中的蔗糖等非还原糖。
[1]OLAITAN P B, ADELEKE O E, OLA I O. Honey∶ a reservoir for microorganisms and an inhibitory agent for microbes[J]. African Health Sciences, 2007, 7(3)∶ 159-165.
[2]中国国家标准化管理委员会. GB 18796—2005 蜜蜂[S]. 北京∶ 中国标准出版社, 2005.
[3]EZZ EL-ARAB A M, GIRGIS S M, HEGAZY E M, et al. Effect of dietary honey on intestinal microflora and toxicity of mycotoxins in mice[J]. BMC Complementary and Alternative Medicine, 2006, 6(1)∶ 6.
[4]HEGAZI A G, ABD EL-HADY F K. Influence of honey on the suppression of human low density lipoprotein (LDL) peroxidation (in vitro)[J]. Evid Based Complement Alternat Med, 2009, 6(1)∶ 113-121.
[5]SIMON A, TRAYNOR K, SANTOS K, et al. Medical honey for wound care-still the Latest Resort ?[J]. Evid Based Complement Alternat Med, 2009, 6(2)∶ 165-173.
[6]TAN H T, RAHMAN R A, GAN S H, et al. The antibacterial properties of Malaysian tualang honey against wound and enteric microorganisms in comparison to manuka honey[J]. BMC Complementary and Alternative Medicine, 2009, 9(34)∶ 34-42.
[7]史伯伦. 蜂产品与人类健康[J]. 蜜蜂杂志, 2005, 25(6)∶ 12-13.
[8]CHEPULIS L M. The Effect of honey compared to sucrose, mixed sugars, and a sugar-free diet on weight gain in young rats[J]. Journal of Food Science, 2007, 72(3)∶ 224-229.
[9]朱青, 王毕妮, 梁艳, 等. 蜂蜜掺假检测方法的研究进展[J]. 中国蜂业, 2008, 59(10)∶ 35-37.
[10]史琦云, 贠建民. 旋光法检验蜂蜜中掺入糖类的研究[J]. 食品科学, 2003, 24(9)∶ 111-114.
[11]杨景芝, 孙衍华, 张杰道, 等. 蜂蜜中糖的薄层展开剂的研究与应用[J]. 色谱, 2003, 21(4)∶ 427-429.
[12]田艳玲, 王浩, 张曼玲, 等. 高效液相色谱法与化学法测定蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的比较与研究[J]. 食品研究与开发, 2008, 29(8)∶ 126-129.
[13]张英, 石雪萍, 张卫明. HPLC-ELSD法与HPLC-RID法检测蜂蜜中糖分的比较[J]. 中国野生植物资源, 2009, 28(1)∶ 43-47.
[14]林雁飞, 何进, 操丽丽, 等. 高效毛细管电泳法测定蜂蜜中的多种糖[J]. 分析测试学报, 2005, 24(4)∶ 74-76.
[15]秦皇岛出入境检验检疫局. GB/T 18932.22—2003蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的测定方法∶ 液相色谱示差折光检测法[S]. 北京∶ 中国标准出版社, 2003.
[16]阎政礼, 杨明生, 李添宝, 等. 蜂蜜中葡萄糖、果糖、和蔗糖NMR定量分析研究[J]. 食品科学, 2009, 30(14)∶ 253-255.
[17]崔鹤, 李戈, 纪雷, 等. 离子色谱脉冲安培法测定蜂蜜中的葡萄糖、果糖、蔗糖[J]. 化学分析计量, 2001(1)∶ 25-26.
[18]刘婷. 多糖类物质的离子色谱检测技术研究[D]. 重庆∶ 西南大学, 2009.
[19]郝桂堂, 陈尚卫, 朱松, 等. 对氨基苯甲酸衍生化高效液相色谱法分析多糖中的单糖及糖醛酸组成[J]. 色谱, 2007, 25(1)∶ 75-79.
Determination of Fructose, Glucose, and Maltose in Honey by HPLC-FLD
ZHANG Qi-an1,WANG Juan2,DAI Jian-xiao1,DU Pei-fen1,WANG Su-qing1,LU De-mei3,YANG Shao-bo1,*
(1. Shandong Huakang Honey Products Co. Ltd., Rizhao 276500, China;2. Shandong Vocational College of Water Conservancy, Rizhao 276826, China;3. Xianyang Jiankang Honey Products Co. Ltd., Xianyang 713400, China )
An ion-pair reversed-phase high performance liquid chromatographic method was developed to simultaneous determine fructose, glucose, and maltose in honey using p-aminobenzoic acid (p-AMBA) for pre-column derivatization. The chromatographic separation was achieved on an ODS column using a mobile phase made up of 0.1 mol/L phosphate buffer solution (20 mmol/L tetrabutylammoniumhydrogen sulfate, pH 2.5) and acetonitrile (95∶5, V/V). The analytes were detected using a fluorescence detector and quantified by external standard method. The results showed that the detection limits of fructose, glucose and maltose were 210, 96μg/kg and 240μg/kg, respectively, and the linear ranges were 130 -140, 52-98 mg/kg, and 154-98 mg/kg (r > 0.9988). The spike recoveries ranged from 98.2% to 101.2%, with RSDs between 3.4% and 5.4%.
high performance liquid chromatographic;fluorescence detection;honey;reducing sugars
R155.5
A
1002-6630(2011)14-0249-04
2010-09-09
张其安(1966—),男,会计师,本科,研究方向为蜂产品加工与检测。E-mail:sdhkfy@126.com
*通信作者:杨少波(1978—),男,助理工程师,硕士,研究方向为蜂产品加工与检测。E-mail:shboyg@126.com

