由马铃薯淀粉制得磷酸寡糖的定性定量测定
杨 丽,杨文军,刘 霞,杜先锋*
(安徽农业大学茶与食品科技学院,安徽 合肥 230036)
由马铃薯淀粉制得磷酸寡糖的定性定量测定
杨 丽,杨文军,刘 霞,杜先锋*
(安徽农业大学茶与食品科技学院,安徽 合肥 230036)
对以马铃薯淀粉为原料、全酶法制得的磷酸寡糖进行定性定量分析。通过采用薄层层析法(thin layer chromatography,TLC)和高效阴离子交换色谱-脉冲安培检测(high-performance anionic exchange chromatography-air pulsing ampere detectors,HPAEC-PAD)对磷酸寡糖组分进行检测分析,同时利用红外吸收光谱(infrared spectroscopy,IR)对其进行结构分析。结果表明:磷酸寡糖是结合有磷酸基团的并且聚合度在3~7之间的麦芽低聚糖混合物,以麦芽三糖至麦芽六糖组分居多。
磷酸寡糖;薄层层析法;高效阴离子交换色谱-脉冲安培检测;红外吸收光谱
寡糖又称低聚糖的概念是Helgerich于1930年首先提出的[1]。它们通常指由2~10个单糖通过糖苷键连接形成的具有直链或支链的低度聚合糖类,一般以还原端的糖命名,如麦芽寡糖、寡果糖、寡木糖、纤维寡糖等[2]。根据寡糖的生物学功能可将其分为功能性寡糖和普通寡糖两大类。功能性寡糖通常不被胃酸及人体酶所水解,不能被人体肠道所利用。与一般的低聚糖相比,功能性低聚糖具有如促进双歧杆菌增殖、抑制体内毒素生成,调节肠胃功能、抗衰老、防止胆固醇积累、降低血压等独特的生理功能,是功能性食品开发和研究的重点[3-5]。
磷酸寡糖(phosphoryl oligosaccharides,POs)是指从马铃薯淀粉水解产物中分离得到的分子中带有磷酸酯键(C—O—P),且聚合度在3~6之间的麦芽寡糖的混合物。其具有促进体内钙、铁等矿物质吸收和溶解、抗龋齿、抗淀粉老化等独特的功能特性。此外,将磷酸寡糖可添加到液体或粉末状肥料及药剂中,还可起到保持植物如水果和切花的保质期的作用,是应用安全、广泛的新型功能性低聚糖[6]。磷酸寡糖的概念最早是由日本学者Kamasaka等于1995年提出的,目前日本已有磷酸寡糖的商业化产品问市[7],而我国对其重视较晚,当前对其生产制备研究尚属空白,因此,完善制备磷酸寡糖的相关理论研究,具有重要的现实意义。
磷酸寡糖是从天然的马铃薯淀粉水解液中分离出来的,具有含量低、成分复杂、纯化难度大的特点,给磷酸寡糖的定性定量分析带来了一定的难度。由于目前未有磷酸寡糖标准品面市,所以无法直接对其进行定性定量分析,只能采用碱性磷酸酯酶对磷酸寡糖进行脱磷酸根处理之后,使其转化为麦芽低聚糖,与麦芽低聚糖标准品作为对照,采用低聚糖类通用的分析和检测方法对其进行分析测定。利用薄层层析法和高效阴离子交换色谱-脉冲安培检测器(high-performance anionic exchange chromatography-air pulsing ampere detectors,HPAEC-PAD)对其进行组分分析,同时采用红外吸收光谱(infrared spectroscopy,IR)对其进行结构分析,为进一步探讨磷酸寡糖的功能、制备及研究提供参考。
1 材料与方法
1.1 材料与试剂
磷酸寡糖样品(以马铃薯淀粉为原料制备方法参见文献[8]) 安徽农业大学磷酸寡糖课题组;色谱级葡萄糖(G1)、麦芽糖(G2)、麦芽三糖(G3)、麦芽四糖(G4)、麦芽五糖(G5)、麦芽六糖(G6)、麦芽七糖(G7)标准品 美国Sigma公司;其他试剂均为市售分析纯。
1.2 仪器与设备
ICS-3000高效阴离子交换色谱仪(脉冲安培检测器)美国Dionex公司;NEXUS-870傅里叶红外光谱仪 美国尼高力仪器公司。
1.3 方法
1.3.1 磷酸寡糖的薄层层析[9-10]
将高效薄层层析硅胶板置于110℃干燥箱内活化30min,保证胶板干燥,之后使用夹子轻轻夹出,即可点样使用。以葡萄糖、麦芽低聚糖(DP2~7)做为标准品,磷酸寡糖做为样液,质量浓度为0.4g/100mL,点样量为2μL。于活化后的硅胶板上点样,吹干后放入经展开剂饱和的层析缸中展开。当溶剂前沿到达距胶版上端大约1cm处,停止展开。取出硅胶板,用吹风机吹干,喷显色剂于硅胶板上,并在110℃条件下加热10min使其充分显色,观察分离效果。根据斑点的颜色和面积粗略判断各组分糖的含量。
1.3.2 磷酸寡糖的结构分析[11]
红外吸收光谱分析依据的信息主要是分子内部原子间的相对振动(分子振动),以及分子转动的特征信息。在化合物红外光谱图上,吸收峰越大,说明化合物对这区域光吸收越强。而对每一个化合物来说,在哪些波数可产生吸收峰是与其化学结构,特别是官能团密切相关的[12]。通过化合物的红外光谱图,确定含哪些官能团,进一步确定化学结构。
取冻干的磷酸寡糖样品,通过溴化钾压片法进行红外光谱分析。通过红外光谱图中糖类物质和磷酯键的特征吸收峰,对磷酸寡糖的化学结构进行分析。
1.3.3 磷酸寡糖的组分分析
1.3.3.1 磷酸寡糖的脱磷处理[13]
由于磷酸寡糖分子中结合有磷酸基团,影响磷酸寡糖的定性分析,因此,在进行组分分析前需将磷酸基团除去。使用碱性磷酸酯酶在一定条件下,可以水解磷酸寡糖上的酯键,条件温和,糖不被破坏。
酶切条件:磷酸寡糖粗品400μL,含有10mmol/L MgCl2的Tris-HCl缓冲液(pH9.0) 90μL,0.4U/μL的碱性磷酸酯酶10μL,37℃条件下反应36h。反应结束后置于超滤离心管(3kD)中,6000r/min离心20min,去除碱性磷酸酯酶。
1.3.3.2 高效阴离子交换色谱定性分析磷酸寡糖[14-16]
标准品配制:G1~G7标准品各10.0mg,用超纯水分别溶解定容至10mL,配制成1mg/mL的储备液。分别吸取G1~G7的储备液0.1、0.1、0.2、0.3、0.4、0.5、1.0mL定容至10mL配制成麦芽低聚糖标准混合使用液。经用0.22μm的水系滤膜过滤后进样。
样品检测:取制备的磷酸寡糖粗品,用去离子水稀释至10μg/mL,经0.22μm水系滤膜过滤后进样。
2 结果与分析
2.1 磷酸寡糖薄层层析
2.1.1 展开剂的选择
分别采用以下展开剂:乙酸乙酯-吡啶-水(5:20:7)、乙酸乙酯-甲醇-水-氨水(5:9:1:1.5)、正丁醇-乙酸-水(3:1:1)3种对磷酸寡糖进行展开,点样量为2μL,均以苯胺-二苯胺-磷酸为显色剂比较不同展开剂对磷酸寡糖的层析效果。3种展开剂对磷酸寡糖的层析结果如表1所示。
由表1可以看出,展开剂Ⅱ展开效果最佳,展开剂Ⅰ、Ⅲ均不能将糖样充分展开,因此,本实验优选正丁醇-乙酸-水做为磷酸寡糖中糖组分的薄层鉴定展开剂。

表1 不同展开剂对磷酸寡糖的展开效果对照表Table 1 Comparison of separation results of phosphorylated sligosaccharides with different developing solvents
2.1.2 显色剂的选择
通过除蛋白前后香水莲花多糖溶液蛋白质和多糖含量的测定,比较3种方法的除蛋白效果。如图3,TCA法蛋白质清除效果最佳,可达70.49%,多糖损失率最少为29.24%,该方法结果稳定,操作简单,能够在除蛋白的过程中更好的保证多糖的活性; TCA-Sevage法次之; Sevage法除蛋白仅为14.31%,而多糖损失率最高,相较于其他2种方法,该方法虽然条件温和,可以减少多糖的降解,但需要消耗大量有机试剂,操作繁琐,效率低,难以清除与多糖紧密结合或被多糖包裹的蛋白质。
实验选择了两种显色剂,分别是显色剂Ⅰ(苯胺-二苯胺-磷酸)和显色剂Ⅱ(10%硫酸-乙醇溶液),比照层析谱图效果确定最佳显色剂。结果显示,以10%硫酸-乙醇溶液显色背景干扰大,对磷酸寡糖显色效果较差,样斑为黑色或棕色,原因可能是硫酸的存在使糖样炭化所致。而苯胺-二苯胺-磷酸显色灵敏度好,背景干扰小,样斑清晰呈浅紫色。所以优选苯胺-二苯胺-磷酸做为实验中的最佳显色剂。
2.1.3 磷酸寡糖的薄层层析
将标准品(G1~G7)和磷酸寡糖样品于同一硅胶板上进行薄层层析分析,展开显色后结果如图1所示。

图1 标准品及磷酸寡糖的薄层层析图Fig.1 Thin layer chromatographic patterns of phosphorylated sligosaccharide standard and sample
由图1可以看出,各样点在硅胶板上展开和显色效果相对较好,斑点清晰呈浅紫色,背景干扰小。标样和1、2样点中G6、G7两点没有展开,可能是由于糖分子质量太大,展开剂极性不够大;1、2样谱带中其各个显色点对应于标样均显滞后,可能是由于其结合磷酸根使分子质量增大的缘故。其中麦芽三糖至麦芽六糖斑点面积大、颜色深,说明马铃薯淀粉中磷酸寡糖的糖组分主要为麦芽三糖至麦芽六糖。由此可以推断出实验所制备的磷酸寡糖样品是含有结合有磷酸根的G2~G7这几种糖组分。
2.2 磷酸寡糖的结构分析
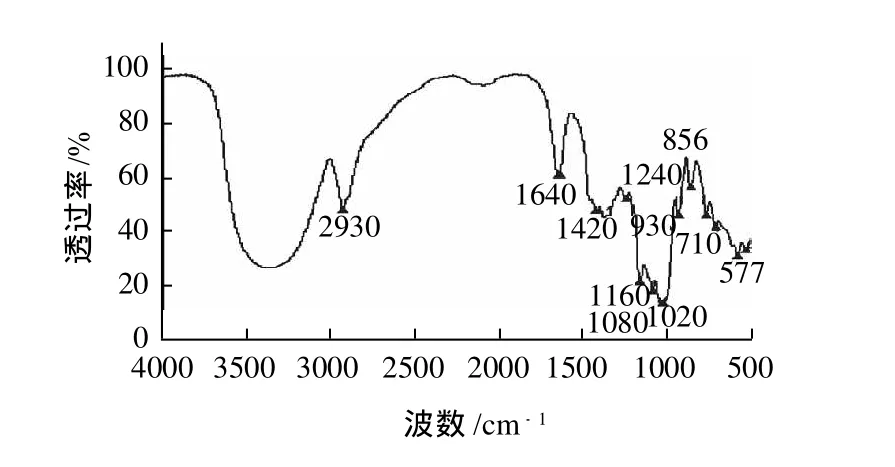
图2 磷酸寡糖红外光谱图Fig.2 Infrared spectra of phosphorylated oligosaccharide sample
将冷冻干燥得到的粉末状磷酸寡糖样品进行红外光谱溴化钾压片法分析。当样品受到频率连续变化的红外光照射时,分子吸收了某些频率的辐射,引起偶极矩的净变化,能级从基态跃迁到激发态,而相应于这些吸收区域的透射光强度减弱。记录波数或波长与红外光的百分透射比关系的曲线,得到图2所示的红外光谱图。
根据红外光谱图(图2)分析表明:在3000~2800cm-1区域内有糖类物质的特征吸收峰,2930cm-1是次甲基(—CH2—)中C—H伸缩振动的吸收峰,1420cm-1处是羰基的C=O伸缩振动引起的吸收峰,764cm-1处是D-葡萄吡喃糖环C—O—C振动吸收峰。1080cm-1处有P—O—C基团的伸缩振动吸收峰,930cm-1处有五价磷的P—O伸展振动。由此,可进一步确定磷酸寡糖为结合有磷酸基团的麦芽低聚糖混合物。
2.3 HPAEC-PAD分析磷酸寡糖的组分
根据1.3.3节方法将麦警芽低聚标准品、未脱磷的磷酸寡糖样品(POS)、脱磷的磷酸寡糖样品(de-POS)分别进行HPAEC-PAD色谱分析,结果见图3~5所示。

图3 麦芽低聚糖标准品HPAEC-PAD色谱图Fig.3 HPAEC-PAD chromatography of authentic maltooligosaccharides
由图3可以看出,采用CarboPac PA-200(3mm× 250mm)分析柱,100mmol/L氢氧化钠和1mol/L乙酸钠溶液梯度洗脱,可将低聚糖很好的分离开来,G1~G7在4~65min之间依次出峰。
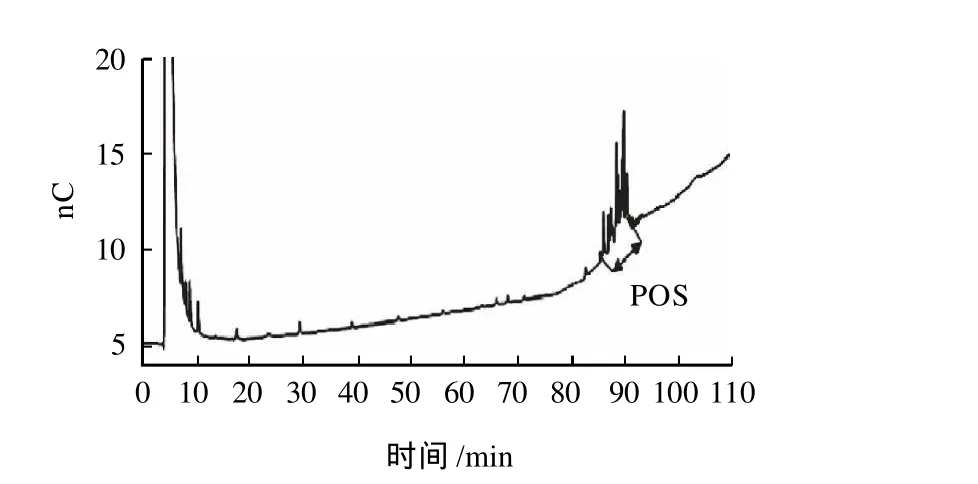
图4 磷酸寡糖样品HPAEC-PAD色谱图Fig.4 HPAEC chromatography of phosphorylated oligosaccharide samples
由图4可知,由于磷酸寡糖分子中葡萄糖残基上结合有磷酸基团,带有负电荷,因此,相对于中性糖,它的出峰时间向后延迟。可以看出,在85~95min之间有系列特征峰出现,而在4~65min之间没有麦芽低聚糖特征峰出现,因此,推断该系列特征峰为磷酸寡糖。

图5 脱磷的磷酸寡糖样品HPAEC-PAD色谱图Fig.5 HPAEC chromatography of dephosphorylated oligosaccharide sample
从图5可以看出,在85~95min之间没有如图3中所出现的系列峰,说明脱磷酸基团后破坏了该物质的存在,且与图3对比发现,在4~65min之间出现了麦芽低聚糖特征峰,包含G1~G7。通过表2对比麦芽低聚糖标准品与de-POS的保留时间,可以看出各组分的保留时间误差均在1min以内,相对误差小于1.9%。由此可以判定本实验中制备得到的磷酸寡糖为聚合度在3~7之间的麦芽低聚糖混合物。价磷的P—O伸展振动。由此判定本实验所制备的样品为结合有磷酸基团的麦芽低聚糖混合物——磷酸寡糖。3.3 由于磷酸寡糖是一种新型功能性低聚糖,且是一种混合物,目前市场上尚未见磷酸寡糖的标准品销售,直接对磷酸寡糖进行相关的定性定量分析存在一定困难。因此,实验中只能以麦芽低聚糖标准品为对照,采用HPAEC-PAD法对磷酸寡糖进行组分分析。由于分子中磷酸基团的作用,磷酸寡糖的保留时间延长,出峰时间向后延迟,对比脱磷后的磷酸寡糖与麦芽低聚糖标准品的保留时间,确定其主要组分为麦芽三糖、麦芽四糖、麦芽五糖、麦芽六糖、麦芽七糖。

表2 de-POS与麦芽低聚糖标准品的保留时间对照表Table 2 Retention times of authentic maltooligosaccarides and dephosphorylated oligosaccharides
3 结 论
3.1 实验结果表明采用展开剂正丁醇-乙酸-水(3:1:1),显色剂苯胺-二苯胺-磷酸,点样量为2μL,点样原点直径小于2mm时,各样点在硅胶板上展开和显色效果相对较好,可将麦芽糖至麦芽七糖各组分分开,通过与麦芽低聚糖标准品对照,可以推断出磷酸寡糖含有结合有磷酸根的G2~G7这几种糖组分。
3.2 红外光谱溴化钾压片法结果表明:样品在1080cm-1处有P—O—C基团的伸缩振动吸收峰,928cm-1处有五
[1]文建平. 我国寡糖产业透视[J]. 生物技术世界, 2005(2): 66-68.
[2]倪红, 杨艳燕, 阎达中. 寡糖的开发现状及其应用研究进展[J]. 湖北大学学报, 2003, 25(2): 148-151.
[3]LYONS T P, JACQUES K A, NOTTINGHAM A. Competitive exclusion of salmonella using bacterial cultures and oligosaccharides[C]. Stamford, UK: Alltech, 1995: 383-388.
[4]BROCK A W, VANDEN M H. Development of the functional food market in Japan[M]. Toyota: Bureau Landbouwraad Press, 1992: 45-50.
[5]胡学智. 功能性低聚糖的研究开发[J]. 中国食物与营养, 2000, 5(1): 39-41.
[6]KAMASAKA H, TO-O K, KUSAKA K, et al. The Structures of phosphoryl oligosaccharides prepared from potato starch[J]. Biosci Biotech Biochem, 1997, 61(2): 238-244.
[7]谷利伟, 赵金兰. 日本低聚糖开发新动态[J]. 食品与机械, 1999(2): 27-28.
[8]朱蓓蕾, 汪明春, 刘霞, 等. 马铃薯淀粉磷酸寡糖的全酶法制备及其分离[J]. 食品与发酵工业, 2009, 5(35): 74-78.
[9]房子, 刘万顺, 位晓娟, 等. 甲壳胺寡糖的液相色谱及薄层层析分析[J]. 中国海洋大学学报, 2005, 35(1): 113-115.
[10]杨雅麟, 王建华. 薄层层析法分离菊芋汁中低聚糖[J]. 理化检验: 化学分册, 2007, 43(3): 229-232.
[11]刘为伟, 罗学潭. 红外光谱分析中液体样品处理方法的探讨[J]. 湖南教育学院学报, 1994, 12(5): 178-182.
[12]贾晓春. 现代仪器分析技术及其在食品中的应用[M]. 北京: 中国轻工业出版社, 2005: 80-82.
[13]KAMASAKA H, UCHIDA M, KUSAKA K, et al. Inhibitory effect of phosphorylated oligosaccharides prepared from potato starch on the formation of calcium phosphate[J]. Biosci Biotech Biochem, 1995, 59(8): 1412-1416.
[14]牟世芬, 于泓, 蔡亚岐. 糖的高效阴离子交换色谱-脉冲安培检测法分析[J]. 色谱, 2009, 27(5): 667-674.
[15]梁立娜, 张萍, 蔡亚岐, 等. 高效阴离子交换-脉冲安培检测同时分析单糖和糖醛酸[J]. 分析化学, 2006, 34(10): 1371-1374.
[16]潘媛媛, 梁立娜, 蔡亚岐, 等. 高效阴离子交换色谱-脉冲安培检测法分析啤酒和麦汁中的糖[J]. 色谱, 2008, 26(5): 626-630.
Determination of Phosphorylated Oligosaccharides Prepared from Potato Starch
YANG Li,YANG Wen-jun,LIU Xia,DU Xian-feng*
(College of Tea & Food Science and Technology, Anhui Agricultural University, Hefei 230036, China)
The current study was carried out to quantitatively and qualitatively analyze phosphorylated sligosaccharides prepared from potato starch by totally enzymatic method. The phosphorylated sligosaccharide composition was determined by thin layer chromatography (TLC) and high performance anionic exchange chromatography with pulsed amperometric detection (HPAEC-PAD). Infrared spectroscopy (IR) was used for structure elucidation. The analytes were identified as a mixture of maltooligosaccharides containing phosphate groups and having a degree of polymerization between 3 and 7, in which maltotriose, maltotetraose, maltopentaose and maltohexaose were the dominant components.
phosphorylated oligosaccharides;thin layer chromatography (TLC);high-performance anionic exchange chromatography-air pulsing ampere detectors (HPAEC-PAD);infrared spectroscopy (IR)
TQ917
A
1002-6630(2011)14-0198-04
2010-09-30
国家“863”计划项目(2006AA10Z340)
杨丽(1985—),女,硕士研究生,研究方向为食品生物技术及农副产品深加工。E-mail:yangli5960@126.com
*通信作者:杜先锋(1963—),男,教授,博士,研究方向为天然产物及农产品加工。E-mail:dxf@ahau.edu.cn

