液相色谱-串联质谱法同时检测花生油中4种黄曲霉毒素
赵晓娟,冼燕萍,罗海英,钱 敏,白卫东,*
(1.仲恺农业工程学院轻工食品学院,广东 广州 510225;2.广州市质量监督检测研究院,广东 广州 510110)
液相色谱-串联质谱法同时检测花生油中4种黄曲霉毒素
赵晓娟1,冼燕萍2,罗海英2,钱 敏1,白卫东1,*
(1.仲恺农业工程学院轻工食品学院,广东 广州 510225;2.广州市质量监督检测研究院,广东 广州 510110)
建立同时测定花生油中4种黄曲霉毒素(包括黄曲霉毒素B1、B2、G1、G2)的液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)。该方法经甲醇-水、三氯甲烷依次提取样品,以C18柱分离,流动相为乙腈-0.1%甲酸溶液(梯度洗脱),采用电喷雾正离子多反应监测(multiple reaction monitor,MRM)模式检测。结果表明:标准曲线在0.0~20.0μg/kg进样范围内线性良好;用本法测定4种黄曲霉毒素的回收率在70.8%~108.0%(低加标水平)、82.4%~104.5%(中和高加标水平)之间,相对标准偏差在5.7%~9.7%之间。运用所建立的方法对市售19种不同品牌和批次的花生油中的黄曲霉毒素进行分析,结果显示该方法选择性强、灵敏度高,适用于花生油中4种黄曲霉毒素的定性、定量测定。
液相色谱串联质谱法(LC-MS/MS);黄曲霉毒素;花生油;多反应监测(MRM)
黄曲霉毒素(aflatoxin,AF)是黄曲霉、寄生曲霉等产生的次生代谢物[1-2],是一组化学结构类似的二氢呋喃香豆素的衍生化合物,最为重要的包括黄曲霉毒素B1、B2、G1、G2、M1、M2等,其中黄曲霉毒素M1和M2经动物代谢产生并残留于牛奶及其制品中,黄曲霉毒素B1、B2、G1和G2易污染多种农作物、食品及饲料,常存在于各种霉变的坚果特别是花生和核桃及其制品中。1993年黄曲霉毒素被世界卫生组织(world healthyorganizatiom,WHO)的癌症研究机构(international agency for research on cancer,IARC)划定为Ⅰ类致癌物。黄曲霉青毒素B1为毒性及致癌性最强的物质之一。黄曲霉毒素对人和动物健康的危害主要与其抑制蛋白质的合成有关[3],引起人的中毒表现主要是损害肝脏,发生肝炎、肝硬化、 肝坏死等。因此,世界各国对主要食品中黄曲霉毒素的总量,尤其是AFB1的含量规定了允许限量值。我国也明确规定了食品中真菌毒素的限量,其中规定玉米、花生及及其制品中AFB1的允许限量值为 20μg/kg[4]。
黄曲霉毒素在花生及粮食中广泛而微量地存在,建立准确灵敏、快速简便的检测方法是黄曲霉毒素研究的重要方面。目前,黄曲霉毒素的检测方法主要包括酶联免疫法(enzyme-linked immunosorbent assay,ELISA)等快速筛选法[5-7],薄层色谱扫描法(thin layer chromatography scan,TLCS)、高效液相色谱法(high-performance liquid chromatography,HPLC)和液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry,LCMS/MS)等确证检测法[8-13],以及免疫传感器阵列等其他新方法[14-18]。ELISA法适用于大批量样品的快速筛选,具有检测速度快、特异等优点,但缺点是检测结果易出现假阳性,且不能准确定量;薄层色谱法(TLC)是测定黄曲霉毒素的经典方法,属于定性和半定量方法,为提高薄层色谱法的精度而建立的TLCS法在确证新发现的霉菌毒素和检测方法学研究等方面曾经具有一定的优越性,但是该法操作烦琐、灵敏度低、定量不够准确,近年来应用较少;HPLC结合紫外或荧光检测器具有灵敏度高、检测限低、自动化程度高等优点,近年来在黄曲霉毒素检测中得到了广泛的应用,但该法需进行柱前或柱后衍生处理,操作繁杂,不适宜多种不同类霉菌毒素的同时检测;LC-MS/MS法是近几年兴起的新技术,能够提供结构信息,且检出限低、灵敏度高、线性范围宽、简便快捷,是多组分霉菌毒素检测的理想方法。
本研究拟建立测定花生油中4种黄曲霉毒素(包括黄曲霉毒素B1、B2、G1、G2)的LC-MS/MS法,并对方法的可靠性进行评价。运用所建立的方法对市售19种不同品牌和批次的花生油中的黄曲霉毒素进行分析。
1 材料与方法
1.1 材料与试剂
黄曲霉毒素 B1、B2、G1、G2标准品 美国 Alexis公司;甲醇、乙腈、甲酸(均为色谱纯) 美国Fisher公司;三氯甲烷、正己烷等为国产分析纯;花生油 市购。
1.2 仪器与设备
1200高效液相色谱仪 美国Agilent公司;API 4000 Q-trap三重四级杆串联质谱仪(配有电喷雾离子源(ESI) 美国ABI公司;MTN-2800W水浴氮吹仪 天津奥特赛恩斯仪器有限公司;MS3 digital涡旋振荡器 德国IKA公司。
1.3 方法
1.3.1 色谱条件
色谱柱:Waters C18柱(150mm×4.6mm,5μm);流动相:乙腈-0.1%甲酸溶液,梯度洗脱,梯度洗脱表见表1;流速:0.5mL/min;柱温:30℃;进样量:20μL。

表1 流动相梯度洗脱Table 1 Mobile phase gradients for HPLC analysis
1.3.2 质谱条件
电喷雾离子源(electrospray ionization,ESI)正离子模式;电喷雾电压5500V;离子源温度500℃;多反应监测(multiple reaction monitor,MRM),4种待测物的定性离子对和定量离子对见表2;碰撞气、雾化气、气帘气、碰撞气能量、聚焦电压和碰撞室出口电压均为最优。

表2 4种待测物的定性离子对和定量离子对Table 2 Qualitative and quantitative ion pairs and quantitative ion pairs of four aflatoxins
1.3.3 样品处理
称取1.0g花生油样品于离心管中,加入5mL正已烷溶解。再用5mL甲醇-水(55:45,V/V)萃取,4000r/min离心5min,吸取甲醇-水层至第二个离心管中,将原离心管中的样品用甲醇-水再萃取一次,合并甲醇-水于第二个离心管中。用10mL三氯甲烷萃取两次,合并三氯甲烷(20mL),置于水浴氮吹浓缩至干。用乙腈-0.1%甲酸溶液(2:8,V/V)定容至1.0mL,经0.22μm滤膜后,用于LC-MS/MS测定。
2 结果与分析
2.1 前处理方法的选择
黄曲霉毒素难溶于水,不溶于石油醚、己烷和乙醚等非极性溶剂,但易溶于甲醇、丙酮和三氯甲烷等带极性的有机溶剂。一般使用这几种有机溶剂的水溶液作为提取剂[19-20]。提取剂中的水可以增强有机溶剂在样品中的渗透能力,提高萃取效率。应根据不同食品基质的性质来选择合适的提取剂。大部分文献和标准均是使用甲醇-水或乙腈-水作为提取剂[2,11,21],但考虑到乙腈比甲醇毒性大,而且价格昂贵,故本研究选择甲醇-水作为花生油中黄曲霉毒素的提取剂。甲醇-水比例(55:45,V/V)的确定以及样品的前处理过程以文献[19]标准为基础,并经过适当的调整与优化(见1.3.3节)。
2.2 标准曲线与线性范围
取不同水平的黄曲霉毒素标准溶液,按1.3节建立的仪器条件进行LC-MS/MS测定,20.0μg/kg的标准品的提取离子流色谱图(extracted ion chromatography,XIC)如图1所示。计算不同标准水平下的峰面积,以黄曲霉毒素标准品水平/(μg/kg)为横坐标、峰面积为纵坐标绘制标准曲线。直线几乎通过原点,故通过原点进行线性回归。标准曲线在0~20.0μg/kg的进样水平范围内线性良好。线性方程及相关系数见表3。

表3 黄曲霉毒素的线性方程和相关系数Table 3 Linear regression equations and correlation coefficient of fours aflatoxins

图1 多反应监测模式下黄曲霉毒素标准品色谱图Fig.1 Ion chromatograms of four aflatoxin standards in MRM mode
2.3 加标回收率和方法精密度
取16号样品(AFB1阳性)作为代表性样品,添加低、中、高3个不同水平的混合标准溶液,按照1.3节建立的仪器条件进行加标回收率实验。每个加标水平取6个平行样,其回收率与精密度数据见表4。图2为16号样品的提取离子流色谱图,图3为16号加标样品的色谱图。

图2 16号样品的提取离子流色谱图Fig.2 Chromatograms of aflatoxins in blank sample No. 16

图3 16号加标样品的色谱图Fig.3 Chromatograms of aflatoxins in spiked
加标水平20.0μg/kg。

表4 16号样品中黄曲霉毒素的加标回收率和精密度结果(n=6)Table 4 Average recovery rates and relative standard deviations for aflatoxins in sample No. 16 spiked at 3 levels (n = 6)
从表4可以看出,用本检测方法进行加标回收实验时,在低加标水平条件下,4种黄曲霉毒素的平均回收率在70.8%~108.0%之间,相对标准偏差在8.6%~9.7%之间;在中、高加标水平下,平均回收率在82.4%~104.5%之间,相对标准偏差在5.7%~7.9%之间,表明此方法的准确度和精密度均较高。
2.4 样品测定
运用所建立的方法对市售19种不同品牌和批次的花生油中的黄曲霉毒素进行分析,检测结果见表5。
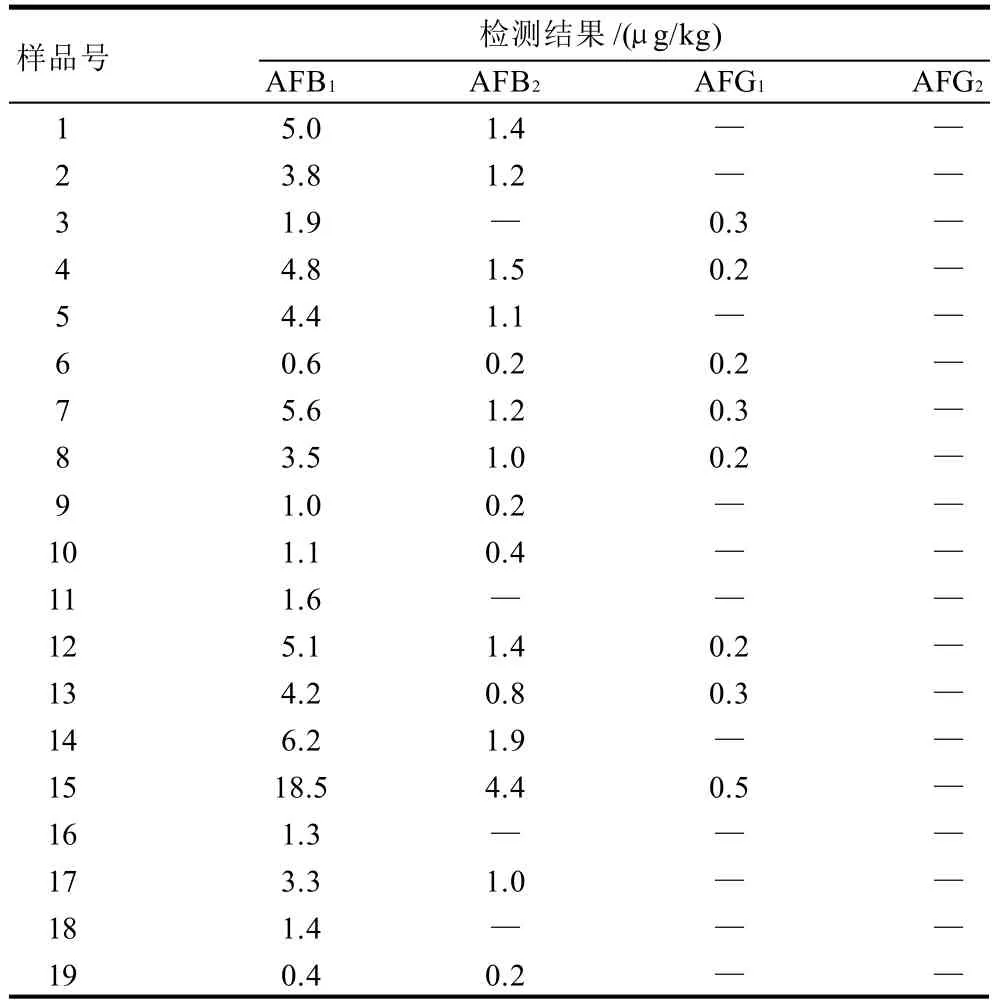
表5 花生油样品黄曲霉毒素的检测结果Table 5 Analytical results of aflatoxins in 16 commercial peanut iol sample
由表5可以看出,所有19种花生油样品均受到不同程度的黄曲霉毒素的污染,尤其是黄曲霉毒素B1的污染最为广泛,在所有样品中均有检出,其含量为0.4~18.5μg/kg。该含量值均在GB 2761—2005《食品中真菌毒素限量》规定的20μg/kg的允许限量值范围内,因此消费者可以放心食用。该检测结果表明,尽管样品中几种黄曲霉毒素的含量较低,通过本检测方法可灵敏、准确地对其含量进行定量。
3 结 论
本研究建立了同时检测花生油中4种黄曲霉毒素(AFB1、AFB2、AFG1、AFG2)含量的液相色谱-串联质谱法,并对不同品牌和批次的多种市售花生油样品进行了分析。实验结果表明,本检测方法可以实现黄曲霉毒素与样品基质的良好分离,检测灵敏度高、选择性好、结果准确,适用于花生油中4种黄曲霉毒素的定性、定量测定。
[1] 马志科, 昝林森. 黄曲霉毒素危害、检测方法及生物降解研究进展[J]. 动物医学进展, 2009, 30(9): 91-94.
[2] 王树茂. 利用高效液相色谱检测干(坚)果中的黄曲霉毒素[J]. 食品研究与开发, 2010, 31(8): 112-115.
[3] 李书国, 陈辉, 李雪梅, 等. 粮油食品中黄曲霉毒素检测方法综述[J].粮油食品科技, 2009, 17(2): 62-65.
[4] GB 2761—2005 食品中真菌毒素限量[S]. 北京: 中国标准出版社,2005.
[5] GUAN Di, LI Peiwu, ZHANG Qi, et al. An ultra-sensitive monoclonal antibody-based competitive enzyme immunoassay for aflatoxin M1in milk and infant milk products[J]. Food Chemistry, 2011, 125(4): 1359-1364.
[6] 齐惠萍, 吕建明, 李常青. ELISA 法检测食醋中黄曲霉毒素B1方法的改进[J]. 中国食品卫生杂志, 2008, 20(4): 313-315.
[7] 江涛, 柳桢, 郑佳, 等. 总黄曲霉毒素ELISA定量检测方法的研制[J]. 中国食品卫生杂志, 2006, 18(4): 292-296.
[8] HAN Zheng, ZHENG Yunliang, LUAN Lianjun, et al. An ultra-highperformance liquid chromatography-tandem mass spectrometry method for simultaneous determination of aflatoxins B1, B2, G1, G2, M1and M2in traditional Chinese medicines[J]. Analytica Chimica Acta, 2010, 664(2): 165-171.
[9] NONAKA Y, SAITO K, HANIOKA N, et al. Determination of aflatoxins in food samples by automated on-line in-tube solid-phase microextraction coupled with liquid chromatography-mass spectrometry[J]. Journal of Chromatography A, 2009, 1216(20): 4416-4422.
[10] TANAKA H, TAKINO M, SUGITA-KONISHI Y, et al. Development of a liquid chromatography/time-of-flight mass spectrometric method for the simultaneous determination of trichothecenes, zearalenone and aflatoxins in foodstuffs[J]. Rapid Communications in Mass Spectrometry,2006, 20(9): 1422-1428.
[11] 朱聪英, 应永飞, 韦敏珏, 等. 液相色谱-串联质谱法测定饲料中黄曲霉毒素的研究[J]. 质谱学报, 2010, 31(4): 240-246.
[12] 付朝晖, 黄雪祥, 闵顺耕. 超高效液相色谱法快速测定发酵茶叶中的黄曲霉毒素[J]. 分析试验室, 2009, 28(6): 112-115.
[13] MAHONEY N, MOLYNEUX R. Rapid analytical method for the determination of Aflatoxins in plant-derived dietary supplement and cosmetic oils[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7): 4065-4070.
[14] ADAYI N, LEVKOVETS I, RODRIGUEZ-GIL S, et al. Development of immunosensor based on OWLS technique for determining Aflatoxin B1and Ochratoxin A[J]. Biosensors and Bioelectronics, 2007, 22(6):797-802.
[15] ARDUINI F, ERRICO I, AMINE A, et al. Enzymatic spectrophotometric method for Aflatoxin b detection based on acetylcholinesterase inhibition[J]. Analytical Chemistry, 2007, 79(9): 3409-3415.
[16] PIERMARINI S, MICHELI L, AMMIDA N, et al. Electrochemical immunosensor array using a 96-well screen-printed microplate for Aflatoxin B1detection[J]. Biosensors and Bioelectronics, 2007, 22(7):1434-1440.
[17] 汤俊琪, 庞广昌. 免疫传感器测定食品中黄曲霉毒素的研究进展[J].食品科学, 2009, 30(17): 326-329.
[18] 孙秀兰, 汪忠云, 方银军, 等. 溶胶凝胶法固定抗体制备黄曲霉毒素免疫传感器[J]. 分析化学, 2010, 38(2): 245-248.
[19] 王娜, 潘治利, 杨君丽, 等. 花生中黄曲霉毒素检测方法的研究[J].安徽农业科学, 2008, 36(24): 10305-10306.
[20] 李军, 田苗, 于一芒, 等. 免疫亲和-光化学衍生高效液相色谱检测花生及花生制品中黄曲霉毒素[J]. 分析测试学报, 2007, 26(1): 93-96.
[21] GB/T 5009.23—2006 食品中黄曲霉毒素B1、B2、G1、G2的测定[S]. 北京: 中国标准出版社, 2006.
Simultaneous Determination of Four Aflatoxins in Peanut Oil by Liquid Chromatography-Tandem Mass Spectrometry
ZHAO Xiao-juan1,XIAN Yan-ping2,LUO Hai-ying2,QIAN Min1,BAI Wei-dong1,*
(1. College of Light Industry and Food Science, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, China;2. Guangzhou Quality Supervision and Testing Institute, Guangzhou 510110, China)
A liquid chromatography-tandem mass spectrometry (LC-MS/MS) method was established for simultaneous determination of 4 aflatoxins in peanut oil including aflatoxins B1, B2, G1 and G2. The sample preparation was achieved by sequential extraction with aqueous methanol solution and chloroform. The analytes were separated on a C18 column using a mobile phase composed of acetonitrile and 0.1% aqueous formic acid solution and detected using electrospray ionisation (ESI)-MS/MS in positive ion mode with multiple reaction monitoring (MRM). The linear range of aflatoxins determination was from 0.0 to 20.0μg/kg. The recovery rates for four aflatoxins were from 70.8% to 108.0% at 1.0μg/kg and from 82.4% to 104.5% at 10.0 and 20.0μg/kg, and the relative standard deviations from 5.7% to 9.7%. The developed method proved highly selective and sensitive in determining 19 commercial peanut oil samples, thus being suitable for qualitative and quantitative analysis of four aflatoxins in peanut oil.
liquid chromatography-tandem mass spectrometry (LC-MS/MS);aflatoxins;peanut oil;multi-reaction monitor (MRM)
TS207.3
A
1002-6630(2011)14-0194-04
2010-11-28
国家自然科学基金青年科学基金项目(21005091);粤港关键领域重点突破项目(2009A020700005)
赵晓娟(1980—),女,讲师,博士,主要从事食品添加剂与食品分析研究。E-mail:xiao0692@163.com
*通信作者:白卫东(1967—),男,教授,硕士,主要从事食品化学与食品添加剂研究。E-mail:whitebai2001@yahoo.com.cn

