低能离子注入法选育透明质酸高产菌株
张 伟,姚 俊*,陈宽婷,孙荣斌,魏钦俊,曹 新
(1.南京医科大学基础医学院生物技术系,江苏 南京 210029;2.江苏省常熟职业教育中心校旅游管理系,江苏 常熟215500;3.南京医科大学药学院,江苏 南京 210029)
低能离子注入法选育透明质酸高产菌株
张 伟1,2,姚 俊1,*,陈宽婷1,孙荣斌3,魏钦俊1,曹 新1
(1.南京医科大学基础医学院生物技术系,江苏 南京 210029;2.江苏省常熟职业教育中心校旅游管理系,江苏 常熟215500;3.南京医科大学药学院,江苏 南京 210029)
以一株兽疫链球菌(Streptococcus zooepidemicus) NN-7为出发菌株,利用30keV,剂量为8×1014N+/cm2氮离子进行诱变,筛选获得溶血素和透明质酸酶双缺陷型突变菌株,经摇瓶发酵培养筛选获得一株透明质酸高产菌株SH-9,透明质酸产量达3.23g/L,相对分子质量达2.12×106,相对于原始菌株,透明质酸产量及相对分子质量分别提高了104.4%及35.9%。6代传代实验表明诱变后得到的高产透明质酸菌株具有较好的传代稳定性。低能离子注入法可作为有效的诱变手段用于透明质酸高产菌株的选育。
透明质酸;兽疫链球菌;离子注入;诱变选育
透明质酸(hyaluronic acid,HA)是由β-D-葡萄糖醛酸和N-乙酰基-D-氨基葡萄糖交替聚合而成的酸性黏多糖,相对分子质量在2×105~7×106之间[1]。HA独特的线性分子结构和理化性质,使其具有良好的水溶性、吸水性、生物黏附性、生物相溶性、生物降解性,在工农业、食品与医药等领域极具应用潜力[2-5]。HA广泛存在于脊椎动物的结缔组织如公鸡鸡冠、脐带、眼睛的玻璃体液和皮肤中,同时也存在于链球菌的荚膜中[2]。微生物发酵法是大量获得HA的主要途径,目前筛选的HA合成菌大多是链球菌属的A群和C群,均为β溶血型,产HA也产透明质酸酶,为克服原菌株的不利因素,一般需进行育种处理才能获得溶血素和透明质酸酶双缺陷的HA高产菌株[6]。诱变剂育种由于方法简便、突变率高、成本低廉,而广泛用于HA合成菌的育种中,采用的诱变剂主要有紫外线、60Co、LiCl、硫酸二乙酯(DES)和亚硝基胍(NTG)等物理或化学诱变剂[7-9]。
近年来,离子注入技术逐渐从物质的表面修饰发展成为一种新型的生物物理诱变手段,具有以较小的生理损伤而得到较高的突变率、较广的突变谱的优点,在优良菌株的筛选、诱变效率的提高以及离子束介导外源基因的转入等方面发挥了重要的作用[10-12]。目前在HA产生菌株的诱变育种中应用低能离子注入的方式还未见报道。本实验以兽疫链球菌(Streptococcus zooepidemicus NN-7)为出发菌株,采用30keV氮离子注入法进行诱变,筛选HA高产菌株。
1 材料与方法
1.1 材料、培养基与仪器
兽疫链球菌(Streptococcus zooepidemicus NN-7)由南京医科大学生物技术实验室保藏。
马丁肉汤培养基(g/L):马丁肉汤 20、蛋白胨 5、NaCl 3、NaHCO32、Na2HPO41、葡萄糖 10、琼脂20, pH7.6;发酵培养基(g/L):葡萄糖 30、胰蛋白胨25、MgSO4·7H2O 10、MnSO40.6、K2HPO410、KH2PO410、(NH4)2SO40.6,pH7.6;筛选培养基:血琼脂平板用于非溶血性菌株筛选,在马丁肉汤培养基中加入10%脱纤维羊血;透明质酸平板用于透明质酸酶缺陷型菌株筛选,在马丁肉汤培养基中加入0.1%的透明质酸钠。
LZD900多功能离子注入机 核工业部西南物理研究院。
1.2 方法
1.2.1 诱变方法
无菌条件下挑取兽疫链球菌NN-7在生理盐水中悬浮,制成菌悬液,稀释涂布于直径为9cm的空平皿中心,使菌液形成一薄层;无菌风干后采用不同剂量的氮离子注入(能量30keV)进行辐照;辐照后用无菌棉球洗擦平皿菌层,将带菌棉球放入装有玻璃珠的无菌水试管中振荡,逐级10倍稀释后涂布于血琼脂平板培养基培养。

1.2.2 初筛方法
血溶素缺陷型:原始菌株NN-7经低能离子诱变后,在血琼脂平板培养基上培养48h,用无菌牙签挑取无溶血性的菌落接种于马丁肉汤斜面培养基保存。
透明质酸酶缺陷型:血溶性缺陷型菌株经低能离子诱变后(操作同1.2.1节),将存活菌株接种到含透明质酸钠的筛选培养基平板上,培养16h后喷洒1%十六烷基吡啶溶液,用无菌牙签挑取长势好且无混浊圈的菌落接种于马丁肉汤斜面培养基保存。
1.2.3 复筛方法
取初筛保藏的斜面,用接种环接一环菌于装有50mL液体发酵培养基的250mL三角瓶中,于37℃、250r/min发酵培养44h后测定HA产量及相对分子质量。
1.3 指标测定方法
1.3.1 HA含量的测定
将发酵液以4000r/min离心20min,取上清液1mL,加入2.5倍体积无水乙醇,混匀后置4℃冰箱中保存1h,离心收集沉淀,加入5mL蒸馏水稀释沉淀,采用Bitter-Muir咔唑法测定HA的含量[13]。
1.3.2 HA相对分子质量的测定
以0.2mol/L NaCl溶液为参比液,采用毛细管内径0.6mm的乌氏黏度计于25℃测定HA溶液的黏度,并计算其特性黏度值,再根据公式[η]=3.6×10-4Mr0.78(式中:[η]为特性黏度;Mr为相对分子质量)计算出HA的相对分子质量[14]。
2 结果与分析
2.1 离子注入剂量的选择
采用不同氮离子剂量诱变处理兽疫链球菌NN-7,方法如1.2.1节所述,考察氮离子注入剂量与供试菌株致死率的关系,结果如图1所示。

图1 N+注入辐照兽疫链球菌NN-7的存活率曲线Fig.1 Relationship between survival rate and N+implantation dose
从图1可以看出,随着N+注入剂量的增加,兽疫链球菌NN-7的存活率曲线呈先减小后增大再减小的“马鞍型”剂量-效应曲线,这是离子注入诱变所特有的诱变效应的重要表现,与一般电离辐射造成的“指数型”剂量-效应曲线不同。这是因为低剂量离子只对细胞表面进行损伤和刻蚀,随着注入剂量的增加,能量沉积所产生的大量自由基致使DNA和生物膜等其他大分子损伤,从而造成存活率急剧下降,但当剂量增加至一定阈值时,注入细胞的库仑力形成一个“保护屏障”并由此激活细胞内的修复机制和修复酶,使得存活率回升,但随着剂量继续增加,细胞损伤加剧,从而使得存活率再次下降[10-12]。
不同剂量N+注入辐照对菌株突变率和正突变率的影响如表1所示。随着剂量的增加,菌株的突变率和正突变率也随之增加,当注入剂量为8×1014N+/cm2时,菌株的正突变率最高,超过此剂量后,菌株突变率继续增加,但正突变率呈下降趋势。现代育种理论认为:被诱变的微生物致死率在75%左右时产量性状的正突变率较高,在更高的致死率条件下,突变率虽可能较高,但负突变率较之正突变率高很多,不利于正突变菌株的筛选[15]。因此根据图1和表1结果,选择剂量为8×1014N+/cm2作为HA产生菌的离子注入剂量,实验证明该注入剂量在诱变过程中较为有效。
2.2 离子注入后HA产生菌突变株的筛选

图2 突变株S-7与原始菌株的菌落形态对比Fig.2 Colony morphology of mutant strain (S-7) and original strain (blank)
菌株经离子注入后,涂布于血琼脂平板培养基上,从中筛选出溶血素缺陷型突变菌株25株,并对其进行摇瓶发酵实验进行复筛,发酵后测定HA产量及相对分子质量,11株HA产量及相对分子质量较高的菌株的实验结果见表2。经离子注入诱变后比较原始菌株和诱变菌株的菌落形态,突变株S-7于血琼脂平板培养基培养无明显的溶血圈出现(图2),且发酵合成的HA产量和相对分子质量均有较大提高,故确定S-7菌株作为下一轮注入诱变的出发菌株。
以S-7菌株为出发菌株再次进行注入诱变,系列稀释后涂布于透明质酸平板培养基上,从中筛选出透明质酸酶缺陷型突变菌株17株,并对其进行摇瓶发酵实验进行复筛,发酵后测定HA产量及相对分子质量,部分结果见表3。
对照出发菌株S-7,由表3可知,经氮离子注入诱变、透明质酸平板培养基筛选及摇瓶发酵后,有少数菌发生了负突变,不过正突变的菌株占绝大多数,其中SH-9菌株HA产量最高为3.23g/L,比原始菌株NN-7提高了104.4%,相对分子质量为2.12×106,比原始菌株NN-7提高了35.9%。
2.3 高产菌株SH-9的遗传稳定性
对SH-9菌株连续传代6次,每次均涂布于血琼脂平板培养基上培养,并分别进行摇瓶发酵后检测HA产量及相对分子质量,结果如表4所示。实验证明6次传代后突变株都无溶血圈。从传代结果可以看出,该高产HA菌株的遗传性能稳定,是一株适合HA生产要求的菌株。
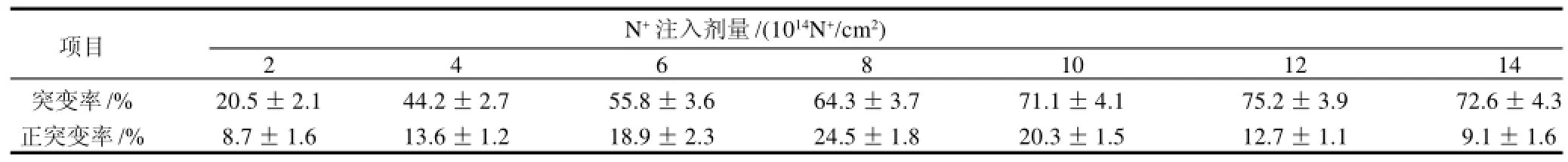
表1 N+注入辐照对菌株突变率及正突变率的影响Table 1 Effect of N+implantation on mutation rate and positive mutation rate
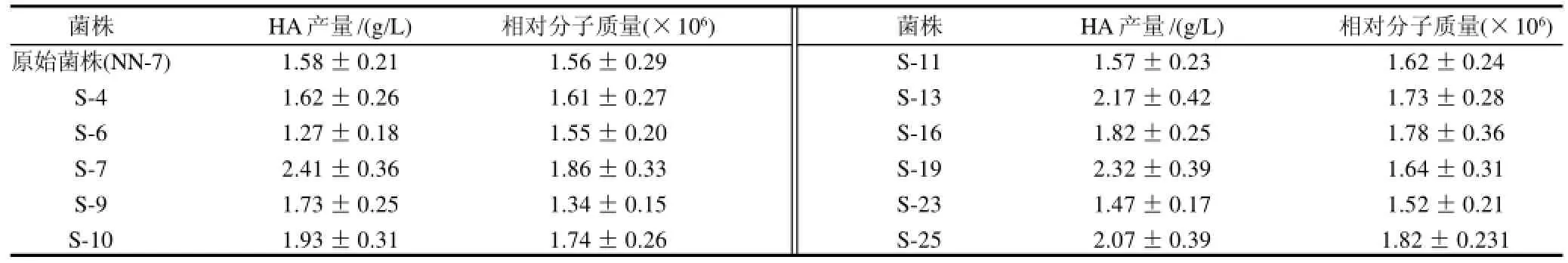
表2 经N+诱变后溶血素酶缺陷型突变株的筛选结果Table 2 Screening results of hemolysin-degrading enzyme deficient mutant strains induced by N+implantation
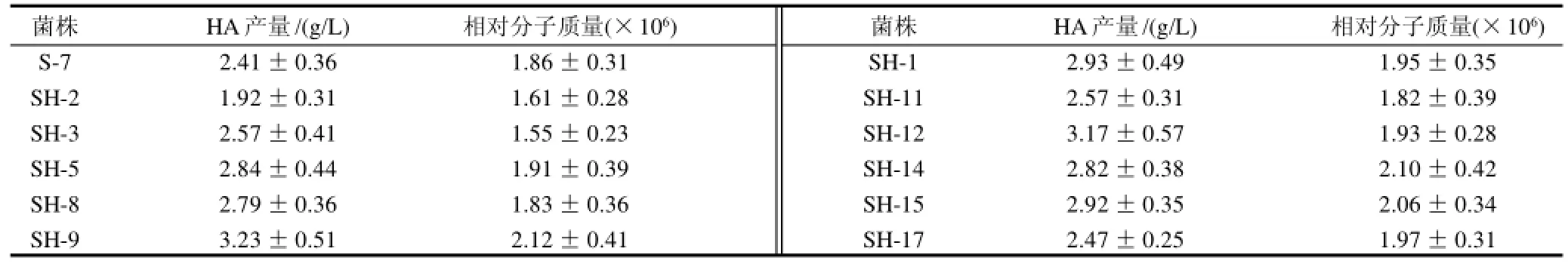
表3 经N+诱变后透明质酸酶缺陷型突变株的筛选结果Table 3 Screening results of hyaluronic acid-degrading enzyme deficient mutant strains induced by N+implantation

表4 SH-9菌株传代后HA产量及相对分子质量的变化Table 4 The yield and relative molecular weight of hyaluronic acid produced by cultured SH-9 strain
3 结 论
本实验采用低能氮离子注入的方法用于HA合成菌株的诱变选育,结果表明,不同注入剂量与菌株的死亡率存在一定的关系,随着注入剂量的增加,菌株致死率也随之增大,在剂量为8×1014N+/cm2时菌株致死率达到76%,且在血琼脂平板培养基和透明质酸平板培养基上的正突变率也较高;在经N+离子注入诱变后,筛选获得一株溶血素和透明质酸酶双缺陷型突变株SH-9;经摇瓶发酵,突变株SH-9合成的HA产量达3.23g/L,比原始菌株的合成水平提高了104.4%,HA相对分子质量为2.12×106,比原始菌株提高了35.9%,因而低能氮离子注入的方法可作为有效手段用于HA高产菌株的诱变选育。
[1] 付莉, 刘宏生. 一株产生透明质酸的菌株的筛选[J]. 辽宁大学学报, 2006, 33(3): 246-248.
[2] 邓禹, 堵国成, 李秀芬, 等. 基于发酵液特性的透明质酸提取预处理工艺[J]. 过程工程学报, 2007, 7(2): 380-384.
[3] 周荣清, 郭祀远, 李琳. 透明质酸发酵液的絮凝预处理研究[J]. 食品与发酵工业, 2001, 27(12): 16-19.
[4] BOSNIAK S, SADICK N S, CANTISANO-ZILKHA M, et al. The hyaluronic acid push technique for the nasojugal groove[J]. Dermatol Surg, 2008, 34(1): 127-131.
[5] 张文强, 黄岳山, 支晓兴. 透明质酸在临床医学中的应用[J]. 中国组织工程研究与临床康复, 2008, 12(23): 4515-4518.
[6] 郭学平, 王喜春, 凌沛学, 等. 透明质酸及其发酵生产概述[J]. 中国生化医药杂志, 1998, 19(4): 209-211.
[7] 石艳丽, 郭学平, 栾贻宏. 产透明质酸菌的育种概况[J]. 食品与药品, 2006, 8(10): 22-24.
[8] 张容鹄, 冯建成, 张剑韵, 等. 高分子量透明质酸产生菌选育及发酵条件优化[J]. 中国酿造, 2008(10): 17-21.
[9] 邓静, 吴明霞, 吴华昌, 等. 不同诱变方法对兽疫链球菌产透明质酸的影响[J]. 安徽农业科学, 2009, 37(4): 1391-1393; 1399.
[10] 吴定, 路桂红. 低能离子注入法诱变微生物育种[J]. 中国酿造, 2002 (增刊 1): 31-23.
[11] 张敏, 赵丛, 路福平, 等. N+注入中性蛋白酶高产菌株诱变选育的研究[J]. 浙江大学学报: 农业与生命科学版, 2008, 34(3): 245-248.
[12] 余增亮. 离子注入生物效应及育种研究进展[J]. 安徽农学院学报, 1991, 18(4): 251-257.
[13] 周荣清, 郭祀远, 李琳, 等. 发酵液中HA含量分析方法的研究[J]. 华南理工大学学报: 自然科学版, 2001, 29(11): 55-58.
[14] 拉普洛夫. 胶体化学实验[M]. 陈宗琪, 译. 济南: 山东大学出版社, 1980: 161-163.
[15] 钱海伦. 微生物学[M]. 北京: 中国医药工业出版社, 1993: 219-226.
Screening of High-yield Hyaluronic Acid-producing Strain by Low Energy Ion Implantation
ZHANG Wei1,2,YAO Jun1,*,CHEN Kuan-ting1,SUN Rong-bin3,WEI Qin-jun1,CAO Xin1
(1. Department of Biotechnology, School of Basic Medical Science, Nanjing Medical University, Nanjing 210029, China;2. Department of Tourism Management, Changshu Central School of Vocational Education, Changshu 215500, China;3. School of Pharmacy, Nanjing Medical University, Nanjing 210029, China)
Streptococcus zooepidemicus NN-7 was subjected to mutagenesis by means of low energy ion implantation of 8× 1014N+/cm2dose at 30 keV. After culture in selective medium, the mutant strains with double deficiency of hemolysin and hyaluronic acid-degrading enzyme were screened. Among these strains, a mutant strain capable of producing a high yield of hyaluronic acid was selected and designated as SH-9. The strain still revealed excellent passage stability after six generations. The yield of hyaluronic acid reached up to 3.23 g/L with determined relative molecular weight (Mr) of 2.12×106. Compared with the original parent strain, the yield and molecular weight of hyaluronic acid derived from SH-9 were increased by 104.4%and 35.9%, respectively.
hyaluronic acid;Streptococcus zooepidemicus;ion implantation;mutation screening
Q933
A
1002-6630(2011)07-0269-04
2010-08-24
江苏省高校自然科学研究计划项目(09KJB530007)
张伟(1975—),男,助教,学士,研究方向为生物高分子。E-mail:jscswx2000@yahoo.com.cn
*通信作者:姚俊(1979—),男,讲师,博士,研究方向为生物医用材料。E-mail:joelyao@163.com

