白果过敏蛋白及其过敏原性研究
李莹莹,吴彩娥,*,杨剑婷,范龚健
(1.南京林业大学森林资源与环境学院,江苏 南京 210037;2.安徽科技学院食品药品学院,安徽 凤阳 233100)
白果过敏蛋白及其过敏原性研究
李莹莹1,吴彩娥1,*,杨剑婷2,范龚健1
(1.南京林业大学森林资源与环境学院,江苏 南京 210037;2.安徽科技学院食品药品学院,安徽 凤阳 233100)
对白果的主要过敏蛋白进行鉴定,并对其过敏原性进行分析。以SDS-PAGE和Western-Blotting分析鉴定白果蛋白提取液中的蛋白质组分和过敏蛋白,通过间接ELISA法检测过敏小鼠血清中sIgE的效价。白果的蛋白质条带主要有13条,其中以21kD和32kD含量最多。Western-Blotting分析结果表明,白果蛋白中存在3条过敏原蛋白,分子质量分别为21、32、36kD。当酶标二抗稀释度为1:1000,白果蛋白包被质量浓度为50μg/mL,间接ELISA测得过敏小鼠血清中sIgE的效价为1:6400。对白果蛋白进行分析鉴定,明确了白果中存在的过敏原蛋白。
白果;过敏蛋白;SDS-PAGE;Western-Blotting;间接ELISA
食物过敏是指当人体摄入某种特定的食物后在体内发生的由E型抗体(IgE)介导的液体免疫反应。在过敏反应中,有90%以上是由蛋类、花生、乳类、大豆、小麦、树生坚果(杏、板栗、腰果等)、贝类(包括甲壳类和软体动物)、鱼等[1]8类食物引起的。一般食物中使机体产生过敏并与IgE等抗体结合的都为蛋白质[2]。
银杏为裸子植物门银杏纲银杏植物(Gingko bilba L.),为一科一属一种的特殊植物,是我国特有的古老珍贵树种之一[3]。银杏种实去掉肉质外种皮后的部分俗称白果。白果富含淀粉、蛋白质和脂肪等营养物质以及银杏酸、白果酚、五碳多糖、胆固醇等功能成分[4],自古以来被当作养生延年的上品。但是,生食白果或进食太多,会引起过敏反应,临床表现为恶心、呕吐、腹痛、腹泻、烦躁不安、昏迷、抽搐、呼吸困难、瞳孔放大伴随着对光反应迟钝,乃至死亡[5]。Baron-Ruppert等[6]研究认为导致白果过敏主要物质是烷基酚类化合物,Arenz等[7]研究认为4-O-甲基吡哆醇(4-OMethylpyridoxine,MPN)可能有致敏作用。杨剑婷等[8]通过对白果过敏的相关数据分析,认为白果中可能存在其他类型的致敏物质。
白果中含有8.7%~13.4%的蛋白质,其氨基酸组成丰富、合理,属于优质蛋白。近年来,关于白果蛋白的研究主要集中于白果蛋白组成及其功能上。Uwe等[9]在1989年从白果中分离出一种类似豆球蛋白的物质。牛卫宁等[10]报道了从白果中提取得到的蛋白具有抗菌作用。黄文等[11]应用不同的提取方法,分离出白果清蛋白、球蛋白、醇溶蛋白和碱溶蛋白等,发现白果中的蛋白质主要以清蛋白和球蛋白为主,其中白果清蛋白具有抗氧化和延缓衰老等作用。有研究表明,食物中90%的过敏原是蛋白质,郭红彦等[12]研究发现,银杏枝条中的32、36kD贮藏蛋白具有免疫原性。本课题组在此基础上,已应用豚鼠为实验动物,明确了白果蛋白具有致敏性,并建立了白果蛋白过敏反应的小鼠模型[13],本研究正是基于此模型,初步鉴定白果中的过敏蛋白,并对其过敏原性进行分析,旨在明确白果中的过敏蛋白及其过敏原性,以期为过敏性疾病的特异性诊断以及白果食品的安全开发提供指导。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
白果为大佛指品种,购自江苏泰兴。
1.1.2 试剂与仪器
HRP(辣根过氧化物酶)标记的羊抗鼠IgE抗体、SDSPAGE凝胶电泳所用试剂 美国Sigma公司;低分子质量蛋白标准、葡萄糖、牛血清蛋白 上海生化试剂公司;邻苯二胺(OPD)、二氨基联苯胺(DAB)显色试剂 华美公司;其他试剂均为国产分析纯。
TU-1800PC紫外-可见分光光度计 北京普析通用仪器有限责任公司;GL-20G- II型冷冻离心机 上海安亭科学仪器厂;PHS-25型pH计 上海智光仪器仪表有限公司;DYY-6C型电泳仪、DYCZ-24D垂直板电泳槽 北京六一仪器厂;BIO-RAD电泳自动成像仪、BIO-RAD半干式转印仪 美国BIO-RAD生化科技有限公司;Thermo354型酶标仪、96孔酶标板 Thereto Labsystem公司。
1.1.3 动物
小鼠,健康成年昆明种小白鼠,雄性,体质量(20±2)g,由南京江宁区青龙山动物繁殖场提供。
1.2 方法
1.2.1 白果蛋白粗提液的制备
取白果50g,冷冻干燥后,研磨过筛,5倍体积石油醚脱脂至脱脂完全为止,待石油醚完全挥发后,以1:20 (m/V)的比例加入pH 8.5、0.15mol/L Tris-HCl溶液进行蛋白提取,4℃下磁力搅拌24h,12000r/min冷冻离心20min,上清液通过40~80g/100mL饱和度的(NH4)2SO4沉淀,12000r/min离心10min,沉淀用pH 7.4、0.01mol/L磷酸盐缓冲液(PBS)溶解,采用透析袋用PBS进行透析。透析完全后,4℃贮存备用。
1.2.2 免疫小鼠模型的建立
成年小鼠分成3组,每组40只雄性。实验组分为阴性对照组、白果蛋白组、阳性对照组,具体如下:阴性对照组:0.2mol/L、pH 7.4的Tris-HCl经口灌胃致敏和腹腔注射激发;白果蛋白组:100mg/mL白果蛋白经口灌胃致敏、200mg/mL白果蛋白经口灌胃激发;阳性对照组:0.50mg/mL的卵白蛋白经口灌胃致敏、1.0mg/mL卵白蛋白腹腔注射激发。
每组小鼠均在第1、7、14 天致敏,第21 天激发。致敏、激发剂量均为0.3mL/10g体质量。末次激发后第14天采血,收集的血清放置在室温中自然凝固3~4h。待血液凝固血块收缩后,用毛细滴管吸取血清。于3000r/min离心15min,取上清,分装后置4℃冰箱中保存备用。
测定时,取5mL血清与等量的生理盐水混合后,缓慢加入20g/100mL的硫酸铵使有沉淀产生。充分混合后,4℃放置30min;后于3000r/min离心20min,弃沉淀,上清液中继续加入硫酸铵至浓度为50g/100mL,4℃放置30min,经5000r/min离心30min,收集沉淀溶于10mL的生理盐水,加入硫酸铵至终浓度为33g/100mL, 4℃放置30min,后于3000r/min离心20min,沉淀以33g/100mL饱和度的硫酸铵溶液洗涤两次后,溶解于l0mL生理盐水中,置于透析袋中在生理盐水中透析过夜,处理好的血清用于IgE测定。
1.2.3 SDS-PAGE分析
调整白果蛋白粗提物质量浓度为1mg/mL,将白果蛋白提取液与样品缓冲液按1:1的比例混合,100℃煮沸5min,12000r/min离心5min,上样20μL,12%分离胶,3.9%浓缩胶。开始电流10mA,进入分离胶后为20mA,电泳时间为2.5~3.5h。考马斯亮蓝R-250染色,过夜,放入脱色液中脱色,直至胶片背景蓝色完全透明状。BIO-RAD电泳自动成像仪拍照,蛋白质分子质量运用Quality one软件进行分析。
1.2.4 Western-Blotting分析
使用BIO-RAD 半干式转印仪将SDS-PAGE凝胶中的蛋白条带转移至PVDF(聚偏氟乙烯) 膜上;转移结束后,0.01mol/L PBS洗膜,5min ×3次,将膜用5g/100mL OVA (卵蛋白)封闭2h;PBST漂洗,加入抗血清(按1:100 稀释),设阴性对照,4℃放置12h以上;PBST 漂洗,5min× 3次,加入羊抗鼠IgE-HRP(按1:500 稀释),室温孵育2h,PBST 漂洗,5min×3次。加入DAB显色液,显色后用水终止反应,结果拍照保存。
1.2.5 间接ELISA检测抗血清中sIgE
用包被缓冲液将白果蛋白稀释至一定质量浓度,加到96孔酶标板,100μL/孔,4℃过夜;次日用PBST液洗涤3次,拍干;将酶标板孔内加入封闭液,200μL/孔,37℃恒温箱中孵育2h,同上洗涤;将一定质量浓度的抗血清加入板孔,100μL/孔,37℃恒温箱中孵育2h,同上洗涤;加入羊抗鼠IgE-HRP,100μL/孔,37℃恒温箱中孵育2h,同上洗涤;再加现配制的OPD底物显色液,37℃避光显色30 min;加入2mol/L的H2SO4终止液,每孔50μL,用 ELISA 酶标仪于492nm波长处,以空白对照孔调零后测定各孔OD值。结果判定:计算待检测孔与阴性对照孔的 OD492nm之比(P/N),当 P/N≥2.1时,为阳性;当P/N<2.1时,为阴性。
1.2.5.1 酶标二抗浓度的确定
按照ELISA操作步骤,用包被缓冲液将抗血清稀释为1:200、1:400、1:800、1:1600、1:3200、1:6400;将羊抗鼠IgE-HRP,分别稀释为1:500、1:1000、1:2000,依次加入酶标板,两者37℃作用2h后,再加底物液作用30min,加终止液,在酶标仪上读取OD492nm值。
1.2.5.2 抗原最佳包被质量浓度和抗血清最佳稀释度的确定
采用棋盘法。将包被抗原稀释为5、10、50μg/mL和100μg/mL,加入到酶标板中,每行1个稀释度,4℃过夜;将抗血清稀释为1:200、1:400、1:800、1:1600、1:3200、1:6400、1:12800加入酶标板中,每一列为1个稀释度,37℃孵育2h。其余反应同ELISA操作步骤,测定各孔OD492nm。
1.2.6 抗血清sIgE效价的测定
将抗血清按照 1:200、1:400、1:800、1:1600、1:3200、1:6400、1:12800的比例稀释,采用间接 ELISA法测定其效价。以阳性血清和阴性血清的OD492nm之比(P/N)大于2.1的血清最高稀释倍数作为抗体的效价。
1.2.7 蛋白质量浓度的测定
应用Bradford法[14],以牛血清蛋白为标准蛋白,标准曲线方程为Y=8.2134X+0.0214(R2=0.9985)。
1.3 统计学分析
数据采用DPS(version 3.01)统计软件进行统计分析,设置显著水平分别为P<0.05及P<0.01。所有实验设3次重复,结果均为平均值,以平均值±标准误表示,并进行方差分析和Duncan s检验。
2 结果与分析
2.1 白果蛋白粗提液SDS-PAGE电泳分析
对白果蛋白提取液进行SDS-PAGE凝胶电泳,如图1所示。白果的蛋白质条带主要有13条,其分子质量介于10~100kD之间,白果蛋白分子质量最大为99kD,最小的为13kD,其中含量高的有6条,分子质量分别为15、21、32、36、48、69kD,其中以21kD和32kD含量最多。白果的蛋白条带主要集中在31~100kD,占蛋白总条数的77%,其余蛋白条带集中在13~22kD范围内,可见白果蛋白多以大分子的结构存在,蛋白质带表现出了良好的多态性。白果中蛋白种类丰富,主要存在分子质量为21kD和32kD的两种蛋白,以及十余种含量略低的其他蛋白,大分子蛋白较多。
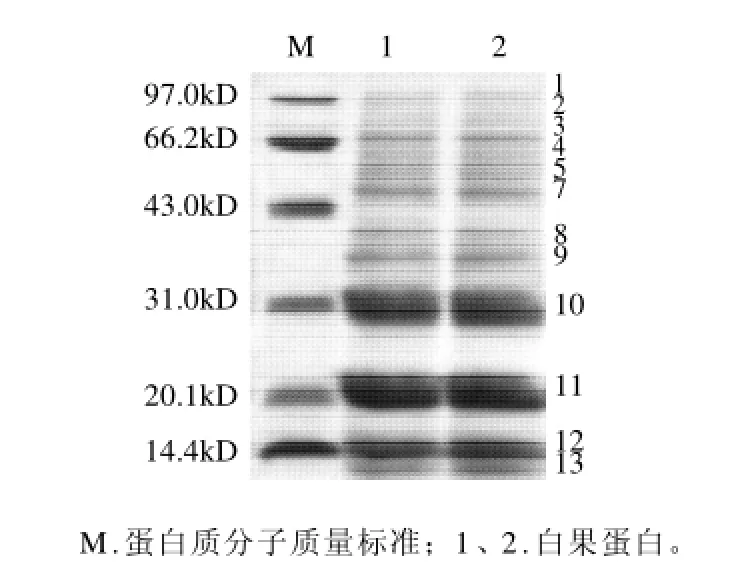
图1 白果蛋白提取液的SDS-PAGE结果Fig.1 SDS-PAGE of ginkgo seed proteins
2.2 Western-Blotting分析鉴定白果的主要过敏蛋白
Western-Blotting是将经过SDS-PAGE分离的蛋白质样品,转移到固相载体(PVDF膜)上,以固相载体上的蛋白质作为抗原,与对应的抗体起免疫反应,再与酶标记的第二抗体起反应,经过底物显色以检测电泳分离的特异性的蛋白成分。将白果蛋白进行Western-Blotting分析,结果如图2所示。
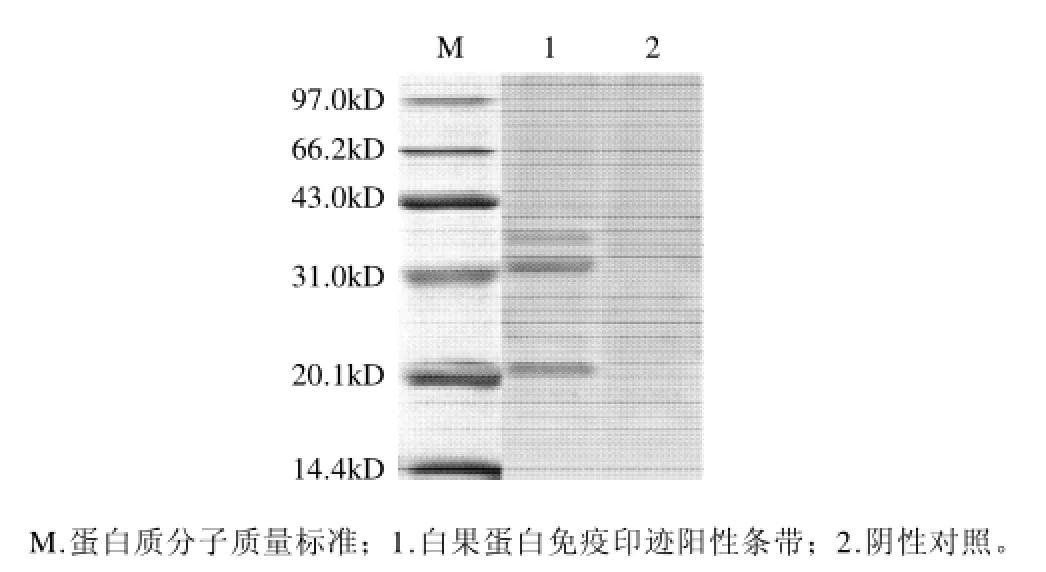
图2 白果蛋白的Western-Blotting结果Fig.2 Western-Blotting of ginkgo seed proteins
过敏小鼠血清经免疫印迹检测均有阳性区带产生,而阴性对照血清未显示特异性IgE结合区带。白果蛋白组分中可与过敏小鼠抗血清中的IgE特异性结合的主要有3种蛋白组分,其分子质量分别为21、32、36kD,可初步确定其为白果中主要的过敏原蛋白。据报道,大豆中的3种主要致敏原是Glym Bd 30k、Glym Bd 28k和β-伴大豆球蛋白,其分子质量分别为30、28kD,而大米中已分离得到的6种过敏蛋白,分子质量分别为14、15、16、26、33kD和56kD[15],可见,白果过敏蛋白与其他核果类过敏原中存在的主要过敏原蛋白在分子质量上具有一定的相似性。
2.3 间接ELISA检测抗血清中sIgE
2.3.1 酶标二抗浓度的确定
分别将羊抗鼠IgE-HRP稀释为1:500、1:1000和1:2000,在不同的抗血清稀释度下测得的OD492nm如图3所示。
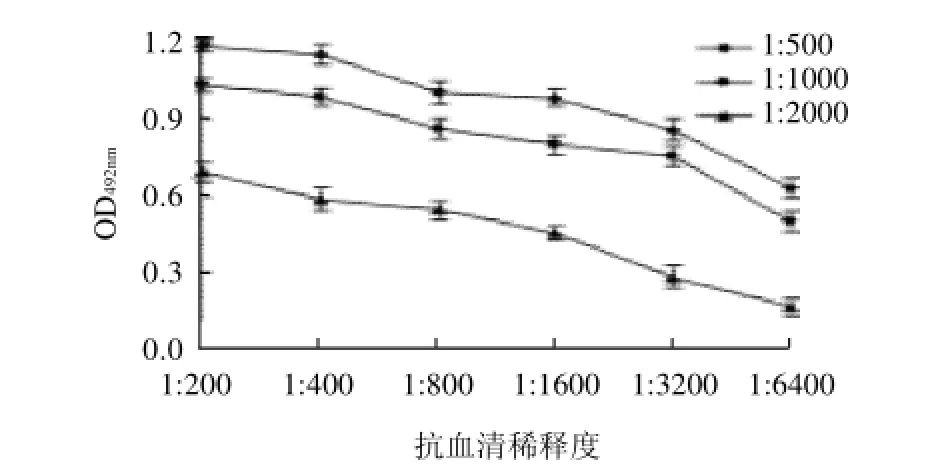
图3 不同血清稀释度下HRP-羊抗鼠IgE稀释度的OD492nmFig.3 Plot of OD492nmversus different dilutions of antiserum with different dilutions of goat anti-mouse IgE-HRP
随着羊抗鼠IgE-HRP稀释度增大,各孔OD值逐渐减小。当羊抗鼠IgE-HRP稀释至1:2000时,OD值较稀释度1:500和1:1000显著降低(P>0.05)。但羊抗鼠IgEHRP稀释为1:500和1:1000,OD492nm值较接近。一般情况下,ELISA检测仪在检测OD值时,OD值为1.0左右时误差最小,反应最灵敏[16]。羊抗鼠IgE-HRP在稀释度1:1000,血清稀释度为1:400时,OD492nm为0.992,接近1.0,另外从节约成本角度考虑,本实验确定酶标二抗的最佳工作稀释度为1:1000。
2.3.2 抗原最佳包被质量浓度和抗血清最佳稀释度的确定
通过以不同质量浓度的白果蛋白包被酶标板,然后加入不同稀释度的抗血清,再通过酶标二抗的作用,不同质量浓度的过敏原与不同稀释度的抗血清作用的OD492nm值,结果见图4。随着抗血清稀释度的增加,不同抗原包被质量浓度下测得的OD值逐渐减小,当包被的白果蛋白质量浓度为50μg/mL和100μg/mL时测得的OD值较高,当包被的白果蛋白质量浓度为50μg/mL,血清稀释度为1:500时,OD492nm为0.997,接近1.0,且此时阳性血清和阴性血清的OD492nm的比值P/N为8.982,其值远远大于2.1,因此确定抗原的最佳包被质量浓度为50μg/mL,包被是ELISA实验中关键的一步,如果质量浓度过低,包被液中的蛋白质不能完全覆盖固相载体表面,随后加入的特异性抗体和酶标二抗就有可能直接被吸附到固相载体上,最后产生非特异性显色而使检测结果偏高[17];质量浓度过高,蛋白质分子的相互作用影响聚苯乙烯与蛋白质之间的吸附,以至在随后的抗原抗体反应、洗涤等步骤中,部分抗原或与抗体结合释放到洗涤液中被弃去,或直接释放到洗涤液中造成抗原的浪费[18],本实验确定抗原的最佳包被质量浓度为50μg/mL,取得了较好的包被效果。
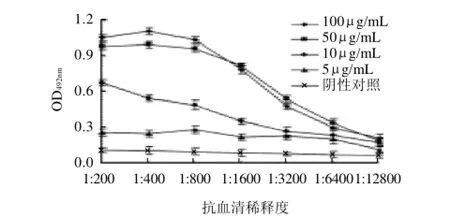
图4 白果蛋白不同包被质量浓度时不同稀释度血清的OD492nmFig.4 Plot pf OD492nm versus different dilutions of antiserum with different coating concentrations of ginkgo seed proteins
2.4 抗血清sIgE效价的测定
本实验采用间接ELISA法测定经白果蛋白免疫后的过敏小鼠血清中sIgE的效价,以阳性血清和阴性血清的OD492nm之比(P/N)大于2.1的血清最高稀释倍数作为抗体的效价,结果见表1。
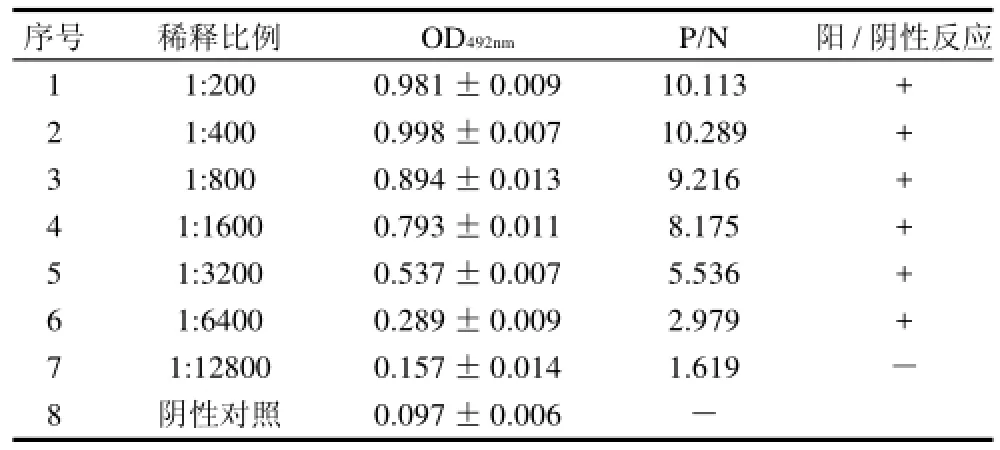
表1 抗血清IgE效价测定结果Table 1 Determination results of mouse serum IgE titer
将抗血清按照一定的比例稀释后,除抗血清稀释度为1:12800外,其余稀释度中各反应皆为阳性反应,阳性血清和阴性血清的OD492nm之比P/N都大于2.1,因此确定抗血清中sIgE的效价为1:6400。本实验测得的sIgE的效价较报道的其他过敏原效价较低[17],分析原因,可能是因为酶联免疫是很强的非特异性吸附反应,而制得的多克隆抗体只经过硫酸铵沉淀未经过层析法进一步纯化,使得制得的多克隆抗体中除了一些特异性的抗体以外,还有存在某些杂质和其他抗体成分,这些物质的存在一定程度上降低了特异性抗体的灵敏性[19]。
目前,测定抗体效价的方法很多,结果比较粗放,采用琼脂扩散的方法比较多,但由于影响因素比较多,而且敏感度比较低[20]。间接酶联免疫的方法克服了这些缺点,而且操作简便。由于多克隆抗体存在大量的抗原决定簇,很容易和抗体进行结合,特别适合于用酶联免疫的方法检测,而且在检测过程中经常采用酶联免疫的方法,能够对以后检测过程中抗体的使用提供直接的指导。
3 结 论
3.1 通过Tris-HCl法提取白果蛋白,并采用SDS-PAGE分析白果蛋白的分子组成及其分子质量,结果表明,白果的蛋白质条带主要有13条,其中以21kD和32kD含量最多。
3.2 通过Western-Blotting分析鉴定白果的主要过敏原,结果初步表明白果中主要存在3种蛋白过敏原,其分子质量分别为21、32、36kD。
3.3 采用间接ELISA法测定经白果蛋白免疫后的过敏小鼠血清中sIgE的效价,结果表明当酶标二抗浓度为1:1000,白果蛋白包被质量浓度为50μg/mL时,测得过敏小鼠血清中sIgE的效价为1:6400。
[1] HEIMO B, CLARE M. Plant food allergens:structural and functional aspects of allergenicity[J]. Biotechnology Advances, 2005, 23: 395-399.
[2] 聂凌鸿. 食物过敏原研究进展[J]. 生命的化学, 2002, 22(5): 474-477. [3] 曹福亮. 中国银杏志[M]. 北京: 中国林业出版社, 2007.
[4] 钱丙炎. 银杏的功效[M]. 邳州: 邳州市银杏科学研究所, 2008.
[5] van BEEK T A. Chemical analysis of Ginkgo biloba leaves and extracts [J]. Journal of Chromatography A, 2002, 967: 21-55.
[6] BARON-RUPPERT G, LUEPKE N P. Evidence for toxic effects of alkylphenols from Ginkgo biloba in the hen s egg test[J]. Phytomedicine, 2001, 8, 133-138.
[7] ARENZ A, KLEIN M, FIEHE K, et al. Occurrence of neurotoxic 4'-O-methylpyridoxine in Ginkgo biloba leaves, ginkgo medications and Japanese ginkgo food[J]. Planta Med, 1996, 62: 548-551.
[8] 杨剑婷, 吴彩娥. 白果致过敏成分及其致敏机理研究进展[J]. 食品科技, 2009, 34(6): 282-286.
[9] UWE J, HEIKE B. Legumin-like proteins in gymnosperms[J]. Phytochemistry, 1989, 28(5): 1389-1394.
[10] 牛卫宁, 郭霭光. 银杏种仁中抗菌蛋白的纯化及性质[J]. 西北植物学报, 2003, 23(9): 1545-1549.
[11] 黄文, 谢笔钧, 王益, 等. 白果蛋白的分离、纯化、理化特性及其抗氧化活性研究[J]. 中国农业科学, 2004, 37(10): 1537-1545.
[12] 郭红彦. 银杏营养贮藏蛋白质的分离鉴定及特性研究[D]. 南京: 南京林业大学, 2007.
[13] 杨剑婷, 吴彩娥, 李莹莹, 等. 白果蛋白过敏动物模型的试验研究[J].中国农业科学, 2010, 43(17): 3616-3623.
[14] BRADFORD M M. Rapid and sensitive method for quantitation of microgram quantities of protein utilizing principle of protein:dye binding [J]. Analytical Biochemistry, 1976, 72: 248-254.
[15] 卢大用. 食品中的蛋白过敏原及其检测[J]. 食品研究与开发, 2000, 21(2): 49-50.
[16] 刘合义, 孙留霞, 王进轶, 等. 牛冠状病毒重组N蛋白间接ELISA检测方法的建立[J]. 中国预防兽医学报, 2009, 31(8): 618-620.
[17] 李金明. 临床酶免测定技术[M]. 北京:人民军医出版社, 2005.
[18] 张也, 刘以祥. 酶联免疫技术与食品安全快速检测[J].食品科学, 2003, 24(8): 200-203.
[19] 李文敏. 酶联免疫吸附反应的技术进展及应用[J].中国动物检疫, 2003, 6(4): 65-69.
[20] 朱立平, 陈学清. 免疫学常用实验方法[M]. 北京: 人民军医出版社, 2000.
Identification and Allergenicity of Allergic Proteins in Ginkgo Seeds
LI Ying-ying1,WU Cai-e1,*, YANG Jian-ting2,FAN Gong-jian1
(1.College of Forest Resources and Environment, Nanjing Forestry University, Nanjing 210037, China;2.College of Food and Drug, Anhui Science and Technology University, Fengyang 233100, China)
SDS-PAGE and Western-Blotting were used to identify the protein composition and allergic proteins of ginkgo seed extract, respectively. A total of 13 bands were observed in the SDS-PAGE pattern, and the fractions of 21 kD and 32 kD exhibited the highest content. Western-Blotting analysis indicated that ginkgo seeds had 3 allergic proteins, whose molecular weights were 21, 32 kD and 36 kD, respectively. When the enzyme secondary antibody concentration was 1:1000 and the ginkgo protein coating concentration was 50μg/mL, the serum IgE titer of mice allergic to ginkgo seeds was detected to be 1:6400 by indirect ELISA.
ginkgo seed;allergic protein;SDS-PAGE;Western-Blotting;indirect ELISA
Q816
A
1002-6630(2011)07-0016-05
2010-06-30
教育部博士点基金项目(200802980004)
李莹莹(1984—),女,硕士研究生,研究方向为经济植物资源加工利用及其安全控制。E-mail:njliyingying@yahoo.com.cn
*通信作者:吴彩娥(1963—),女,教授,博士,研究方向为食品活性成分提取及食品安全控制。E-mail:sxwucaie@163.com

