富硒螺旋藻多肽对血管紧张素转化酶的抑制作用
高冬芳,张逸波,凌钦婕,邹 颖,黄 峙*
(暨南大学生命科学技术学院,广东 广州 510632)
富硒螺旋藻多肽对血管紧张素转化酶的抑制作用
高冬芳,张逸波,凌钦婕,邹 颖,黄 峙*
(暨南大学生命科学技术学院,广东 广州 510632)
从富硒螺旋藻(SeSP)中提取总蛋白(SeSP-TP),用不同蛋白酶水解SeSP-TP制备富硒螺旋藻多肽(SeSP-Ps),体外测定SeSP-Ps对血管紧张素转化酶(ACE)的抑制作用。结果表明:5种常见蛋白酶在最适条件下对SeSP-TP水解度明显不同,其中胃蛋白酶-胰蛋白酶-胰凝乳蛋白酶联合使用时的酶水解度最高;虽然不同蛋白酶水解制备的SeSP-Ps均对ACE具有较强的抑制作用,但不同酶水解的SeSP-Ps对ACE的50%抑制浓度(IC50)存在明显差异,其中胃蛋白酶-胰蛋白酶-胰凝乳蛋白酶联合酶解制备的SeSP-Ps对ACE的IC50值最低,为74.6μg/mL。结果提示:SeSP在体内经胃肠蛋白酶消化产生的多肽,对ACE具有较强的抑制活性,且SeSP-Ps对ACE的抑制作用呈现显著的剂量-效应依赖性。
血管紧张素转化酶(ACE);螺旋藻;硒;多肽
螺旋藻(Spirulina platensis,SP)具有预防心脑血管疾病、抗肿瘤、抗病毒等辅助药用价值[1]。硒(selenium,Se)是人体必需微量元素之一,缺硒与克山病、糖尿病、肿瘤等数10种疾病有关。SP是无机硒生物有机化的理想载体[2-4],前期的研究证实了富硒螺旋藻(selenium enriched Spirulina platensis,SeSP)、SeSP总蛋白(SeSP-TP)和硒藻蓝蛋白(Se phycocyanin,Se-PC)具有拮抗肝损伤和纤维化及诱导肿瘤细胞凋亡等方面的生物学活性,发现含硒蛋白质是SeSP中的主要活性组分[5-10]。
血管紧张素转化酶(angiotensin convert enzyme,ACE)催化血管紧张素Ⅰ生成血管紧张素Ⅱ,使小动脉血管平滑肌收缩,引起血压迅速上升[11]。抑制ACE的活性,可以有效阻止血管紧张素Ⅱ的生成,从而达到降压作用。近年来,研究者已证实食品不同来源的ACE抑制多肽有250余种[12-14]。本研究从SeSP中提取SeSP-TP,用不同蛋白酶水解SeSP-TP制备富硒螺旋藻多肽(SeSP peptides,SeSP-Ps),体外测定SeSP-Ps对血管紧张素转化酶(ACE)的抑制作用。
1 材料与方法
1.1 材料、试剂与仪器
钝顶螺旋藻(Spirulina platensis Nordst. Geitler)藻种取自暨南大学水生生物研究所。
胃蛋白酶(pepsin,2500U/mg)、胰蛋白酶(trypsin,10000U/mg)、木瓜蛋白酶(papain,200U/mg)、胰凝乳蛋白酶(chymotrypsin,1500U/mg)、碱性蛋白酶(alcalase,200U/mg)、马尿酰-组胺酰-亮氨酸(Nhippuryl-His-Leu hydrate,HHL)、血管紧张素转化酶(ACE,10U/mg) 美国Sigma公司;BCA法蛋白质定量试剂盒、HEPES和PBS缓冲液 鼎国生物技术公司;亚硒酸钠、丙酮、乙酸乙酯等试剂均为分析纯。实验全部采用Milli Q水。
LRH-250-B型光照培养箱、TGL-16G型冷冻高速离心机 上海医用分析仪器厂;JY92-IID型超声细胞破碎仪 湖北泰维医疗科技公司;S54型紫外-可见分光光度计 广州光学仪器厂。
1.2 富硒螺旋藻(SeSP)的培养
采用Zarrouk培养基培养保种[2]。取对数生长期的钝顶螺旋藻藻种,接种于5L鼓泡培养瓶内,接种量为OD560nm值为0.10。培养条件:温度33~35℃,pH8.8~9.5,光照强度4000lx,光照时间16h/d。在培养周期的第7、8、9天,分3次等量加入200μg/L亚硒酸钠。第10天过滤收集藻细胞。
1.3 富硒螺旋藻水溶性总蛋白(SeSP-TP)的提取
取藻细胞25g,加入120mL PBS缓冲液(pH7.2),反复冻融3次,冰浴超声破碎30min(5s破碎,10s间隔;功率800W),12000×g离心30min去掉细胞碎片,5倍体积-20℃预冷丙酮沉淀过夜,12000×g离心15min收集沉淀蛋白,冰浴待丙酮挥发干净后,加入1mL PBS复溶。采用BCA法测定蛋白质浓度[9]。
1.4 富硒螺旋藻蛋白多肽(SeSP-Ps)的制备
取1mg SeSP-TP加入0.3U蛋白酶进行酶解,经大量预实验,不同蛋白酶的最适酶解条件如表1所示。胃蛋白酶-胰蛋白酶-胰凝乳蛋白酶联合水解方案:先用胃蛋白酶在37℃、pH1.5条件下水解6h,再用胰蛋白酶-胰凝乳蛋白酶酶活力比为10:1的比例在37℃、pH7.5条件下水解6h[13]。水解过程中采用0.1mol/L的NaOH溶液调节反应体系的pH值。水解结束,沸水浴15min终止反应。用截留分子质量为10kD的超滤管超滤所有酶解样品,冷冻干燥,得SeSP-Ps。
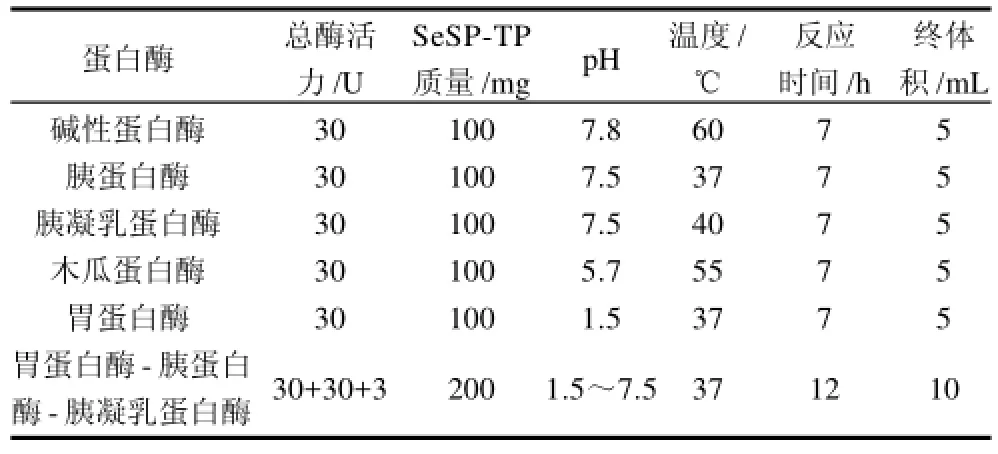
表1 不同蛋白酶水解SeSP-TP的最适条件Table 1 Optimal conditions for SeSP-TP hydrolysis by different proteases
1.5 蛋白酶水解度(hydrolysis degree,HD)的测定
采用水解后多肽的质量与水解前蛋白质的质量之间的比值作为蛋白酶水解度。多肽质量浓度测定方法如下,调整SeSP-Ps及对照组的稀释倍数,分别测定215nm和225nm波长处的吸光度,根据文献[13]计算多肽质量浓度。
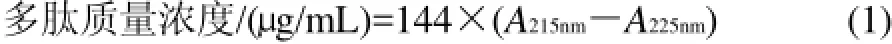
1.6 ACE抑制率测定
ACE活性测定方法参见文献[12],将20μL SeSP-Ps、0.3mU ACE、20μL缓冲溶液(HEPE-NaCl缓冲液,50mmol/L,pH8.3,含300mmol/L NaCl),37℃孵化15min。加入20μL 6.5mmol/L HHL,37℃孵化1h后用1mol/L的HCl终止反应。加入200μL乙酸乙酯萃取反应产物马尿酸(Hip),取上层150μL,减压离心(40℃、真空度0.090MPa)去除乙酸乙酯,固体用500μL Milli Q水溶解,测228nm波长处的光吸收度(产物马尿酸在228nm波长处有特征吸收峰)。SeSP-Ps对ACE的抑制率按式(2)计算。

1.7 硒含量检测
参照文献[15]的方法,将100mg的样品混合5mL的消化液(浓硝酸:高氯酸体积比3:1),200℃消化6h,待溶液完全澄清之后停止,12000×g离心去沉淀。用Milli Q水稀释到5mL,用ICP-AES测定硒含量。
1.8 统计分析
所有实验重复3次。结果以x±s表示,统计分析采用SPSS 13.0处理,进行差异显著性分析。
2 结果与分析
2.1 SeSP和SeSP-TP中Se含量
如图1所示,SeSP和SeSP-TP中硒含量分别为402μg/g和314μg/g,说明SeSP代谢转化的硒75%以上存在于藻体蛋白质中,也提示SeSP-TP经酶解后可获得含硒的水解多肽。
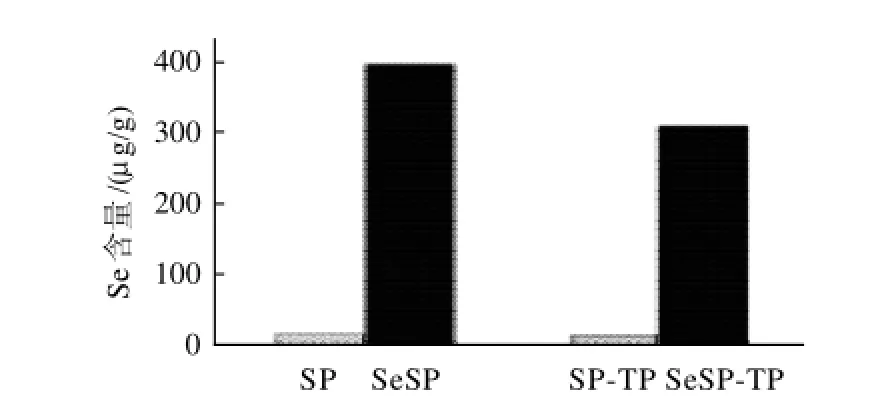
图1 SeSP和SeSP-TP中硒含量Fig.1 Se concentrations of SeSP and SeSP-TP
2.2 不同蛋白酶对SeSP-TP的水解度
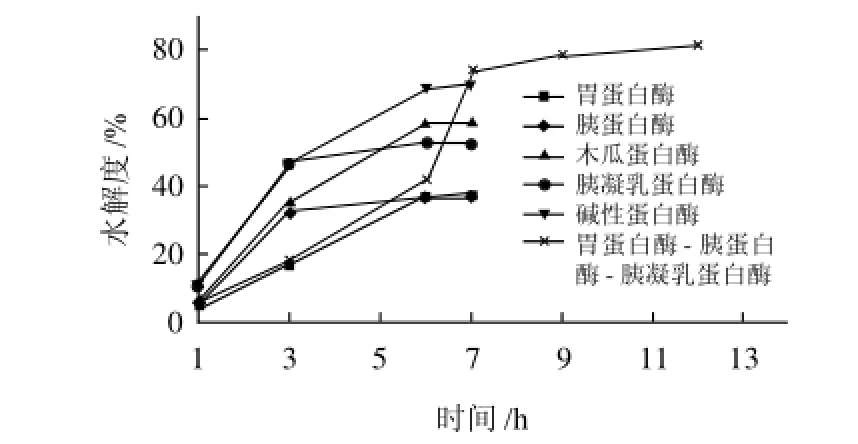
图2 不同蛋白酶对SeSP-TP的水解度Fig.2 Time courses of hydrolysis degree of SeSP-TP by different proteases
如图2所示,5种蛋白酶对SeSP-TP的水解度依次为:碱性蛋白酶(alcalase)>胰凝乳蛋白酶(chymotrypsin)>木瓜蛋白酶(papain)>胃蛋白酶(pepsin)>胰蛋白酶(trypsin)。虽然胰蛋白酶和胃蛋白酶对SeSP-TP的水解度较低,分别为37.1%和36.4%,但是,当胃蛋白酶-胰蛋白酶-胰凝乳蛋白酶联合使用时对SeSP-TP的水解度最高,可以达到81.2%,且持续时间长。胃蛋白酶-胰蛋白酶-胰凝乳蛋白酶联合使用模拟了人体消化道酶系统,说明SeSP-TP可被人体消化利用的效率很高,明显优于其他体外蛋白酶单独作用,因此,SeSP产品无需体外酶解,是一种优质功能性食品,具有强大的应用潜力。在整个水解过程中,随着水解度的升高,水解速率逐渐减低,符合蛋白酶水解过程中由于底物被分解而造成的反应平衡变化的规律。
2.3 SeSP-Ps对ACE的抑制率

图3 螺旋藻蛋白水解多肽对ACE的抑制率Fig.3 ACE inhibition rates of SeSP-Ps hydrolysates obtained with different proteases
如图3所示,5种蛋白酶水解多肽对ACE抑制率依次为:木瓜蛋白酶>胃蛋白酶>碱性蛋白酶>胰凝乳蛋白酶>胰蛋白酶,富硒和未富硒螺旋藻总蛋白的酶水解多肽SeSP-Ps和SP-Ps对ACE的抑制作用具有相似的趋势,且SeSP-Ps对ACE的抑制率均高于SP-Ps,其中胃蛋白酶水解多肽SeSP-Ps对ACE的抑制率明显高于SP-Ps (P<0.05)。结果还发现,胃蛋白酶-胰蛋白酶-胰凝乳蛋白酶联合水解的SeSP-Ps对ACE抑制率最高(89.5%),明显高于相同酶解条件下的水解多肽SP-Ps对ACE的抑制率(72.2%)。结果表明蛋白酶水解多肽对ACE抑制率与上述结果中的水解度相一致,胃蛋白酶-胰蛋白酶-胰凝乳蛋白酶联合水解,较好地模拟了人体消化道酶系统,提示SeSP-TP经人体消化利用后,可产生对ACE具有较强抑制作用的活性多肽。因此,SeSP作为防治高血压和心脑血管的保健食品具有广阔的应用前景。
2.4 SeSP-Ps抑制ACE的剂量效应

图4 胃蛋白酶-胰蛋白酶-胰凝乳蛋白酶联合水解多肽抑制ACE的剂量效应关系Fig.4 Dose dependence of ACE inhibition activity of SeSP-Ps hydrolysate obtained by the combined use of pepsin, trypsin and chimotrypsin
从图4可见,胃蛋白酶-胰蛋白酶-胰凝乳蛋白酶联合水解的SeSP-Ps对ACE的抑制具有明显的剂量效应关系,推算SP-Ps和SeSP-Ps的IC50值分别是139.8μg/mL和74.6μg/mL,差异明显。当多肽质量浓度在200μg/mL以下时,SP-Ps和SeSP-Ps对ACE抑制效率差异不显著,而当多肽质量浓度高于200μg/mL时,SP-Ps和SeSP-Ps的ACE抑制效率差异极显著(P<0.01)。另外,用ICPAES测定SeSP-TP和SeSP-Ps中Se含量分别为314μg/g和293μg/g,两者差别较小。结果说明,在SeSP-Ps制备过程中硒的损失不大;另外,当多肽质量浓度小于200μg/mL时,其中所含Se的质量浓度为0.06μg/mL,可能很难发挥其作用,造成SP-Ps和SeSP-Ps的ACE抑制效率差异很小。随着SeSP-Ps质量浓度的增加,Se含量也随之上升,Se则可能参与对ACE的抑制作用,导致SeSP-Ps在高浓度时对ACE的抑制效率显著高于SP-Ps。
3 结 论
研究了5种蛋白酶水解SeSP-TP的效率及其水解多肽对ACE的抑制作用,并进一步探讨了最优酶解方案的水解多肽抑制ACE的剂量效应和IC50值。结果发现采用模拟人体内消化道胃蛋白酶-胰蛋白酶-胰凝乳蛋白酶联合水解方案对SeSP的水解度最高,其水解多肽SeSP-Ps对ACE的抑制最强,IC50值为74.6μg/mL,SeSP-Ps对ACE的抑制作用呈现显著的剂量-效应依赖性。
[1] 王文博, 高俊萍, 孙建光, 等. 螺旋藻的营养保健价值及其在预防医学中的应用[J]. 中国食物与营养, 2009(1): 48-51.
[2] 吴文龙, 杨志娟. 螺旋藻保健食品的功能因子与研究开发进展[J]. 食品研究与开发, 2006, 27(2): 129-131.
[3] CHEN Tianfeng, ZHENG Wenjie, WONG Y S, et al. Accumulation of selenium in mixotrophic culture of Spirulina platensis on glucose[J]. Bioresource Technology, 2006, 97(18): 2260-2265.
[4] MENDIOLA J A, JAIME L, SANTOYO S, et al. Screening of functional compounds in supercritical fluid extracts from Spirulina platensis[J]. Food Chemistry, 2007, 102(4): 1357-1367.
[5] 黄峙, 郑文杰, 向军俭, 等. 含硒藻蓝蛋白抗小鼠实验性肝损伤的作用[J]. 中国病理生理杂志, 2002, 18(7): 819-822.
[6] HUANG Zhi, GUO Baojiang, WONG R N S, et al. Characterization and antioxidant activity of selenium-containing phycocyanin isolated from Spirulina platensis[J]. Food Chemistry, 2007, 100(3): 1137-1143.
[7] 彭赟, 黄峙, 郭宝江. 富硒螺旋藻清除氧自由基的初步研究[J]. 营养学报, 2005, 27(1): 61-64
[8] 黄峙, 杨芳, 郑文杰. 富硒螺旋藻中硒别藻蓝蛋白的纯化及其特性[J]. 微生物学报, 2006, 46(3): 401-405.
[9] HUANG Zhi, YANG Fang, ZHENG Wenjie, et al. Purification and preparation of active subunits of C-phycocyanin by a protocol of liquidphase isoeletric focusing[J]. Chemical Journal of Chinese Universities, 2006, 27(6): 1051-1054.
[10] HUANG Zhi, ZHENG Wenjie, YANG Fang, et al. Chemical composition and selenium distribution in selenium enriched Spirulina platensis biomass[J]. Chemistry of Natural Compounds, 2006, 42(6): 636-640.
[11] MEGIAS C, PEDROCHE J, YUST M, et al. Purification of angiotensinconverting enzyme inhibitory peptides from sunflower protein hydrolysates by reverse-phase chromatography following affinity purification[J]. LWT - Food Science and Technology, 2009, 42(1): 228-232.
[12] CHEUNG I W Y, NAKAYAMA S, HSU M N K, et al. Angiotensin-I converting enzyme inhibitory activity of hydrolysates from oat (Avena sativa) proteins by in silico and in vitro analyses[J]. Journal of Agricultural and Food Chemistry, 2009, 57(19): 9234-9242.
[13] GUANG C, PHILLIPS R D. Purification, activity and sequence of angiotensinⅠconverting enzyme inhibitory peptide from alcalase hydrolysate of peanut flour[J]. Journal of Agricultural and Food Chemistry, 2009, 57(21): 10102-10106.
[14] SHEIH I C, FANG T J, WU T K. Isolation and characterisation of a novel angiotensin Ⅰ-converting enzyme (ACE) inhibitory peptide from the algae protein waste[J]. Food Chemistry, 2009, 115(1): 279-284.
[15] 黄峙, 向军俭, 郑文杰, 等. 钝顶螺旋藻富集转化硒及硒在藻体中的分布[J]. 植物生理学通讯, 2001, 37(1): 12-14.
Angiotensin Convert Enzyme Inhibition of Peptides Derived from Water Soluble Total Protein of Selenium-enriched Spirulina platensis
GAO Dong-fang,ZHANG Yi-bo,LING Qin-jie,ZOU Ying,HUANG Zhi*
(College of Life Science and Technology, Jinan University, Guangzhou 510632, China)
The water soluble total protein (TP) of selenium-enriched Spirulina platensis (SeSP), named as SeSP-TP, was extracted by phosphate buffer and then hydrolyzed by 5 different proteases to produce SeSP peptides (SeSP-Ps). The angiotensin convert enzyme (ACE) inhibition of SeSP-Ps was measured in vitro. The results showed that treatments with different proteases caused obvious difference of hydrolysis degree (HD) to SeSP-TP, and the combined use of pepsin, trypsin and chimotrypsin led to the highest H. Furthermore, we found that all SeSP-Ps produced by various proteases could inhibit ACE. The 50% ACE inhibition concentration (IC50) of SeSP-Ps derived from the combination of pepsin, trypsin and chimotrypsin was 74.6μg/mL, which was the lowest in comparison with SeSP-Ps obtained with each of the three enzymes or papain. The present results implied that the excellent functional food SeSP contains highly active dose-dependent ACE inhibition peptides.
angiotensin convert enzyme;Spirulina platensis;selenium;peptide
TS201.6
A
1002-6630(2011)07-0007-04
2010-07-04
国家自然科学基金项目(20975045;20675045);暨南大学大学生创新工程项目(cx10088)
高冬芳(1988—),女,本科生,研究方向为天然产物抗高血压活性。E-mail:2007051587@stu.jnu.edu.cn
*通信作者:黄峙(1968—),男,副教授,博士,研究方向为砷、硒等元素的活性形态及其作用机制。
E-mail:thsh@jnu.edu.cn

