花生根细胞悬浮培养制备白藜芦醇条件的优化
黄卫文,黎继烈,戴梓茹,李忠海
(1.中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2.中南林业科技大学生命科学与技术学院,湖南 长沙410004;3.钦州学院化学化工学院,广西 钦州 535000)
花生根细胞悬浮培养制备白藜芦醇条件的优化
黄卫文1,黎继烈2,戴梓茹3,李忠海1
(1.中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2.中南林业科技大学生命科学与技术学院,湖南 长沙410004;3.钦州学院化学化工学院,广西 钦州 535000)
以花生根愈伤组织为材料,采用二次通用旋转组合试验设计,优化花生根细胞悬浮培养产白藜芦醇的条件,探讨影响花生根细胞悬浮培养产白藜芦醇的最佳工艺参数。当摇床转速为130r/min、接种量为38.00g/L、pH5.80、蔗糖质量浓度为40.00g/L时,培养15d,花生根细胞增殖倍数最大为(4.71±0.04)倍,白藜芦醇产量达到907.3μg/g。
花生根细胞;愈伤组织;悬浮培养;白藜芦醇
白藜芦醇为非黄酮类多酚化合物,是一种低毒的天然药物,具有抗菌、抗炎、抗氧化、预防心脏病、抗癌、抗血小板凝聚、保护肝脏、免疫调节、防辐射、雌激素样作用、抗艾滋活性等优良的药理活性和保健功能[1-6]。广泛应用于食品、医药、保健品、化妆品、食品添加剂等领域。白藜芦醇在植物中以游离态或结合态存在,主要存在于葡萄、虎杖、花生、桑葚、朝鲜槐等植物中[7],但其在植物体内的含量普遍很低,即使应用一些环境诱导因素,如生物因素[8-10]和非生物因素[11-12]来提高白藜芦醇的含量,其效果也很有限。从天然植物中获取白藜芦醇面临着资源短缺的问题,寻找获取更多白藜芦醇的有效途径成为研究热点。植物细胞悬浮培养技术为利用植物细胞大规模培养生产有用次生代谢产物提供了有效途径与方法[13]。花生植株(尤其是根部)为白藜芦醇含量较高的植物[14-15],Medina-Bolivar等[16]从花生的毛状根组织培养液中检测到较高含量的白藜芦醇及其衍生物。本实验以花生植株(根部)为原料,通过二次回归通用旋转组合试验,建立花 生根细胞悬浮培养的回归模型方程,优化细胞悬浮培养的条件,为花生根细胞悬浮培养制备白藜芦醇提供参考依据。
1 材料与方法
1.1 材料、试剂与仪器
花生植株:分别选取广西玉林桂花、辽宁沈阳黑花、辽宁沈阳海花、湖南长沙红星等花生植株为外植体,进行愈伤组织诱导培养,并测定各愈伤组织中的白藜芦醇含量,选用白藜芦醇含量较高、开花后第40天的桂花根尖部分为实验材料。
磷酸、疏基乙醇、硼酸、聚乙烯吡咯烷酮、苯丙氨酸、愈创木酚、过氧化氢为食品级或分析纯。
UV-1700紫外分光光度计、UV-PROBE操作系统 日本岛津公司;VCX500超声波细胞粉碎仪 郑州长城科工贸有限公司。
1.2 方法
1.2.1 培养基
愈伤组织诱导培养基:以MS为基础培养基,附加30.00g/L蔗糖、9.00g/L琼脂、2.5mg/L 2,4-二氯苯氧乙酸(2,4-D)、 1.8mg/L 6-糠氨基嘌呤(KT)、3.0mg/L 6-苄氨基腺嘌呤(6-BA)。将培养基的pH值调至5.80,分装,于121℃、0.15MPa灭菌20min,冷却备用。
细胞悬浮种子培养基:MS培养基中添加2.5mg/L 2,4-D、1.8mg/L KT、3.0mg/L 6-BA、30.00g/L蔗糖,pH值调至5.80,加热,煮沸后分装于50mL三角瓶中,每瓶装20mL液体培养基,于121℃、0.15MPa灭菌20min,冷却备用。
1.2.2 愈伤组织诱导与细胞悬浮种子培养
选取健壮无病、品种为桂花的花生植株根部,冲洗干净,晾干表面水分,在超净工作台内用75%乙醇消毒30s,无菌水冲洗3次, 0.1% HgCl2消毒9min,无菌水冲洗6次,置于无菌滤纸上晾干,切成约1cm长的小段,接入1.2.1节愈伤组织诱导培养基中进行诱导培养,以不同浓度的激素对花生根愈伤组织诱导率的影响进行实验,确定最佳激素配比,并以此为基础配制花生根细胞悬浮培养的液体培养基[17]。培养条件:温度(25±1)℃,光照时间12h/d,每21d 继代一次。
将经过多次继代培养获得的花生根愈伤组织接种到1.2.1节细胞悬浮种子培养基中,接种量约为35.00g/L,置于摇床进行振荡培养,摇床转速为125r/min。培养过程中除去大的组织块和细胞团,获得生长均匀的细胞,以此作为悬浮培养种子细胞。
1.2.3 四元二次回归通用旋转组合试验设计
植物细胞悬浮培养的增殖受多种因素的影响,根据预实验对摇床转速、接种量、pH值、蔗糖质量浓度、培养温度、培养时间、液料比的单因素试验及其他试验条件的综合考察,本实验选择摇床转速(X1)、接种量(X2)、pH值(X3)、蔗糖质量浓度(X4)4个因素,以花生根细胞的增殖倍数(Y)为指标,通过四元二次回归通用旋转组合试验,建立数学回归方程模型,经过回归分析和方差分析,对数学模型进行检验寻优,确定悬浮培养体系的优化条件[18]。各因素编码和水平见表1。

表1 四元二次通用旋转组合试验因素水平表Table 1 Factor and levels in quadratic rotation combinatorial design
1.2.4 花生根细胞增殖倍数测定

式中:n为接种量/(g/L);ρ为收获的细胞质量浓度/ (g/L)。
花生根悬浮细胞干质量及白藜芦醇含量的测定参照文献[17]的方法。
1.2.5 数据处理
实验所得数据,采用SPSS 11.5统计分析软件进行分析,并利用Statistica 6.0软件绘出3D曲面图,分析各因素对花生根细胞悬浮培养体系细胞增殖的影响。
2 结果与分析
2.1 四元二次通用旋转组合试验结果
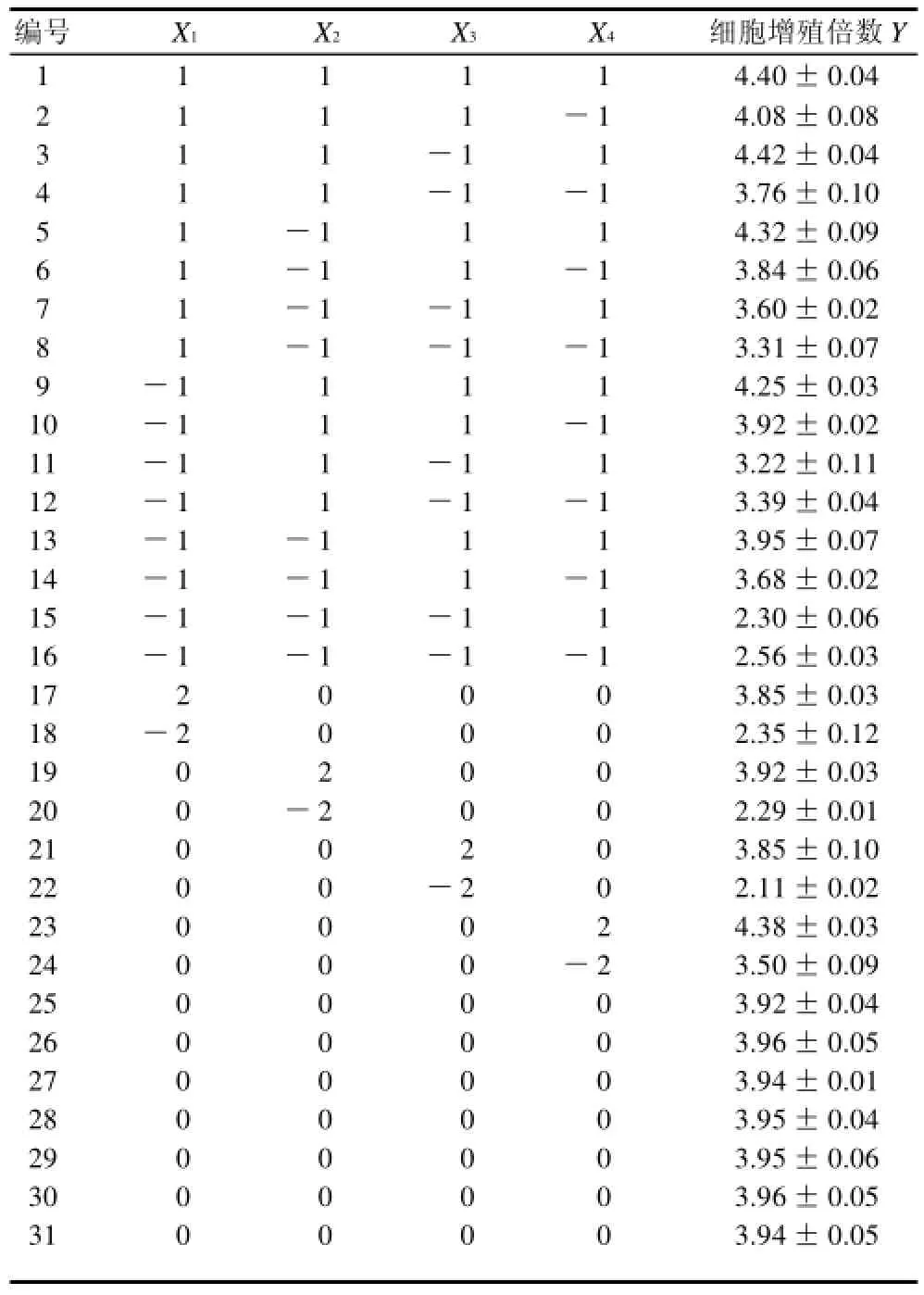
表2 四元二次通用旋转组合试验结果Table 2 Quadratic rotation combinatorial design scheme and experimental results
对表2数据进行回归分析,建立以花生根悬浮培养细胞的增殖倍数为目标函数的二次回归数学模型:
Y=3.946+0.311X1+0.298X2+0.389X3+0.153X4-0.044X1X2-0.173X1X3+0.099X1X4- 0.136X2X3+0.022X2X4+0.056X3X4-0.143X12-0.142X22-0.175X32+0.066X42
检验回归模型拟合度及其显著性,试验所得回归模型拟合度较好,R2=0.9025,表明回归模型较好地拟合了花生根悬浮培养细胞的增殖倍数与各因素之间的关系,模型得出的结果可靠。在显著性方面,P<0.001,达到极显著水平。同时对回归模型方程中各项进行方差分析,所得结果如表3所示。

表3 回归模型各项方差分析Table 3 Variance analysis of polynomial regression model
根据表3回归模型方程中各项方差分析结果,剔除不显著项,得到以细胞增殖倍数为目标函数的二次回归数学模型:

由回归方程中各因素系数绝对值可知,4个因素中对细胞增殖倍数的影响顺序为pH值>摇床转速>接种量>蔗糖质量浓度。
2.2 单因素效应分析
对单因素效应方程进行规划求解,得到花生根悬浮细胞增殖倍数的理论最大值和各因素的水平取值。摇床转速为142r/min、接种量为37.87g/L、pH值为5.82与蔗糖质量浓度为40.00g/L时,各自的增殖倍数达到最大,分别为4.11、4.10、4.16和4.25。如图1所示,细胞增殖倍数与摇床转速、接种量及pH值之间呈抛物线关系,随着各因素水平增加,花生根细胞增殖倍数表现为先增加后下降的趋势;花生根细胞增殖倍数与蔗糖质量浓度之间呈线性关系,随着蔗糖质量浓度水平的增加,花生根细胞增殖倍数也增加。

图1 单因素效应曲线Fig.1 Single factor-effect curves
2.3 各因素交互作用响应曲面模型分析
固定摇床转速、接种量、pH值和蔗糖质量浓度4个因素中的2个因素在0水平编码,代入简化回归模型方程,考察其他两个因素对花生根悬浮培养细胞增殖倍数的影响,绘出3D曲面图,结果图2所示。
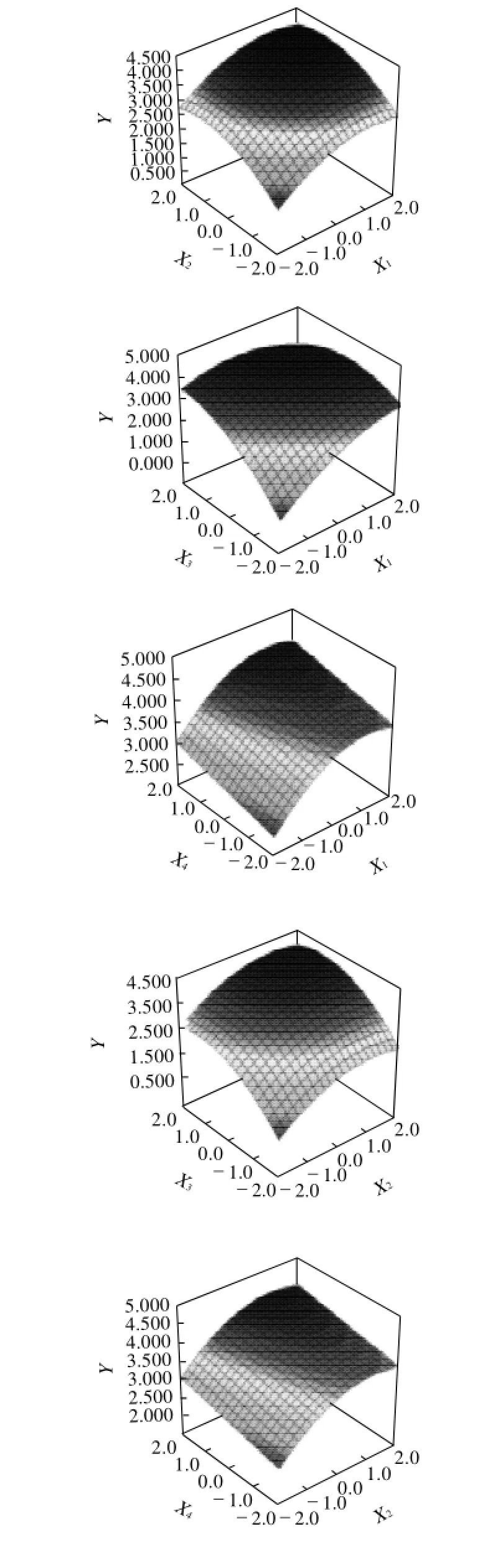

图2 各因素交互作用响应曲面图Fig.2 Response surface plots for the interactive effects of four factors on proliferation fold of suspension cells
在试验范围内,随着各因素水平的变动,增殖倍数的变化范围较大(>1.9倍),说明交互作用对增殖倍数影响较大,交互作用明显。当摇床转速编码值在-0.700~1.600、接种量编码值在0.400~1.700、pH值编码值在-0.500~2.000范围,蔗糖质量浓度编码值在2.000时,有利于细胞增殖倍数的提高,增殖倍数可达到4.66倍以上。各因素对提取效率均有影响,其中pH值和摇床转速对增殖倍数的影响效果最为显著。
2.4 模型寻优与验证实验
从2.3节响应面分析可知,响应值有最大值,X1、X2、X3、X4存在极值点,所以对模型进行响应因素的水平优化分析,得到4个因素的最优试验点(X1,X2,X3,X4)的代码值为(0.592,1.049,0.819,2.000),其相应真实值为(132,37.90,5.76,40.00),此时响应值的最大值是4.66倍。为方便操作,真实值可以分别取值(130,38.00,5.80,40.00)。
为了检验模型预测的准确性,分别取摇床转速130r/min,接种量38.00g/L,pH5.80,蔗糖质量浓度40.00g/L,培养15d,进行验证实验,实验重复5次,得到实验值为(4.71±0.04)倍,与理论值4.66倍基本一致,而且干质量的花生根细胞中白藜芦醇产量达到907.3μg/g,与自然生长的花生根(白藜芦醇含量94.3μg/g)[9]相比,白藜芦醇产量显著提高,由此表明建立的模型可靠。
3 结论与讨论
不同的植物细胞在培养过程中的培养条件及所需要的营养物质并不完全相同。本实验培养15d便可达到最大生物量,收获的细胞呈淡黄色,没有出现褐化或受到损伤等现象。说明在培养过程中,摇床转速所产生的溶氧能满足细胞的生长,而产生的剪切力没有对细胞造成伤害;接种量不仅能启动细胞的生长,且对营养物质的消耗适宜;pH值为5.80时,细胞增殖倍数最大,这可能是因为pH值影响培养细胞膜透性或代谢所致,其机理有待进一步研究;蔗糖质量浓度为40.00g/L时能够满足细胞的生长,且对细胞的生长和白藜芦醇的合成没有抑制作用,这说明花生根细胞能够耐受较高浓度的糖。
实验各因素对花生根细胞悬浮培养的细胞增殖倍数的影响顺序为pH值>摇床转速>接种量>蔗糖质量浓度。当摇床转速130r/min、接种量38.00g/L、pH5.80、蔗糖质量浓度40.00g/L时,培养15d,细胞增殖倍数达到(4.71±0.04)倍,干质量的花生根细胞中白藜芦醇产量达到907.3μg/g,建立的模型理论值与实验值相符,回归模型可靠,所优化的培养条件可明显提高花生根悬浮培养细胞中的白藜芦醇含量。
[1] 党尉, 尉亚辉, 曹炜. 白藜芦醇合酶的研究进展[J]. 植物学通报, 2003, 20(2): 152-159.
[2] MERTENS-TALCOTT S U, PERCIVAL S S. Ellagic acid and quartering interact synergistically with resveratrol in the induction of apoptosis and cause transient cell cycle arrest in human leukemia cells[J]. Cancer Lett, 2005, 218(2): 141-151.
[3] SIGNORELLI P, GHIDONI R. Resveratrol as an anticancer nutrient molecular basis, openqustions and promises[J]. Journal of Nutrient Biochemical, 2005, 16(8): 449-466.
[4] JUNG H J, HWANG I A, SUNG W S, et al. Fungicidal effect of resveratrol on human infectious fungi[J]. Arch Pharm Res, 2005, 28(5): 557-560.
[5] GEHM B D, MCANDREWS J M, CHIEN P Y, et al. Resveratrol, a polyphenolic compound found in grapes and wine, is an agonist for the estrogen receptor[J]. Proc Natl Acad Sci USA, 1997, 94(25): 14138-14143.
[6] NAKAGAWA H, KIYOZUKA Y, UEMURA Y, et al. Resveratrol inhibits human breast cancer cell growth and may mitigate the effect of linoleic acid, a potent breast cancer cell stimulator[J]. Cancer Res Clin Oncol, 2001, 127(4): 258-264.
[7] 张宏芳, 张秀琦, 郑建斌, 等. 葡萄酒中白藜芦醇的二次微分简易示波伏安法测定[J]. 分析测试学报, 2001, 20(2): 21-23.
[8] YEN G C, DUH P D, TSAI C L. Relationship between antioxidant activity and maturity of peanut hulls[J]. Journal of Agricultural and Food Chemistry, 1993, 41(1): 67-70.
[9] SOBOLEV V S, COLE R J, DOMER J W. Isolation, purification, and liquid chromatographic determination of stilbene phytoalexins in peanuts [J]. Journal of AOAC International, 1995, 78(5): 1177-1182.
[10] AGUAMAH G E, LANGCAKE P, LEWORTHY D P. Two novel stilbene phytoalexins from arachis hypogaea[J]. Phytochemistry, 1981, 20(6): 1381-1383.
[11] RAO P V S, WADIA K D R, STRANGE R N. Biotic and abiotic elicitation of phytoalexins in leaves of groundnut (Arachis hypogaea L.) [J]. Physiological and Molecular Plant Pathology, 1996, 49(5): 343-357.
[12] ARORA M K, STAGE R N. Phytoalexin accumulation in groundnuts in response to wounding[J]. Plant Science, 1991, 78(2): 157-160.
[13] VERPOORTE R, VARDER R, SCHRIPSEMA J. Plant cell biotechnology for the production of alkaloids: present status and prospect[J]. J Natural Product, 1993, 56 (2): 186-207.
[14] CHEN R S, WU P L, CHIOU R Y Y. Peanut roots as a source of resveratrol[J]. Journal of Agricultural and Food Chemistry, 2002, 50(6): 1665-1667.
[15] 王琴飞, 李景明, 张如莲. 花生中白藜芦醇及其衍生物的研究进展[J]. 中国粮油学报, 2009, 24(10): 145-152.
[16] MEDINA-BOLIVAR F, CONDORI J, RIMANDO A M, et al. Production and secretion of resveratrol in hairy root culture of peanut[J]. Phytochemistry, 2007, 68(14): 1992-2003.
[17] 黄卫文, 李忠海. 花生细胞悬浮培养物中白藜芦醇的积累调控与分离纯化[D]. 长沙: 中南林业科技大学, 2010.
[18] 刘建峰, 葛向阳, 梁运祥. 响应面法优化豆粕固态发酵工艺的研究[J]. 中国生物工程杂志, 2007, 27(6): 87-91.
Optimization of Suspension Culture Conditions for Preparing Resveratrol in Peanut Root Cells
HUANG Wei-wen1,LI Ji-lie2,DAI Zi-ru3, LI Zhong-hai1
(1. College of Food Science and Engineering, Central South University of Forestry and Technology, Changsha 410004, China;2. College of Life Science and Technology, Central South University of Forestry and Technology, Changsha 410004, China;3. College of Chemistry and Chemical Engineering, Qinzhou University, Qinzhou 535000, China)
Quadratic rotation combinatorial design was utilized to optimize suspension culture conditions for resveratrol production by peanut root callus tissue. Under the following optimized conditions: shaker rational speed 130 r/min; inoculum size 38.00 g/L; pH 5.80; and sucrose concentration 40.00 g/L, the maximum proliferation fold of suspension cells was 4.71 ± 0.04, and the resveratrol production reached 907.3 μg/g after 15-day incubation.
peanut root cell;callus;suspension culture;resveratrol
Q813
A
1002-6630(2011)07-0233-04
2010-06-05
湖南省教育厅科技项目(05C335)
黄卫文(1956—),男,高级实验师,博士,研究方向为食品生物技术。E-mail:hww5626@163.com

