陆生伊萨酵母降解L-苹果酸和柠檬酸的研究
文连奎,王立芳,王贵珍
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
陆生伊萨酵母降解L-苹果酸和柠檬酸的研究
文连奎,王立芳,王贵珍
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
利用陆生伊萨酵母对L-苹果酸和柠檬酸进行降解,考察菌株的耐受性,陆生伊萨酵母可耐受SO2的最大质量浓度为450mg/L、体积分数5%的酒精、最低pH值为2的酸度。对培养基进行优化,最佳氮源胰蛋白胨质量浓度为0.5g/100mL时,降酸率最高,达90%以上。对降酸条件进行优化,接种量在1.25×106~7.5×106CFU/mL范围内,培养时间为60h时,菌株对质量浓度为8~20g/L的L-苹果酸和质量浓度为8~12g/L柠檬酸降解率均达90%以上。
陆生伊萨酵母;降解;L-苹果酸;柠檬酸
L-苹果酸又名L-2-羟基丁二酸,主要存在于苹果、葡萄和不成熟的山楂等果实中[1];柠檬酸又名枸橼酸,主要存在于柠檬、柑橘、菠萝、山楂等果实中[2]。利用这些含酸量高的果实生产的果汁和果酒会有酸涩感,影响产品品质。此外,L-苹果酸和柠檬酸生产企业排放的废弃物酸度太高,对环境造成了严重污染,必须进行降酸才能达到国家规定的排放标准。采用稀释法降酸,会降低果汁和果酒的营养价值,采用阴离子交换树脂[3-4]、碳酸钙沉淀[5]、碱中和[6]、电渗析[7-8]等物理和化学方法降酸,会使饮料或果酒口感差,因此现代降酸研究和发展的方向是微生物降酸法。目前关于降酸微生物的报道大多是针对苹果酸,如葡萄酒生产中利用酒明串珠菌(Leuconostoc oenos)在无氧条件下利用苹果酸产生乳酸和CO2,但几乎不利用柠檬酸[9-11],因此在以柠檬酸为主的果汁中不能发挥作用;肠膜明串珠菌乳脂亚种(Leu.mesenteroides subsp.cremoris)在无氧条件下能分解柠檬酸,生成乙酸,CO2和双乙酰[12-13],若柠檬酸含量较高,产生的双乙酰足以产生不良的风味。而同时针对苹果酸和柠檬酸的研究却很少。
陆生伊萨酵母(Issatchenkia terricola)为酵母科伊萨酵母属陆生伊萨种[14]。关于陆生伊萨酵母的报道很少,惠丰立等[15]筛选得到一株具有抗菌活性的陆生伊萨酵母,而利用该菌株进行降酸的研究还未见报道。本实验以前期筛选到的陆生伊萨酵母为出发菌株对其耐受性及降酸条件进行研究。
1 材料与方法
1.1 酵母、培养基与试剂
酵母由本实验室于葡萄园土壤中筛选获得,经形态学和分子生物学鉴定其为陆生伊萨酵母(Issatchenkia terricola)[16]。
WL营养培养基:酵母浸粉 0.4g、胰蛋白胨 0.5g、KH2PO40.055g、KCl 0.0425g、无水CaCl20.0125g、FeCl30.00025g、MgSO40.0125g、MnSO40.0002g,蒸馏水100mL,L-苹果酸或柠檬酸按需加入;保藏培养基:YPD培养基。
L-苹果酸(分析纯)、柠檬酸(分析纯) 美国Bio Basic公司;其他试剂如酵母浸粉、KH2PO4、FeCl3等均为化学纯。
1.2 方法
1.2.1 耐受性实验
将处于对数生长期的菌悬液,以相同接种量分别接种于含不同质量浓度SO2、酒精体积分数和pH值的WL营养培养基中,30℃、150r/min振荡培养24h,取菌液测定OD600nm(以未接菌的WL营养培养基作空白对照),确定菌株对SO2、酒精和酸度的耐受性。
1.2.2 降酸培养基成分优化
以WL营养培养基为基础培养基,分别以质量浓度为10g/L L-苹果酸和柠檬酸作为唯一碳源,然后以0.5g/100mL水平分别添加胰蛋白胨、牛肉膏、尿素、(NH4)2SO4、NaNO3,将菌株以相同接种量接入培养基,以150r/min、30℃摇床培养48h后测定菌株对L-苹果酸和柠檬酸的降解率,确定菌株所利用的最佳氮源;最后调节最佳氮源的质量浓度分别为0.3、0.5、0.7、0.9、1.1g/100mL,以同样条件培养,确定最佳氮源的加入量。
1.2.3 降酸条件优化
1.2.3.1 酸质量浓度对降酸的影响
以WL营养培养基为基础培养基,调节L-苹果酸和柠檬酸的质量浓度分别为4、6、8、10、12、14、16、18、20g/L,将菌株以5×106CFU/mL分别接入100mL液体培养基中,30℃、150r/min摇床培养48h后测定降酸率,确定酸质量浓度对降酸的影响。
1.2.3.2 接种量对降酸的影响
L-苹果酸和柠檬酸添加量为10g/L,接种量分别为:1.25×106、2.5×106、3.75×106、5×106、6.25×106、7.5×106CFU/mL,30℃、150r/min摇床培养,每隔10h测定不同接种量对L-苹果酸和柠檬酸的降解率,确定最佳接种量。
1.2.3.3 菌株的最佳降酸时间
L-苹果酸和柠檬酸添加量为10g/L,以1.2.3.2节的最佳接种量接入100mL液体培养基中,30℃、150r/min摇床培养,每隔10h测定降酸率,确定菌株对L-苹果酸和柠檬酸的最佳降解时间。
1.3 指标测定方法
菌体的生物量测定采用分光光度法,以最大吸收波长600nm处菌液的光密度表示菌体的数量,以OD600nm表示[17]。
酸度测定采用NaOH滴定法[18](以苹果酸或柠檬酸计,单位g/L)。
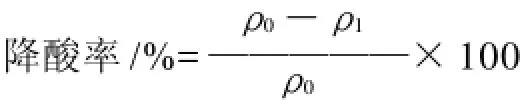
式中:ρ0为降解前苹果酸(柠檬酸)的质量浓度;ρ1为降解后苹果酸(柠檬酸)的质量浓度。
2 结果与分析
2.1 耐受性实验
2.1.1 菌株对SO2的耐受性
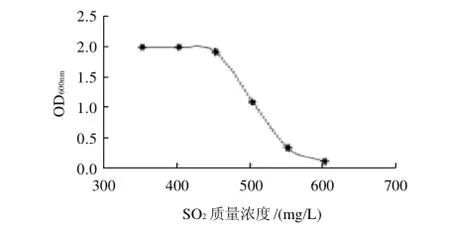
图1 SO2质量浓度对菌株生长的影响Fig.1 Effect of SO2concentration on the growth of Issatchenkia terricola
由图1可知,在SO2质量浓度≤450mg/L时,菌体的生长基本不被抑制;SO2质量浓度>450mg/L时,菌体数量急剧下降,因此菌株能耐受SO2的最高质量浓度为450mg/L。由于SO2的通入量一般在60~100mg/L范围内,就可以抑制其他菌的生长[19],因此该菌株有足够的耐受SO2的能力。
2.1.2 菌株对酒精的耐受性
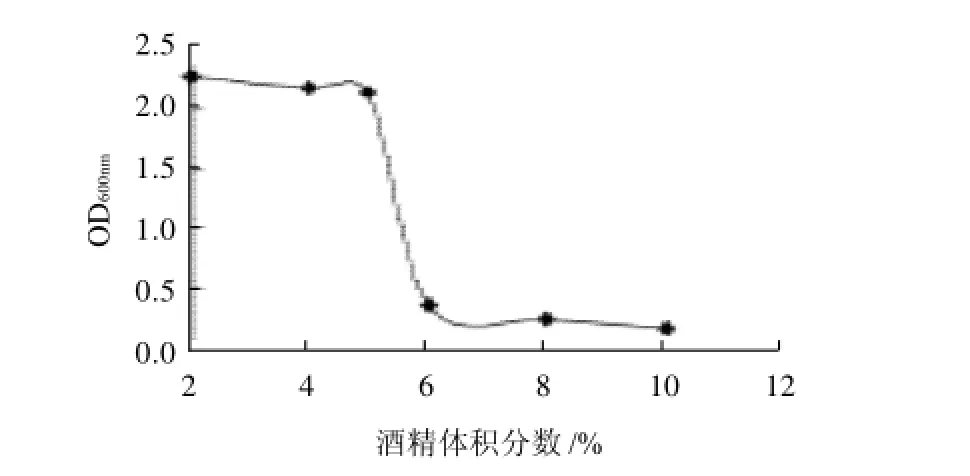
图2 酒精体积分数对菌株生长的影响Fig.2 Effect of alcohol concentration on the growth of Issatchenkia terricola
由图2可知,在酒精体积分数≤5%时,菌体的生长基本不被抑制;酒精体积分数>5%时,菌体数量急剧下降,因此菌株能耐受的最高酒精体积分数为5%。菌株不能耐受较高的酒精度,因此在发酵降酸时,可以考虑在酒精发酵前接入该菌株进行降酸。如果为了防止该菌株降酸过度,也可以利用体积分数大于5%的酒精来抑制菌株的生长,从而抑制酸度的进一步降低。
2.1.3 菌株对酸度的耐受性
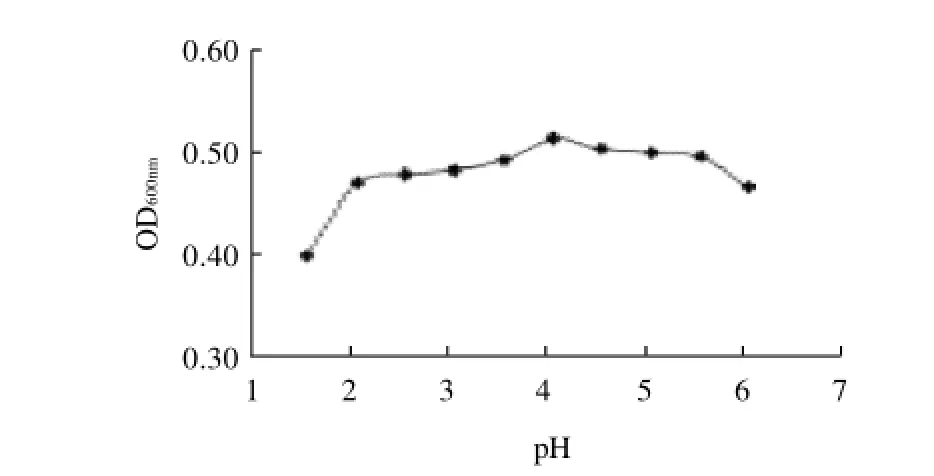
图3 培养液pH值对菌株生长的影响Fig.3 Effect of medium pH on the growth of Issatchenkia terricola
pH值能够改变营养物质的电离程度,从而影响细胞对营养物质的吸收,最终影响菌体的生长。由图3可知,在pH 2~5.5范围内酸度对菌株的生长抑制较弱,而在pH<2和pH>5.5时菌体数量均开始减少,因此菌株能耐受的最低pH值为2,可适用于高酸度果酒、果汁中。
2.2 降酸培养基成分的优化
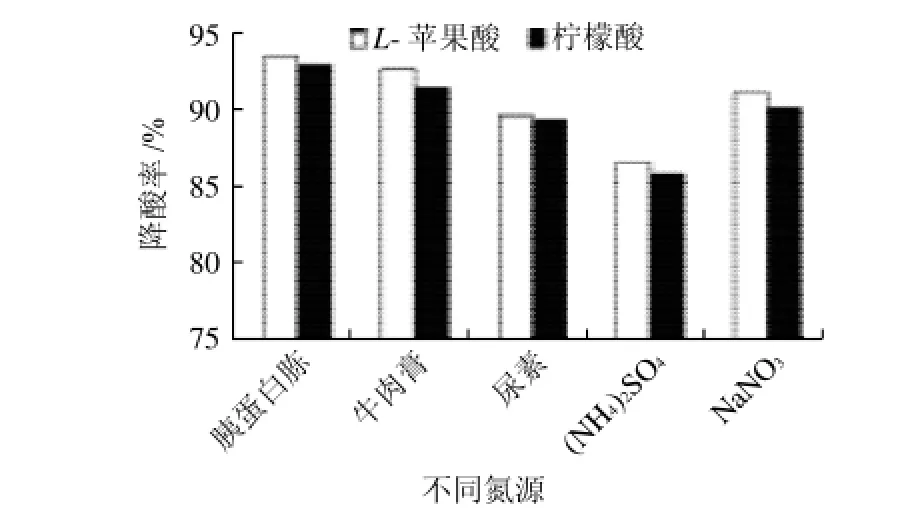
图4 不同氮源对菌株降酸的影响Fig.4 Effect of different nitrogen sources on deacidification rates of L-malic acid and citric acid
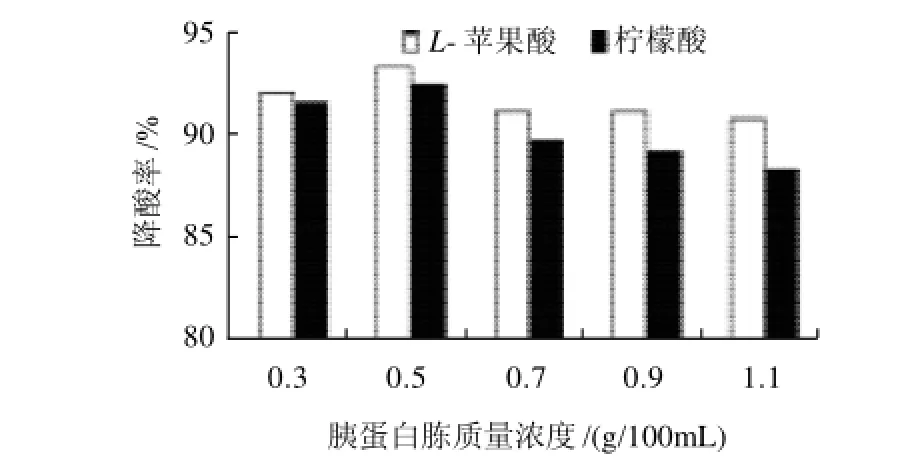
图5 不同质量浓度的胰蛋白胨对菌株降酸的影响Fig.5 Effect of tryptone concentration on deacidification rates of L-malic acid and citric acid
由图4~5可知,与无机氮源相比,有机氮源更有利于酸度的降低,添加0.5g/100mL胰蛋白胨时,菌株的降酸率最高,可达90%以上。
2.3 降酸工艺条件优化
2.3.1 酸质量浓度对降酸的影响
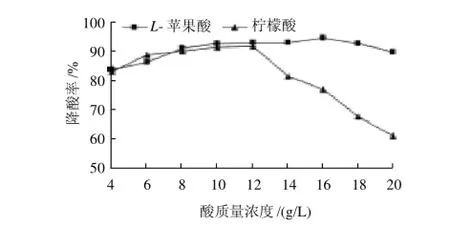
图6 L-苹果酸和柠檬酸质量浓度对降酸的影响Fig.6 Effects of L-malic acid and critic acid concentrations on their deacidification rates
由图6可知,在质量浓度4~12g/L范围内菌株对L-苹果酸和柠檬酸的降解能力相差不大;当超过12g/L时,菌株对L-苹果酸的降解能力变化不大,但对柠檬酸的降解能力却明显减弱,这说明柠檬酸质量浓度大于12g/L时,已不利于菌株代谢产生的降酸酶发挥作用,L-苹果酸则对其影响不大。随着酸质量浓度的增大,降酸率呈现先增后减的趋势,主要是由于pH值的变化,影响了菌体的生长,从而影响了菌株的降酸速率。传代培养10代后,测得其降酸性能仍较稳定。
2.3.2 接种量对降酸的影响
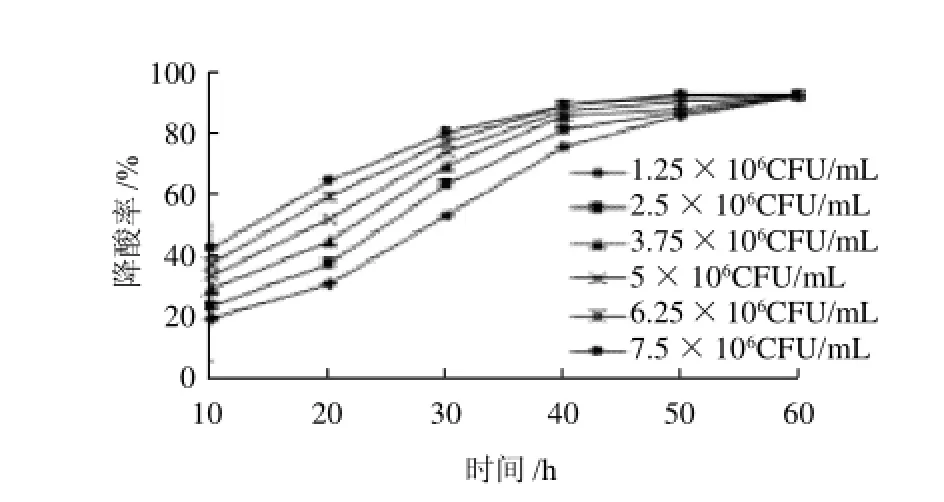
图7 接种量对菌株降解L-苹果酸的影响Fig.7 Effect of inoculum size on deacidification rate of L-malic acid
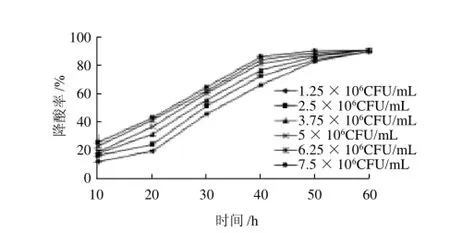
图8 接种量对菌株降解柠檬酸的影响Fig.8 Effect of inoculum size on deacidification rate of citric acid
由图7可知,随着接种量的增加,菌株生长延缓期缩短,接种量大的对L-苹果酸的降解率较高,但是随着时间的延长,由接种量产生的降解率差异越来越小,当培养60h时,降解率几乎持平,接种量对柠檬酸的降解情况也是如此(图8)。由此说明,接种量对降酸率的影响不大,但要缩短延缓期,接种量应大于106CFU/mL。
2.3.3 菌株降酸的最佳时间
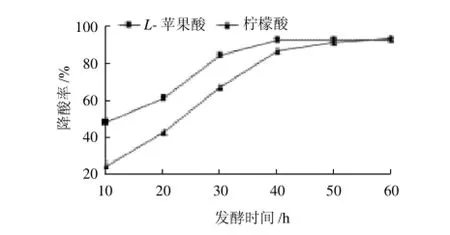
图9 菌株降酸的最佳时间Fig.9 Time course of degradation of L-malic acid and citric acid during fermentation
由图9可知,随着发酵时间的延长,菌株对L-苹果酸和柠檬酸的降解率都逐渐增大,但菌株对L-苹果酸的降解率明显高于柠檬酸,说明与柠檬酸相比,菌株更容易利用L-苹果酸。当发酵60h时菌株对两者的降酸率达到最高,均为93%。因此,菌株降酸的最佳时间为60h。
3 结 论
陆生伊萨酵母能耐受SO2的最大质量浓度为450mg/L,酒精体积分数为5%,最低pH值为2。对降酸培养基进行优化,胰蛋白胨质量浓度为0.5g/mL时,菌株对L-苹果酸和柠檬酸的降解率最高,均达90%以上。
对降酸条件进行优化,在30℃、150r/min条件下培养,L-苹果酸质量浓度为8~20g/L或柠檬酸质量浓度为8~12g/L时,菌株的降酸率最高,均达90%以上;对1.25×106~7.5×106CFU/mL范围的接种量进行实验,结果表明此范围的接种量对降酸率影响不大;当培养60h时菌株对两种酸的降解率达到最高,均为93%,因此最佳降酸时间为60h。
[1] SWEETMAN C, DELUC L G, CRAMER G R, et al. Regulation of malate metabolism in grape berry and other developing fruits[J]. Phytochemistry, 2009, 70(11/12): 1329-1344.
[2] POPOVA T N, de CARVALHO M A A P. Citrate and isocitrate in plant metabolism[J]. Biochimica et Biophysica Acta (BBA) - Bioenergetics, 1998, 1364(3): 307-325.
[3] VERA E, DORNIER M, RUALES J, et al. Comparison between different ion exchange resins for the deacidification of passion fruit juice[J]. Food Engineering, 2003, 57(2): 199-207.
[4] 易建华, 朱振宝, 仇农学, 等. 苹果汁中果酸(苹果酸)的分离(I)-果酸在LSI-1031阴离子交换树脂上交换吸附行为的研究[J]. 食品科技, 2003(12): 17-20.
[5] 王华, 李维新. 猕猴桃干酒的降酸研究[J]. 食品科学, 2001, 22(9): 29-31.
[6] 杨少海. 化学降酸对葡萄酒感官品质的影响[J]. 中外葡萄与葡萄酒, 2002(4): 63-64.
[7] VERA E, RUALES J, DORNIER M, et al. Deacidification of clarified passion fruit juice using different configurations of electrodialysis[J]. J Chen Technol Biotechnol, 2003, 78(8): 918-925.
[8] NOVALIE S, OWKOR J, KULBE K D. The characteristics of citric acid separation using electro dialysis with bipolar membranes[J]. Desalination, 1996, 105(3): 277-282.
[9] CORTE-REAL M, LEAO C. Deacidification of grape juice with derepressed mutants of the yeast Hnasenula anomala[J]. J APP Micro and Biotechnol, 1992, 36(5): 663-666.
[10] 李小刚, 张春娅, 王树生, 等. 苹果酸-乳酸发酵与葡萄酒的风味改良[J]. 中外葡萄与葡萄酒, 2002(1): 12-14.
[11] 高年发, 李小刚, 杨枫. 葡萄及葡萄酒中的有机酸及降酸研究[J]. 中外葡萄与葡萄酒, 1999(4): 6-11.
[12] VILJAKAINEN S, LAAKSO S. Acidity reduction in northern region berry juices by the malolactic bacterium Oenococcus oeni[J]. Eur Food Res and Technol, 2002, 214(5): 412-417.
[13] VILJAKAINEN S, LAAKSO S V. The use of malolactic oenococcus oeni(ATCC 39401) for deacidification of media containg glucose, malic acid citric acid[J]. Eur Food Res Technol, 2000, 211(6): 438-442.
[14] BAMETT J A, PAYNE R W, YARROW D. 酵母菌的特征与鉴定手册[M]. 胡瑞卿, 译. 青岛: 青岛海洋大学出版社, 1991: 61.
[15] 惠丰立, 冯金荣, 杨柯金, 等. 产几丁质酶酵母菌的筛选及鉴定[J].东北林业大学学报, 2007, 35(8): 66-70.
[16] 王立芳, 张微, 文连奎. 可降解L-苹果酸和柠檬酸菌株的筛选及鉴定[J]. 食品科学, 2010, 31(21): 279-282.
[17] 刘慧. 现代食品微生物学实验技术[M]. 北京: 中国工业出版社, 2006: 68.
[18] 全国食品发酵标准化中心中国标准出版社第一编辑室. 中国食品工业标准汇编: 饮料酒卷[M]. 北京: 中国标准出版社, 2000: 217-218.
[19] 周浓. SO2添加量和添加方式对菠萝果酒品质的影响[J]. 食品工业, 2006(4): 22-24.
Degradation of L-Malic and Critic Acids by Issatchenkia terricola
WEN Lian-kui,WANG Li-fang,WANG Gui-zhen
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
The degradation potential of Issatchenkia terricola fermentation to L-malic acid and citric acid was explored. The maximum concentrations of SO2and alcohol and the minimum pH level that the strain could tolerate were 450 mg/L, 5% and 2, respectively. The medium and fermentation conditions for the degradation of both acids by the strain were optimized based on deacidification rate. When the concentration of the determined optimum nitrogen source tryptone was 0.5 g/100 mL, the deacidification rate reached its maximum level, over 90%. The optimum inoculum size and incubation duration were 1.25 × 106-7.5 × 106CFU/mL and 60 h, respectively, and the resulting degradation rates of 8-20 g/L L-malic acid and 8-12 g/L critic acid reached over 90%.
Issatchenkia terricola;degradation;L-malic acid;critic acid
TS261.1
A
1002-6630(2011)07-0220-04
2010-08-28
吉林省科技厅重点项目(20090228)
文连奎(1962—),男,教授,博士,主要从事长白山野生植物资源的开发利用研究。E-mail:wenliankui@163.com

